热门问题
时间线
聊天
视角
朊毒體
由蛋白質構成的致病因子,且具自我複製並具感染性 来自维基百科,自由的百科全书
Remove ads
朊毒體疾病(傳染性海綿狀腦病)和阿茲海默症、帕金森氏症同屬於神經退化性疾病,可能擁有類似的致病機制。它雖然不含核酸,但可自我複製且具有感染性。這是因為朊毒體雖然是由蛋白質構成,但相較於普通蛋白質更為穩定,無法以一般物理或化學消毒法去除感染性。以120 ~ 130℃加熱4小時、紫外線照射、甲醛均不能將這種蛋白質變性。它對蛋白酶有抗性[13],但不能抵抗高濃度的蛋白質強變性劑,如苯酚、尿酸[14]。
朊毒體最早發現於哺乳動物的傳染性海綿狀腦病,包括羊搔癢症、瘋牛病、慢性消耗病,以及人類的克雅二氏病(包含散發性、家族性、與變異型克-雅二氏病)、致死性家族失眠症,和於食人部落發現的庫魯病。所有傳染性海綿狀腦病目前均無法醫治。變異型克-雅二氏病為由牛傳染人的跨物種疾病,透過食用已感染狂牛症的牛隻的肉或其內臟製品感染。該病原體由飲食攝入後會穿越血腦屏障,緩慢破壞腦組織結構,最終導致患者死亡。
朊毒體由錯誤折疊的朊粒蛋白聚集組成。它能夠誘導在神經細胞上原本是正常結構的朊粒蛋白,轉變為錯誤結構的分子(而化學上更為穩定),並進行聚集反應,藉由這個機制引入新的朊毒體蛋白,不斷自我複製並傳遞至鄰近細胞,最終擴散至整個腦部。由組織染色法發現,聚集的朊毒體蛋白會於神經細胞外形成類澱粉沉澱,並伴隨神經細胞死亡,造成腦組織空洞化。
Remove ads
名稱
術語朊毒體(prion)或朊粒,是參照病毒體(virion)或病毒粒而命名,後綴-on有「體、粒、子」 之義。在過去未知其性質,也稱毒朊[15]、朊病毒、蛋白感染粒(proteinaceous infectious particle[16][17])、蛋白侵染子、傳染性蛋白顆粒[18]、普恩蛋白等等,這些術語已漸少用。此外,現在已知它不是病毒,而是僅由蛋白質構成的致病因子,因此稱朊「病毒」可能造成誤解。
朊毒體最早是史坦利·布魯希納於1982年提出「prion」一詞,以代表其自我複製能力,並能夠傳遞本身錯誤結構給其它朊毒體蛋白[19]。英語中的prion是由 "pr"otein 和 infect"ion" 拼接而成的混成詞,全稱是proteinaceous infectious particle[20],為「蛋白質感染顆粒」之意。
譯名「朊病毒」由中國蛋白質生化專家曹天欽提出,中文的「朊」為蛋白質的別稱[21]。中國全國科技名詞委2006年出版的《遺傳學名詞》第二版則將Prion的譯名定為「普里昂」或「朊粒」[21],2009年《生物化學與分子生物學名詞》第二版則又定名為「朊病毒」[22]。因「朊病毒」之名易產生該病原為病毒之誤解,又有學者提出「朊粒」、「朊毒」、「朊毒體」等譯名[23][24][25]。
Remove ads
朊粒蛋白
在發現朊粒蛋白之前,所有已知傳染病的病原體都是微生物,意即有可複製的遺傳物質(核酸),例如細菌、病毒、真菌、原生動物等。早期針對羊搔癢症的研究顯示它可能是由一種「濾過性病毒」造成[26]。於1960年和1967年,Tikvah Alper與John S. Griffith分別提出了羊搔癢症的感染因子可能僅僅由蛋白質所組成[27][28],Griffith進一步提出十分重要的假設,認為這種病原體是由蛋白質本身的錯誤折疊所造成,但當時並未受到重視。
於1982年,美國加州大學舊金山分校的史坦利·布魯希納進一步從感染羊搔癢症的羊腦樣品純化感染因子。在將細菌、病毒和核酸等成分去除之後,他發現剩下的蛋白質仍具有感染性。在排除了病毒與類病毒(viroids)的可能後,他證明該病是由蛋白質所造成,並將這種新發現的病原體稱為朊毒體,而組成的蛋白稱為朊粒蛋白(prion protein,PrP)[29]。當時有許多質疑者認為傳染源為於蛋白質中殘留的病毒,但他們重複的實驗證實了布魯希納的結論。布魯希納的後續研究表明,錯誤結構的朊毒體蛋白(PrPSc)和正常結構的PrPC是由相同基因表現而來,有相同的一級結構(胺基酸序列),但三級結構(立體結構)不同[30]。這項發現打破了之前由克里斯琴·B·安芬森提出的「蛋白質的一級結構決定其立體結構」(一條序列一種結構)的理論[31]。
目前科學界已經普遍接受朊毒體蛋白的結構轉變(由PrPC轉變為PrPSc)是造成朊毒體疾病和其傳染性的原因。在後續的研究中,有非常多的證據支持朊毒體僅由蛋白質所構成這一假設(Protein-only hypothesis)[32]。近十年來,通過對其它神經退行性疾病的研究,科學界認為這類疾病(如阿茲海默症與帕金森氏症)的致病機制都擁有類似朊毒體的性質,因此朊毒體已經成為這個領域中很重要的概念[33][34][35]。
由於發現朊毒體以及對於這種新傳染模式的研究,布魯希納獲得了1997年的諾貝爾生理學或醫學獎[36][37]。
正常結構的朊毒體蛋白(PrPC)是一個有209個胺基酸殘基(以人類序列為例,下同)的醣蛋白 ,約33-35 kDa,由一個糖磷脂醯肌醇(GPI)固定在神經細胞膜的外表面[38]。蛋白質的N端 (序列23-134) 沒有特定構型,在轉譯後修飾後將頭尾兩個信號肽 (序列 1-22 及 231-254) 切除,擁有八個重複的胺基酸片段 (序列: PHGGGWGQ) 可結合Cu2+[39]。而C端 (序列135-230) 主要以三個α螺旋構成,Cys179和214之間有雙硫鍵連結第二個和第三個α螺旋[39]。在Asn181和197的位置會因為醣化而形成無醣、一個多醣、兩個多醣等三種衍生型[40][41]。最近的研究顯示多醣的種類對朊毒體的複製速率和其感染性有重要影響[42]。
正常的朊毒體蛋白由PRNP基因所表現。它在中央神經系統的細胞膜外表面有大量表現,在免疫系統、骨髓、血液和周圍神經系統中也有發現[43]。然而這個蛋白質的功能尚不清楚。小鼠研究初步顯示缺乏PRNP基因對整體表徵沒有影響[44]。許多研究推測朊毒體蛋白在細胞中扮演不同的角色,包括維持神經軸突上的髓磷脂[45],或是與T細胞、巨噬細胞、樹突細胞分化,或是刺激幹細胞的功能分化[46]。
致病機制

對朊毒體蛋白如何致病的研究尚有許多未知領域。根據目前被普遍接受的蛋白質唯一假設 (Protein-only hypothesis),身為致病因子的朊毒體由大量β摺疊構成的不正常構型PrPSc取代α螺旋[47],而且這些錯誤結構的PrPSc蛋白質會導致正常以α螺旋為主結構的PrPC蛋白質也轉變結構成為PrPSc,如此不斷複製;而錯誤結構的PrPSc不再是一般易溶於水的蛋白質單體,而是由於其疏水的性質而產生蛋白質聚集現象[29][38][48][49]。最終形成可見的類澱粉蛋白斑塊(經常以纖維的形態出現)堆積在腦部神經細胞外。這種聚集的蛋白質很難被細胞內的清除系統如蛋白酶體或溶酶體所清除,而且被認為有神經毒性,因此造成腦神經細胞死亡和組織空洞化的現象[38]。
在其它的神經退化性疾病中,蛋白質不正常摺疊和聚集現象也被普遍發現是致病原因,例如阿茲海默症、帕金森氏症、肌萎縮性脊髓側索硬化症(ALS)、亨丁頓舞蹈症、家族性澱粉樣物多發性神經病變(FAP);除此之外,在非神經疾病的2型糖尿病中也有被發現[50][51]。
蛋白質聚集的過程可以用成核-聚合反應(Nucleation-dependent polymerization)[52]來解釋:
Remove ads
朊毒體疾病
朊毒體蛋白導致的疾病統稱為傳染性海綿狀腦病,且在許多哺乳動物均有發現,目前無法治癒。哺乳動物的朊毒體疾病主要有羊搔癢症、牛腦海綿狀病變 (或稱狂牛症) 、鹿纇的慢性消耗病等。人類的朊毒體疾病包括克-雅二氏病(包含散發性、家族性、與變異型克-雅二氏病),致死性家族失眠症,和於食人部落發現的庫魯病。朊毒體疾病和其它相關的神經退行性疾病不同處在於具有感染性,且有跨物種感染的現象。
朊毒體疾病在18世紀已經有記述,最早觀察到的羊搔癢症在1759年由一篇德意志地區的文獻記載,"受感染的動物會跪下、用牠們的背去摩擦樁木,精神不佳且不進食,最後死亡"。文獻也記錄到牧羊人必須隔離這些受影響的羊隻,否則會造成其它羊群的嚴重傳染[60]。19世紀後,歐洲的獸醫開始研究羊搔癢症,Besnoit在1899年發現它在病理學上的主要病徵是腦神經組織的空洞化(Vacuolation)[60][61]。1936年,Cullѐ和Chelle藉由將受感染羊隻的腦及腦幹組織移入健康羊隻並使其感染,證明羊搔癢症具有感染性[60][61]。1961年,在實驗用小鼠上也證明同樣的致病因子會造成感染,這個實驗同時證明了致病因子(隨後由史坦利·布魯希納在1982年發現是朊毒體)具有跨物種傳染的能力[62]。在小鼠研究的成功也讓科學家從此可以不用綿羊或山羊,而是使用更容易操作的小鼠進行朊毒體的研究。 人類的朊毒體疾病最早由一位美國獸醫Hadlow在1959年發現。他在巴布亞新幾內亞的一個食人部落發現他們參與過食人儀式後的人會產生類似羊搔癢症的不正常抽搐現象,並命名為庫魯病(英語:Kuru disease,源自當地語言的 kuria 或 guria,意即顫抖)。在1968年Klatzo根據對庫魯病人的腦部研究,認為早在1920年代發現的人類克雅氏病也有類似庫魯病的性質。隨後進一步的研究發現了更多種類的庫賈氏症,如致死性家族失眠症和家族性克-雅二氏病。最終他們都被歸類於傳染性海綿狀腦病之下[60][61]。
1980年代末期英國爆發了嚴重的狂牛症疫情,當時許多牛隻因為吃入含有受感染的牛骨粉飼料導致大量群聚感染。之後許多人再攝入感染的牛肉類製品也因此染病,這種新型的人類庫賈氏症被稱為變異型克-雅二氏病(vCJD),同時也是第一次發現朊毒體疾病能夠跨物種傳染[61]。至2011年沒有出現新病例為止,全世界有228例變異型克-雅二氏病患者,其中有176例為英國居民[63]。
Remove ads

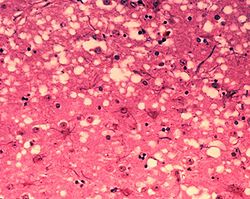
人類克-雅二氏病的症狀包括逐漸喪失腦部功能與行動能力、不正常的抽搐、痴呆、口齒不清、共濟失調(平衡和協調功能障礙)、行為或人格改變[64]。神經病理學上主要的特徵是在發病過程中的腦神經細胞會逐漸死亡,因此在組織中形成微小的「空洞」看起來猶如海綿一般。由免疫組織染色法可以發現由朊毒體蛋白聚集而成的類澱粉蛋白堆積在腦部神經細胞外,並形成可觀察到的斑塊[65]。其他改變還包括星形膠質細胞與小神經膠質細胞被激發而造成神經發炎反應[66]。
變異型克-雅二氏病的平均潛伏期是16.7年[67],而由食人部落所發現的庫魯病平均潛伏期是10.3-13.2年,但有極少數會超過40年[68]。值得注意的是,由於對於變異型克-雅二氏病的研究較多(源於1990年代英國爆發狂牛症),擁有特別基因突變的人可能會因為有更長的潛伏期而尚未發病。一旦出現不適症狀後,病情會快速進展,導致腦損傷和死亡。人類朊毒體疾病的傳染途徑包括:未知的散發型發病(sCJD, 佔80-90%)、攝食受狂牛症感染的牛隻食品(vCJD)、醫源性傳染(iCJD),還有大約有15%的患者為家族遺傳(fCJD);極少數是由於儀式中的食人行為傳染(庫魯病)[13][69][70][71]。多數人在發病後一年內會死亡,但是許多病人的死因是發病導致的其它呼吸道或全身感染[64][72]。
Remove ads
朊毒體蛋白的其他研究成果
1965年,布萊恩·科克斯(英語:Brian Cox)在酵母菌發現了一種奇怪的遺傳,並稱為[PSI+]因子([PSI+] element)。1994年,里德·維克納(英語:Reed Wickner)經由研究釀酒酵母 (Saccharomyces cerevisiae) 提出假說,認為[PSI+]和另一個遺傳因子[URE3]是分別由Sup35p和Ure2p蛋白引起,並具有類似朊毒體能夠自我複製的特性,因此稱為酵母朊毒體(yeast prions)[78]。很快地,Susan Lindquist注意到一種熱休克蛋白(heat shock protein,可以幫助其它蛋白質正確摺疊的蛋白質),Hsp 104可以減少[PSI+]的影響[79]。她隨後的研究顯示[PSI+]在酵母菌中不具有毒性,而且藉由改變特定的胺基酸序列能夠幫助Sup35p蛋白在正常的[PSI-]結構,和有類似朊毒體性質 (意指可自我複製) 的[PSI+] 結構之間轉變[80]。她進一步認為某些具有類似朊毒體性質的蛋白質可能在某些情況下是有利的,因而使得這種性質在演化中得以保留[81]。
除了朊毒體疾病以外,其它的神經退化性疾病的致病因子: 阿茲海默症的Aβ胜肽、帕金森氏症的 α-synuclein、肌萎縮性脊髓側索硬化症 (ALS)的superoxide dismutase 1、亨丁頓舞蹈症的huntingtin蛋白片段、家族性澱粉樣物多發性神經病變 (FAP) 的transthyretin ,和非神經疾病的2型糖尿病的胰島素,都有類似朊毒體的自我複製機制,由蛋白質錯誤折疊和聚集反應造成組織細胞死亡[50][51]。
但不是所有類似朊毒體性質的蛋白質都是危險的。事實上,它們存在於很多植物和動物中。正因為如此,科學家認為這些變形的蛋白質一定為它們的宿主帶來了一些好處。這個假設在對一種特定的蘚類植物進行研究的時候被證實。正常情況下,當一個地方的蘚與另一個地方的蘚長得足夠它們的外層細胞相接觸時,病毒會從一個受感染的蘚的部分傳播到另一個沒有受感染的蘚的部分。但是,朊粒蛋白似乎會繞到被感染的蘚的邊緣部分。這可以引起蘚邊緣部分的細胞死亡,從而形成一個屏障,阻止病毒穿過,從而避免受到感染。
儘管會導致疾病,但通過對朊毒體蛋白的研究,科學家發現了一些具有β摺疊結構的多肽具有自聚集的性質,既然可以自聚集形成纖維,這就為納米材料的製造提供了新的研究思路。多肽的β片層之間可以形成氫鍵,將一個一個多肽單體按照特定的結構連接在一起,形成纖維。世界上許多實驗室正在人工合成一些可以自聚集形成纖維的多肽,希望能夠控制纖維的生長,找到新的功能材料。
注釋
參見
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads