肺癌
疾病 来自维基百科,自由的百科全书
肺癌(lung cancer[9]),也稱支氣管肺癌[12][13],世衛組織稱支氣管或肺惡性腫瘤[1],是發生於支氣管或肺部的惡性腫瘤,起源於組織細胞不受控制地生長[14]。如治療不及時,腫瘤細胞將很可能轉移至鄰近組織或其他身體部位[15]。肺部最常見的原發性惡性腫瘤屬於上皮癌[16],可粗分為小細胞癌(SCLC)和非小細胞癌(NSCLC)[5]。肺癌最常見的症狀有咳嗽(包括咳血)、體重減輕、氣短和胸痛[3]。
| 肺癌 | |
|---|---|
| 又稱 | 支氣管肺癌、支氣管或肺惡性腫瘤[1]、原發性支氣管癌[2] |
 | |
| 胸部X光(胸片)顯示出肺部腫瘤(箭頭所指處)。 | |
| 症狀 | 咳嗽(包含咳嗽咳出血)、體重減輕、呼吸短促、各種胸痛[3] |
| 起病年齡 | ~70 歲[4] |
| 類型 | 小細胞癌(SCLC)、非小細胞癌(NSCLC)[5] |
| 風險因素 | 吸菸、遺傳因子、氡氣、石棉、空氣污染[6][7] |
| 診斷方法 | 醫學影像、活體組織切片[8][9] |
| 治療 | 外科手術、化學療法、放射線療法[9] |
| 預後 | 五年存活率 17.4%(美國)[4] |
| 盛行率 | 330萬(2015年)[10] |
| 死亡數 | 170萬(2015年)[11] |
| 分類和外部資源 | |
| 醫學專科 | 腫瘤學 |
| ICD-11 | 2C25 |
| ICD-10 | C3333.-C3434. |
| ICD-9-CM | 162.3、162.5、162.8、162.4 |
| OMIM | 211980、608935、612593、614210、612571 |
| DiseasesDB | 7616 |
| MedlinePlus | 007194、007270 |
| eMedicine | 279960、280104、362919、358274、358433 |
大多數(85%)肺癌患者患病的原因為長期吸菸[6],然而亦有大約10-15%的患者從不吸菸[17]。這部分人患上肺癌常是由於遺傳因素和吸入氡氣、石棉、二手煙,或其他空氣污染物共同導致[6][18][7][19]。肺癌在胸部X光或斷層掃描(CT)中可見[9],並可通過支氣管鏡檢查或CT引導下進行活檢確診[8][20]。
避開汙染物等風險因子為最主要的預防方式[21]。肺癌的治療和長期療效取決於類型、階段(轉移的程度)和患者的整體健康狀況[9]。大多數的肺癌無法治癒[5],常見治療方式有外科手術、化療和放療[9]。非小細胞肺癌有時採用手術治療,而小細胞肺癌(SCLC)通常對化療和放療的效果佳[22]。
在2012年,全球約有180萬人新罹患肺癌,並導致160萬人死亡[16]。肺癌是男性常見的癌症致死病因,在女性則僅次於乳癌,列名第二[23]。肺癌最常於70歲上下診斷[4]。在美國,總體而言患者在確診為肺癌之後,有17.4%的人存活時間超過5年[4],而這個比例在發展中國家則較低[24]。
在2020年,全球新發肺癌病例約220.7 萬,新增肺癌死亡病例約179.6萬,分別占全部惡性腫瘤新發和死亡病例的11.4%和18.0%。[25]2022年中國新發肺癌病例約87.1萬,新增肺癌死亡病例約76.7萬,分別占所有惡性腫瘤發病和死亡病例的18.1%和23.9%。[26]
臨床表現
肺癌的臨床表現包含:[3]
如果腫瘤生長在呼吸道,那麼其可能會阻斷氣流,造成呼吸困難,還可能阻礙呼吸道分泌物的排出,使得分泌物聚積在呼吸道,增加罹患阻塞性肺炎的可能性[3]。
不同類型腫瘤,會導致不同的腫瘤伴隨症候群。這些與原病灶發生處無關的症狀,常作為初始症狀表現,往往才是肺癌被發現的主因[27]。肺癌的腫瘤伴隨症狀可能包括高血鈣、抗利尿激素分泌異常綜合徵(SIADH,尿液異常濃縮和血液稀釋)、異位性促腎上腺皮質激素(ACTH)分泌、Lambert-Eaton 肌無力症候群(自身抗體引起的肌無力)。肺尖部的腫瘤稱為潘科斯特瘤可能會侵犯局部交感神經系統,導致霍納氏綜合徵(眼瞼低垂和同側瞳孔縮小),也可能會損傷臂神經叢[3]。
肺癌的許多症狀都不具特異性,如食慾減退、消瘦、發熱和疲乏無力等等[8]。因此許多患者在出現症狀後就醫時,癌組織早已從原發部位擴散轉移[28]。提示出現癌轉移的症狀有消瘦、骨痛和神經系統症狀(頭痛、昏厥、驚厥或四肢無力)[3]。肺癌常見的轉移部位有腦、骨、腎上腺、對側肺、肝、心包膜和腎臟[28]。大約10%肺癌患者被確診時沒有臨床症狀,而是在常規胸片檢查時意外發現[20]。
病因


細胞的癌變與DNA及表觀遺傳等遺傳信息的突變有關,這些變化會影響細胞的正常功能,包括細胞增殖、程序性細胞死亡(細胞凋亡)和DNA修復。損傷累積的越多,癌症發生的風險就越高[29]。
吸菸是目前為止導致肺癌的主要原因[6]。香菸菸霧中含有至少73種已知的致癌物質[30],包括苯並芘[31]、NNK、1,3-丁二烯,以及釙-210等放射性物質[30]。以發展中國家在2000年的資料來看,患肺癌死亡的男性中90%是吸菸所致(女性為70%)[32]。吸菸導致的肺癌患者占了肺癌病人的85%[9]。
被動吸煙(吸二手菸,意為吸入其他吸菸者產生的菸草煙霧)也是導致不吸菸的人患上肺癌的原因。美國[33][34][35] 、歐洲[36],和英國[37]的研究都表明被動吸菸者患肺癌風險在顯著增加[38]。和吸菸者共同生活的人患病風險增加20-30%,而工作環境中有二手菸的人其患病風險增加16-19%[39]。而研究亦顯示側流菸比直接吸菸更危險[40]。美國每年有大約3,400人死於被動吸菸造成的肺癌[35]。
大麻和菸草菸霧中含有許多相同致癌物[41],但抽大麻對患肺癌風險的影響還不清楚[42][43]。2013年的一篇回顧性文章並未發現輕度到中度吸食大麻會使患肺癌風險增加[44]。而2014年的回顧性文章則發現吸食大麻會使肺癌風險增加一倍[45]。
氡是一種無色無味的氣體,由地殼中存在的鈾的衰變產物鐳裂變後生成。這些放射衰變產物會使遺傳物質電離,進而導致基因產生某些致癌突變。氡氣是美國肺癌的第二常見的暴露因子[46]。每年導致約21,000人死亡[47]。氡氣濃度每立方米升高100貝可(100 Bq/m³),其致癌風險就會增加8-16%[48]。 氡氣含量隨區域和下層土壤、岩石的成分變化而不同。美國每15個家庭中就有大約一個的氡氣水平超過了建議量每升4皮居里(4 pCi/l)[49]。「密閉」、「通風不足」、「一樓的地板有裂縫,使得土壤中的氡逸散到室內」的建築,將有較高濃度的氡。
石棉可導致多種肺病,包括肺癌。石棉者和吸菸會產生協同作用,大幅增加罹患肺癌的機會[7]。吸菸者工作環境中有石棉時,其患肺癌風險較一般人高了45倍[50]。石棉也可導致胸膜癌變,稱為間皮瘤(和肺癌不同)[51]。
戶外空氣汙染物會增加罹患肺癌的風險,特別是燃燒化石燃料產生的廢氣[6]。懸浮細顆粒(PM2.5)和硫酸鹽氣溶膠也會稍微提升風險,此類汙染物常來自於汽車排放的廢氣[6][52]。二氧化氮濃度每增加10 ppb,人患肺癌風險就上升14%[53]。據估計,1-2%的肺癌由戶外空氣污染所致[6]。
初步證據支持室內空氣污染會使患肺癌風險增加,包括做飯和取暖時燃燒木材、木炭、糞便或作物殘茬[54]。暴露於室內煤煙的女性,罹患肺癌風險會提升大概一倍,許多生物質燃燒後的副產品是已知或可疑的致癌物[55]。這一風險影響全球大約24億人[54],據信約有1.5%的肺癌死亡病例是由此導致[55]。
約8%肺癌由遺傳因素所致[56]。若親屬中有肺癌患者時患病風險會增加一倍, 本疾病可能由多基因共同調控[57]。目前已知5、6和15號染色體上的基因多態性會影響患肺癌的風險[58]。
許多其它物質、職業及所處環境都與肺癌有關聯。國際癌症研究機構(IARC)聲稱有「充足證據證明」以下物質是肺部的致癌物[59]:
致病機轉
和許多其它癌症類似,肺癌也始於原癌基因的激活或抑癌基因的滅活[60]。而致癌物正是誘發這些變的因素[61]。K-ras原癌基因的突變導致10-30%的肺腺癌[62][63]。大概4%的非小細胞肺癌與一個EML4-ALK酪氨酸激酶融合基因有關[64]。表觀遺傳學的變化——如DNA甲基化,組織蛋白尾部修飾或小核糖核酸(微RNA)調控的改變可能會導致抑癌基因的滅活[65]。
表皮細胞生長因子受體(EGFR)調控細胞增殖、凋亡、血管生成和腫瘤侵襲[62]。EGFR基因的突變和增幅是非小細胞癌常見的致病機轉,因此EGFR抑制劑可以用於某些肺癌的治療[62]。其它經常發生突變或擴增的基因有c-MET、NKX2-1、LKB1、PIK3CA和BRAF[62]。
其細胞株系起源機制尚不完全清楚[3]。機理可能涉及幹細胞的異常活化。在氣道近端,表達角蛋白5的幹細胞最易發生癌變,導致肺鱗狀細胞癌。在氣道中段,支氣管無纖毛分泌細胞(club cell)和神經上皮細胞等會表達子宮球蛋白的細胞具幹細胞性質。小細胞肺癌可能來源於這些細胞系[66],或神經分泌細胞[3],也可能會表達CD44[66]。
肺癌細胞在原發時大多為上皮細胞型,但該型細胞並不利遠端轉移,必須要轉變為間質細胞型才可以進行遠端轉移,該現象稱為上皮間質轉化。涉及轉化的蛋白包含Akt/GSK3Beta、MEK-ERK、Fas和Par6等[67]。
COPD和肺纖維化(α1-抗胰蛋白酶缺乏)可能增加肺癌易感性;此外,吸煙者補充β-胡蘿蔔素也會增加患肺癌的危險性。空氣污染和雪茄煙霧中含有致癌物質,這些致癌物質可能存在一定的致癌風險,但尚未顯示可引起肺癌。患者若有其他的肺部疾病(如肺結核)所致瘢痕,那麼他們的患癌風險也將增加。[9]
呼吸道上皮細胞需長時間暴露於促癌物質下並逐漸積累多種基因突變才能成為腫瘤。刺激細胞生長(K-ras, MYC)的基因突變逐漸導致生長因子受體(EGFR,HER2/neu)信號異常,抑制凋亡(BCL-2),引起異常細胞增殖。此外,腫瘤抑制基因的突變(p53、APC)亦可導致癌症。[9]
診斷
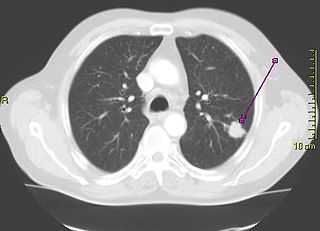
當病人的症狀疑為肺癌時,胸部影像學檢查可提供初步的檢查和評估。肺癌在影像學的表現包括如單個腫塊、多發腫塊、孤立的肺結節等等。另外還有肺門增大、縱隔增寬(可能代表縱膈腔淋巴結轉移)、肺不張、氣管支氣管狹窄、肺實變,未緩解的實質浸潤、空洞。或其他原因無法解釋的肋膜積水[9]。電腦斷層(CT)可以提供更多相關資訊,例如說腫瘤的擴散程度及類別,也相較胸部X光片更能發現縱膈腔後的腫瘤。但上述影像學檢查僅能夠提供診斷上的參考,確診必須透過細胞病理學證實。因此可以透過支氣管鏡檢查或CT引導下的組織活檢,進行組織病理學檢查的取樣[20]。
胸片上肺癌通常表現為一個單一肺結節。但由於有許多症狀類似的疾病,因此仍須配合其他檢查以進行鑑別診斷。與肺癌在影像學類似的疾病包含其他腫瘤的轉移、錯構瘤、感染肉芽腫(如肺結核、組織孢漿菌症、球黴菌症等等)[68],其他導致單個肺結節但不太常見的原因包括支氣管源性囊腫、腺瘤、動靜脈畸形、肺隔離症、類風濕結節、肉芽腫病伴多血管炎或淋巴瘤[69]。肺癌亦可能在進行其他無關原因做胸部X片或CT掃描時意外發現[70]。肺癌需要通過對可疑組織的臨床和影像學特徵進行組織學檢查方能確診[3][8]。臨床實踐指南推薦了肺結節的監測頻率[71]。CT掃描不應使用過長時間或過於頻繁,因為會增加人們接觸到的射線量[71]。
毛玻璃樣斑塊(Ground-glass opacity,GGO)是描述胸部照影中的肺部毛玻璃樣病灶,過去大多被視為良性變化。但在更進一步的解剖研究後,發現有些GGO具有惡性潛勢。良性的GGO包含局部間質纖維化(focal interstitial fibrosis)、發炎,或是出血。惡性的狀況則包含異形腺瘤性增生(AAH)、原位肺腺癌(AIS),或微侵犯型肺腺癌(MIA),以及鱗屑樣為主型肺腺癌(lepidic-predominant invasive adenocarcinomas,LPA)等[72]。由於GGO的惡性機率高達63%,因此在癌早期發現的角色也越顯重要[73]。

肺癌的分類須透過組織病理分型[8],分類對於治療策略的選擇跟預測療效相當重要。肺癌屬於上皮癌,意即腫瘤發源自上皮細胞,可根據顯微鏡下觀察到的癌細胞的大小和形態對肺癌進行分類。為方便治療,肺癌可大致分為非小細胞癌和小細胞肺癌[75]。

非小細胞癌(NSCLC)可粗分為三大類:肺腺癌、鱗狀上皮癌,和大細胞癌[3]。
接近40%的肺癌屬於肺腺癌,腺癌一般起源於周圍肺組織[8]。雖然多數腺癌與吸菸有關,但在從未吸菸者、一生抽菸少於100根,以及曾中度吸菸並已戒治者的肺癌患者中,肺腺癌亦為最常見類型[3][76]。而肺癌的其中一種亞型細支氣管肺泡癌,則多見於女性未吸菸者,其長期存活率較佳[77]。
鱗癌大概占肺癌的30%,一般位於大氣道附近。癌組織中央常可發現因細胞壞死而形成的空腔[8]。大約9%的肺癌為大細胞癌。之所以稱其為大細胞癌是因為癌細胞體積大,細胞質過量,細胞核大,核仁明顯[8]。

小細胞肺癌(SCLC)的癌細胞內含有緻密的神經內分泌顆粒(即含有神經內分泌激素的囊泡),因此這類腫瘤可能會有內分泌相關的副癌綜合徵[78]。多數小細胞肺癌發生在大的氣道(主支氣管和次級支氣管)[20]。病程中癌組織生長迅速,發生擴散早,60-70%的患者就診時已有廣泛侵犯的情形(意即一次放射線治療無法打完)。小細胞癌和吸煙有着極大的關係[3]。
公認的主要組織學亞型有四種,有些癌組織可能同時擁有不同亞型[75],如腺鱗癌[8]。罕見的亞型包括:腺瘤、類癌和肉瘤樣癌(sarcomatoid carcinomas)[8]。
肺部為身體其他腫瘤常見的轉移位置。繼發性腫瘤可根據其原發部位分類,如擴散到肺部的乳腺癌被稱為轉移性乳腺癌。轉移性腫瘤在胸片中常顯示為典型的圓形[79]。
而原發性肺癌本身最常見的轉移部位是腦、骨、肝臟和腎上腺[8]。對活檢組織進行免疫染色通常有助於確定癌症原發部位[80]。若腫瘤細胞出現Napsin-A、TTF-1、CK7和CK20等標記,可以協助確認腫瘤的亞型。如SCLC是源自於神經內分泌細胞,因此可能會表現CD56、神經元黏附分子、突觸素,或嗜鉻粒蛋白等等[3]。
癌症分期是對其從原發部位擴散的程度進行評價[81],是影響肺癌預後和潛在治療措施的因素之一[3][81]。最初對非小細胞肺癌的分期評估使用的是TNM分期法。是基於原發腫瘤(Tumor)的大小,是否累及淋巴結(lymph Node)及有否遠處轉移(Metastasis)[3]。
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
使用TNM分期系統可將非小細胞肺癌分為隱匿癌、0、IA、IB、IIA、IIB、IIIA、IIIB、IIIC、IVA,和IVB期。這一分期系統可輔助選擇治療措施和評估預後[83]。
小細胞肺癌被歸入局限期(limited stage,只限於單側胸腔的一半,且能被納入單一放射治療區域)和廣泛期(播散範圍更廣)[3]。但使用TNM系統進行分類有助於評估其預後[83]。
對非小細胞肺癌和小細胞肺癌來說有兩種分期評估方法:臨床分期和外科手術分期。臨床分期在根除性手術之前進行,主要以影像學檢查結果(如CT掃描和PET掃描)和組織活檢結果為基礎。外科手術分期在術中或術後進行,綜合考慮手術和臨床的結果,包括對胸腔淋巴結的手術取樣[8]。
| TNM | 期組 |
|---|---|
| T1 N0 M0 | IA |
| T2a N0 M0 | IB |
| T2b N0 M0 | IIA |
| T1-T2 N1 M0 | IIB |
| T3 N0 M0 | |
| T1–T2 N2 M0 | IIIA |
| T3 N1 M0 | |
| T4 N0–N1 M0 | |
| T1-T2 N3 M0 | IIIB |
| T3-T4 N2 M0 | |
| T3-T4 N3 M0 | IIIC |
| M1a-M1b | IVA |
| M1c | IVB |
預防

在大多數國家,大部分工業和家用的可致癌物質都已經鑑別出來,並明令規範,但吸菸仍相當普遍。限制吸煙是預防肺癌的首要目標,而戒菸是這個過程中最重要的一環[85]。
有更多西方國家通過政策干預來減少在餐館和工作場所等公共區域的被動吸煙[86]。不丹於2005年起已實行完全禁煙令[87],印度也從2008年10月開始也實行了公共場所禁煙令[88]。世界衛生組織(WHO)號召各國政府全面禁止菸草廣告以防止年輕人沾染,WHO估計在實行這種禁令的國家煙草消費量已減少了至少16%[89]。
肺癌篩檢乃在沒有症狀的人群中進行大規模醫學檢查[90]。對有患肺癌高風險的人群可以通過電腦斷層來篩查發現癌組織,也使病人有機會早期診斷並治療從而延長壽命[71][91]。這種形式的篩查使死於肺癌機率的絕對風險減少了0.3%(相對風險減少了20%)[92][93] 。高危人群是指那些年齡為55-74歲,抽煙量相當於連續30年每天1盒,而且戒煙不超過15年的人[71]。
電腦斷層偽陽性率高,可能導致採取不必要的治療措施[94]。被篩檢為陽性者,僅有1/20為偽陰性[95]。偽陽性率高所衍生的公衛議題包含會造成額外的輻射暴露[94],且後續檢查也可能造成不必要的花費[71]。目前痰液細胞篩檢和胸部X光等另外兩種篩檢沒有任何已知效益[91][96]。
美國預防服務工作組(USPSTF)建議年齡介於55-80歲之間,每年抽菸超過20包,且戒菸未超過15年的族群,每年進行低劑量CT肺癌篩檢[97]。但若合併其他健康問題,使提前診斷無法延長預期壽命,或就算診斷也無法進行治療的族群,並不建議常規進行低劑量CT(LDCT)肺癌篩檢[98]。2014年,英國國家衛生署重新審查了支持進行CT篩查的證據[99]。
臺灣國民健康署建議下列肺癌高風險族群可考慮LDCT篩檢:[100]
- 年齡介於50-80歲,抽菸史超過30包年之民眾(含戒菸時間未超過15年的民眾)。
- 具有肺癌家族史的民眾(父母、子女或兄弟姊妹罹患肺癌)。
- 有肺部病史者(如肺結核、慢性肺阻塞症)。
- 暴露於氡氣環境,或特定職場環境工作者(如:金屬業、冶礦業、石油化學工業、石綿接觸者或長期暴露在有粉塵、油煙、棉絮、化學物質、放射環境下等)。
長期補充維生素A[101][102]、C[101]、D[103]或E[101]並不會降低患肺癌的風險。一些研究表明:飲食中蔬菜和水果比例較高的人患肺癌風險似乎更低[35][104],但這也可能混雜了其他混擾因子,因為會吃蔬果的人可能會抽菸的比例也較低。目前還未有嚴謹的調查研究證明飲食和肺癌風險之間有明確關聯[3][104],但有芸萃分析支持抽菸者如果配合健康飲食可以降低肺癌風險[105]。
治療
肺癌的治療取決於癌細胞的類型,擴散程度和病人的身體狀況。通常的治療措施包括:和緩醫療[106]、手術,化療和放療[3]。對晚期肺癌來說,標靶治療會變得越來越重要。

如果確診為非小細胞肺癌,對其進行分期可確定肺癌病灶是否為局限性、能否手術切除,或是否癌組織已擴散到無法用手術治療的程度,這可用CT和正電子成像術(PET)掃描來決定[3]。如果懷疑縱膈淋巴結受累可以取樣淋巴結從而協助分期。取樣技術包含經胸壁穿刺針吸活檢術(transthoracic needle aspiration)、經支氣管針吸活檢(transbronchial needle aspiration,可選擇是否要用氣管內視鏡超音波輔助)、內視鏡超音波細針抽吸、縱膈鏡檢、胸腔鏡[107]。血液檢查和肺功能檢查可用於評估病人能否承受手術[20]。如果肺功能檢查發現病人呼氣儲備量很低可能不會進行手術[3]。
對大多數早期的非小細胞肺癌患者手術會選擇只切除一個肺葉(肺葉切除術)。對於不適合行完整肺葉切除術的病人,可能可沿邊緣將含有腫瘤的三角形區域切除(楔形切除術)。但是與肺葉切除術相比楔形切除術術後更易復發[108]。在楔形切除部位的邊緣進行近距離放射碘治療(Radioactive iodine brachytherapy)可能會降低復發的風險[109]。僅有在相當罕見的情況下才會進行全肺切除術[110]。電視輔助胸腔鏡手術(VATS)和VATS肺葉切除術使用微創技術對肺癌進行手術治療[111]。與傳統的開放肺葉切除術相比VATS肺葉切除術同樣有效且術後併發症更少[112]。
小細胞肺癌通常使用化療和/或放療[113],但是人們正重新考量手術對小細胞肺癌的作用。對於沒有遠端轉移且無進犯縱膈者,可以先以外科手術切除,再進行輔助性化療[114]。而對於已經進犯縱膈腔者,則建議先以化放療作為初始治療[114]。

化療通常和放療同時進行,對於不符合手術條件的非小細胞肺癌患者,放療也可用於根治性治療。這種高強度的放療被稱為根治性放療[115]。連續超分割加速放療(CHART)是對根治性放療的改進,它在短時間內給予患者大劑量的放療[116]。非小細胞肺癌行治療目的的手術後一般不應進行胸部放療[117],但對有縱膈N2淋巴結累及的一些患者來說術後放療可能有好處[118]。對可能治癒的小細胞肺癌患者化療之外通常建議進行胸部放療[8]。
如果癌組織堵塞了一小段支氣管,可以在氣道內用近距離治療(局部放療)直接打通。和體外放射治療相比,近距離治療可減少治療時間,也可減少對醫護人員的射線照射量[119]。然而目前近距離治療的相關治療證據,仍比傳統的體外放射治療要少[120]。
預防性顱腦照射(PCI)是腦部的一种放療手段,用於降低腫瘤轉移風險,對小細胞肺癌最有用。PCI使局限期肺癌的三年生存率從15%提升至20%,使廣泛期肺癌的一年生存率從13%增加至27%[121]。
近年來靶向治療和影像技術的改進使立體定向放療治療早期肺癌這一療法得到發展。這种放療方法使用立體定向定位技術分幾次對病人進行大劑量放療。這最初用於那些由於某些合併症無法進行手術的患者[122]。
對非小細胞肺癌和小細胞肺癌患者來說稍小劑量的胸部放療可用於控制症狀(和緩性放療)[123]。射頻消融術是一種利用高頻電流來殺死腫瘤細胞的新技術,可以用於腫瘤病灶較小的早期患者或放療後的復發患者。這是一種創傷較小的治療手段,較開胸手術而言,可以儘可能多地保護肺功能,適用於無法手術的患者[9]。
化療方案取決於腫瘤類型[8]。小細胞肺癌(SCLC)即使在相對早期也主要採用化療和放療進行治療[124],常用的化療方案為依託泊苷聯合一種鉑類藥物(順鉑或卡鉑)[125],二者也常和卡鉑、吉西他濱、紫杉醇、長春瑞濱、拓撲替康、伊立替康等藥物聯用[126][127]。對於晚期非小細胞肺癌(NSCLC),如果病人身體可承受,化療可提高存活率,為第一線治療手段[128],並且通常使用兩種藥物來治療,其中一種常為鉑類(順鉑或卡鉑)。其它常用的化療藥物為:吉西他濱、紫杉醇、多西他賽[129][130]、培美曲塞[131]、依託泊苷或長春瑞濱[130]。70歲以上的患者如果使用鉑類藥物進行化療,其產生嚴重副作用的風險會較高[132]。
輔助化療是指在進行根除型手術後再實施化療,目的是提高療效。對於非小細胞肺癌,手術過程中會在病灶旁淋巴結取樣以輔助分期。如果確定其為肺癌II或III期,輔助性化療可以使五年生存率提高4%[133][134][135] 。與舊的化療方案相比,長春瑞濱和順鉑聯用更有效[134]。對IB期肺癌是否應採用輔助性化療還有爭議,因為臨床試驗還未證明其可以提高生存率[136]。非小細胞肺癌的癌組織若能手術切除,術前化療也能提高療效[137][138]。
在對非小細胞肺癌的治療中,化療可能會與和緩醫療聯合應用。對晚期病人而言,適當的化療比單純的支持性護理更能提高平均存活率,也可以改善生存質量[139][140]。在和緩醫療的過程中如果病人身體狀況允許的話,持續化療可以使存活時間延長1.5到3個月,也可減輕症狀,改善生存質量,且現代化療藥物的效果更好[141][142]。非小細胞肺癌芸萃分析協作小組建議:在晚期非小細胞肺癌的治療中,如果患者願意而且可忍受就應該考慮進行化療[128][143]。
肺癌、特別是在晚期肺癌的治療中,有幾種以分子路徑為靶標的藥物可用。厄洛替尼 、吉非替尼,和阿法替尼抑制表皮生長因子受體中的酪氨酸激酶。Denosumab是針對RANKL的單克隆抗體,本品會與RANKL結合,使其無法激活蝕骨細胞,對治療骨轉移癌有效[144]。2015年單克隆抗體藥物安維汀(貝伐珠單抗)肺癌適應症在中國上市,其通過抑制腫瘤血管生成來治療癌症[145]。
T細胞上的受體CTLA-4會抑制免疫系統,有些癌細胞便會依此機制來逃脫免疫系統的偵查。伊匹單抗(Ipilimumab)會抑制CTLA-4,藉此來阻斷其信號傳導,減少癌細胞逃脫的機會,FDA已批准其用於治療黑色素瘤。目前有第三期試驗顯示伊匹單抗與保疾伏(nivolumab)併用可以延長非小細胞肺癌的存活期[146]。
程序性細胞死亡1蛋白(PD-1)傳導的信號可使T細胞失活,一些癌細胞會表達PD-L1,使T細胞無法作用。因此有些藥物藉由抑制PD-1與其配體PD-1配體1(PD-L1)來發揮療效,此類藥物已被批准作為某些肺癌的前幾線藥物[147]。PD-1因此可使用PD-1和PD-L1的單克隆抗體來對況這些癌細胞。此類藥物包含派姆單抗(pembrolizumab)、保疾伏[67]、癌自禦(atezolizumab)[148],以及度伐魯單抗(durvalumab)等等[147],相關的臨床試驗目前正在進行[147]。
有些肺癌患者已對表皮生長因子受體(EGFR)和間變性淋巴瘤激酶(ALK)的酪氨酸激酶抑制劑產生耐受性,故有些新藥正在開發中。新的EGFR抑制劑包括阿法替尼和達科米替尼。新的ALK抑制劑包括克里唑替尼(crizotinib)和色瑞替尼(ceritinib)[149]。
對於氣道阻塞或流血的病人,有數種治療可透過支氣管鏡進行。如果氣管遭到腫瘤堵塞者,可以選擇的治療包含硬式支氣管鏡(rigid bronchoscopy)、支氣管內氣囊擴張和成形術(balloon bronchoplasty)、支架置放術,以及微型輕創術(microdebridement)等等[150]。雷射燒灼術(Laser photosection)則需藉由支氣管鏡讓雷射進入氣道,並將堵塞的腫瘤移除[151]。
和緩醫療能提升患者在治療期間的生活品質。即使正在進行常規化療的患者,合併給予和緩醫療也有助益[152]。和緩醫療也能夠給予患者和醫師雙方一段過渡期,以避免情急之下做出無法反悔的決定[153][154] 。和緩醫療並不只用於生命垂危之際,在整個病程中,和緩醫療都可以避免無用但昂貴的治療措施。對那些癌症晚期的病人,則建議轉由安寧病房進行安寧療護[20][154]。
預後
| 臨床分期 | 五年以上存活率(%) | |
|---|---|---|
| 非小細胞肺癌 | 小細胞肺癌 | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
美國所有肺癌患者中16.8%確診後存活了至少5年[4][155]。在英格蘭和威爾斯2010年到2011年之間肺癌總的五年生存率僅約有9.5%[156]。發展中國家這一情況更糟糕[24],確診時往往已是晚期。就診時30-40%的非小細胞肺癌已是Ⅳ期,60%的小細胞肺癌也已發展到Ⅳ期[8]。確診時分期越晚,肺癌患者存活時間越短,英國的數據表明:確診時處於最早期的病人中70%可以存活至少1年;但對那些確診時處於最晚期的病人,這一數字下降到只有14%[157]。
非小細胞肺癌的預後影響因素包括有無肺部症狀、腫瘤大小(>3公分)、細胞類型(組織學)、擴散程度(分期)和是否轉移到多處淋巴結,有無血管侵犯。不能進行手術的病人中,身體狀況差且體重下降超過10%者預後更差[158]。小細胞肺癌的預後影響因素包括:身體狀況、性別、癌症分期,還有確診時癌細胞是否累及中樞神經系統或者肝臟[159]。
對於非小細胞肺癌,若IA期時手術完整切除癌灶預後最好,多達70%患者可存活5年[160]。小細胞肺癌的五年存活率總共約為5%[3]。晚期小細胞肺癌患者平均五年生存率不到1%。局限期患者的平均生存時間是20個月,五年生存率為20%[9]。
根據美國國家癌症研究所提供的數據,美國肺癌患者確診時的年齡中位數為70歲[161],死亡年齡中位數為72歲[162];有醫療保險的人可能預後更好[163]。
流行病學

0–7
8–12
13–32
33–53
54–81
82–125
126–286
287–398
399–527
528–889


肺癌是全球男性最常見的癌症,也是發生率和死亡率最高的癌症。在女性則為發生率第三高的癌症,而死亡率則僅次於乳癌,居第二位。2012年,全球肺癌新病例數約為182萬,同時也有156萬例死於肺癌,占了所有因癌症死亡人數的19.4%[23]。肺癌發病率最高的是北美、歐洲和東亞。2012年,超過三分之一的新增患者出現在中國大陸,而非洲和南亞肺癌發病率則要低得多[164]。在英國肺癌是第二大最常見癌症(2011年有大約43,500人被診斷為肺癌),也是癌症致死的最常見病因(2012年大約35,400人死於肺癌)[165]。
年齡超過50歲且有吸煙史的人群最可能罹患肺癌。和20多年前就開始下降的男性肺癌死亡率相比,女性的肺癌死亡率在過去數十年來不斷上升,最近才趨於穩定[166]。在美國,男性一生中患肺癌的風險是8%,女性是6%[3]。
據統計,約每抽掉300到400萬根香煙,就有一個人死於肺癌[167]。五大菸業的影響力在吸煙文化中發揮重要作用[168]。看到煙草廣告的年輕的非吸煙者更有可能開始吸煙[169]。近年來,人們越來越重視二手菸在誘發肺癌中的角色[38],以致政府進行政策干預以減少非吸煙者不想要的暴露於其他人的煙草煙霧中的幾率[170]。汽車、工廠、發電廠排放的廢氣也造成了潛在的風險[6]。
東歐男性的肺癌死亡率最高,而北歐和美國女性的肺癌死亡率最高。美國黑人男性和女性的發病率都更高[171]。目前在開發中國家,肺癌的發生率相對較低[172],但隨著這些國家的吸菸人口逐漸上升,肺癌的發生率在接下來的幾年可能會逐漸上升,特別是中國[173]和印度[174]。
在美國,老兵的肺癌發生率較其他族群要高出了25–50%,可能肇因於其抽菸比率較高[175]。也可能是在二戰和韓戰期間暴露於石棉當中,或在越戰中有遭受橘劑暴露[176]。
肺癌為英國第三常見的癌症(2014年約有46,400人新診斷肺癌)[177],且也是最常見的致死癌症(2014年約有35,900人死於肺癌)[178]。
在中國大陸,肺癌確診後存活過5年的病人不足五分之一,中國大陸採用療法的普遍有效程度雖然高於發展中國家的平均水平,但是顯著低於日本、韓國等發達國家,而且也低於例如乳癌、結直腸癌等其它癌症在中國大陸的療效水平。[179]。在台灣,確診後存活過5年的病人約占總確診人數的15.9%,其中一半的人能活過13.2個月。[180]
從1960年代開始,相對於其他類型肺癌,肺腺癌的發病率開始上升,部分原因是過濾嘴香煙的面世。過濾嘴過濾掉了煙草中的大顆粒物,因此減少了大氣道中的沉積物。但是抽煙者必須吸得更深以獲得等量的尼古丁,因此沉積在小氣道的顆粒物就增加了,而小氣道正是肺腺癌易發部位[181]。肺腺癌的發病率還在持續上升[182]。
歷史
在吸菸普及之前,肺癌其實並不常見;在1761年之前,人們甚至不認為肺癌是一個明確的疾病[183]。肺癌的各個方面在1810年得以詳細記述[184]。在1878年,屍檢時發現的癌症中惡性肺腫瘤僅占1%,但到20世紀早期,這一比例已上升到10-15%[185]。在1912年,全世界醫學文獻中的肺癌病例報告只有374例[186],但是一篇屍檢的綜述表明肺癌的發病率已經從1852年的0.3%上升到了1952年的5.66%[187]。1929年,德國內科醫生弗里茨·利金特意識到了吸煙和肺癌的直接關聯[185],這導致了一場激進的反吸煙運動[188]。在1950年代發表的對英國醫生吸煙和肺癌的研究結果,第一次為吸煙和肺癌之間的關聯提供了確鑿的流行病學證據[189]。因此在1964年美國軍醫署建議吸煙者戒煙[190]。
至於肺癌與氡氣之間的關聯性,則要從一群在薩克森州施內貝格附近的厄爾士山脈工作的礦工開始說起。該礦坑從1740年就開始開採銀礦,這些礦富含鈾,也附帶有鐳和氡氣[191]。礦工中很多人患了肺部疾病,直到1870年代才意識到是肺癌[192]。儘管發現了這些問題,但由於蘇聯對鈾的需求,開採還是持續到了1950年代[191]。1960年代,氡被確認為肺癌的一個致病因素[193]。
用於治療肺癌的全肺切除術,在1933年首次成功[194]。姑息放療從1940年代開始使用[195],從1950年代開始使用根治性放療,即嘗試對那些處於肺癌早期但不適合手術治療的病人使用更大的放射劑量[196]。在1997年,連續超分割加速放療法出現,這被認為是對傳統的根治性放療的改進[197]。對小細胞肺癌,1960年代開始嘗試手術切除[198]和根治性放療[199],但並不成功。至1970年代才開發出了成功的化療方案[200]。
研究方向
當前肺癌治療的研究方向包括免疫治療(激活機體免疫系統攻擊腫瘤細胞)[147]、表觀遺傳學、化療和放療新組合(單獨或合併使用)。這些新的治療措施中很多是通過阻斷免疫關卡,干擾癌細胞逃避免疫系統攻擊的能力[147]。
表觀遺傳學是研究遺傳性基因修飾以及基因表達的學門。生物體在不改變DNA序列狀況下,可以藉由一些分子標籤改變基因的表現,而這類修飾常常具有遺傳性。針對這些分子標籤的藥物可以殺死癌細胞,研究顯示非小細胞癌早期給予藥物阻斷多重分子標籤,可以在副作用更少的情形下殺死癌細胞[201]。在對病人進行標準化治療前給他們用這些藥可以提高效果[201]。相關的臨床研究正在進行中,期望能探知此類藥物對於人類肺癌的效果[201]。開發中的藥物包含組蛋白脫乙酰酶抑制劑和DNA甲基轉移酶,前者包括丙戊酸,伏立諾他(vorinostat)、貝利司他(belinostat)、帕比司他(panobinostat)、恩替諾特(entinostat)和羅醚酯肽(romidepsin)。後者則包括地西他濱(decitabine)、氮雜胞苷(azacitidine)和肼屈嗪[65]。
TRACERx計畫正在觀察非小細胞肺癌如何形成和發展,以及這些腫瘤如何變得對治療耐受[202]。這一項目會觀察來自850例非小細胞肺癌病人的腫瘤樣本,這些病人處於確診後、初次治療後、治療後、和復發後等各個時期[203]。通過分析腫瘤發展不同階段的樣本,研究者們希望找出哪些變化能夠加速腫瘤的生長,加強腫瘤對治療的耐受性。該項目的結果能夠幫助科學家和醫生理解非小細胞肺癌,並且可能有助於發現治療肺癌的新的手段[202]。
嵌合抗原受體T細胞免疫療法(Chimeric Antigen Receptor T-Cell Immunotherapy)乃是先取得患者自身的T細胞後,在體外以基因工程的技術,使T細胞具有辨識癌細胞的能力後,再回輸到患者身上。被改造後的T細胞即稱為嵌合抗原受體T細胞(CAR-T),該療法在急性淋巴性白血病(ALL)的治療方面取得了重大突破。目前也正在研究該療法在治療非小細胞肺癌以及間皮瘤的潛力[204]。
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
