铯
原子序數為55的化學元素 来自维基百科,自由的百科全书
1860年,两位德国化学家罗伯特·威廉·本生和古斯塔夫·基尔霍夫通过刚刚研究出来的焰色反应发现铯,并以拉丁文“caesius”(意为天蓝色)作为新元素的名称。铯最早的小规模应用是作为真空管以及光电池的吸气剂。1967年,国际单位制中的秒开始以铯-133的发射光谱中一个特殊的频率作为定义。自此之后,铯广泛地用于原子钟。二十世纪九十年代以来,铯元素的最大应用是用于钻井液的甲酸铯,它在化学工业以及电子工业等领域也有重要用途。其放射性同位素铯-137的半衰期大约为30年,可以用于医学、工业测量仪器以及水文学等。虽然铯仅有轻微的化学毒性,但铯金属的高活泼性使之被归类为危险性物质,而其放射性同位素则会对人体健康和环境生态造成重大危害。
性质

铯是一种非常柔软、延展性很强的的黄白色金属,其莫氏硬度在所有的元素中最低,仅0.2。铯在存在痕量氧气的情况下就会变暗[5][6][7]。铯的熔点为28.4℃,为少数几种在接近室温的条件下为液态的金属元素。汞是唯一的熔点低于铯的金属元素[注 2][9]。此外,该金属具有较低的沸点,仅有641℃,为除了汞以外沸点最低的金属元素。铯的化合物燃烧时具有蓝色[10][11]或者紫色[11]。

铯可以和其它碱金属以及金形成合金,并且与汞形成汞齐。在温度低于650℃的条件下,铯无法和钴、铁、钼、镍、铂、钽或者钨形成合金。铯可以和锑、镓、铟以及钍形成具有感光性的金属互化物[5]。铯可以和除锂之外的碱金属混合形成合金,并且摩尔比例为41%铯,47%钾以及12%钠的合金的熔点为-78℃,在所有已知的金属合金中熔点最低[9][12]。
金属铯具有高度的活性,并且非常容易自燃。除了在空气中能够自发燃烧以外,铯在很低温度下就能够与水发生爆炸性地反应,比碱金属中的其他元素更剧烈[5]。铯可以在温度低达-116℃的条件下与冰发生反应[9]。由于其高度活性,该金属被分类为危险性物质。铯通常在诸如矿物油等的干燥的饱和烃中储存和运输。类似的,必须在惰性气体的保护下处理铯,例如氩。然而,铯-水的爆炸威力通常比同样量的钠-水的威力小,这是由于铯在接触到水的时候立即爆炸,使得聚集起氢气的时间很少[14]。铯可以储存于真空密封的硅硼酸盐玻璃制造的安瓿中。若铯的量超过100克,需要将铯放置在密封的不锈钢容器中运输。
铯的化学性质与其他碱金属类似,但是更接近于元素周期表中其上面的元素铷的化学性质[15]。由于铯是一种碱金属,可以预期其通常的化合价为+1[注 3]。由于铯具有较高的原子量,并且比其他非放射性碱金属电正性更强,有一些较小的区别[18]。铯是电正性最强的稳定化学元素[注 4]。铯离子也比较大,并且与其他更轻的碱金属相比较软。
铯化合物多数都含有Cs+
离子,它能与很多种离子形成离子键。一个值得注意的例外是铯化物中含有Cs−
。[20] 其他例外还包括一些低氧化物(参见下面的氧化物章节)。
回到普通的铯化合物,Cs+的盐通常是无色的,除非阴离子有颜色。 许多简单的盐具有潮解性,但比更轻的其他碱金属弱。铯的乙酸盐、碳酸盐、卤化物、氧化物、硝酸盐和硫酸盐可溶于水。 复盐通常溶解度较小,硫酸铝铯溶解度较小的性质常用来从矿石中提纯铯。与锑(例如CsSbCl
4)、铋、镉、铜、铁和铅形成的复盐通常溶解度很小[5]。
氢氧化铯(CsOH)是一种具有强烈吸水性的强碱[15]。它能迅速腐蚀半导体材料(例如硅)的表面。[21] 过去化学家曾认为CsOH是“最强的碱”,因为大阳离子Cs+与OH-的相互作用很微弱[10]。氢氧化铯确实是碱性最强的阿伦尼乌斯碱,但是许多无法存在于水溶液中的化合物的碱性远比CsOH强,例如正丁基锂和氨基钠[15]。
铯与金的化学计量1:1的混合物加热后可以反应形成黄色的金化铯。这里的金阴离子表现为拟卤素。该化合物能够与水发生剧烈反应,生成氢氧化铯、金属金以及氢气。在液氨中,金化铯可以与铯特定的离子交换树脂反应以产生四甲基金。类似的铂化物,红色的铂化铯Cs
2Pt包含表现得像拟硫族的铂阴离子[22]。
与所有的金属阳离子类似,Cs+与路易斯碱在溶液中形成复合物。由于该粒子较大,Cs+通常的配位数大于6,而较轻的碱金属阳离子的典型配位数为6。这个趋势在CsCl中很明显,其配位数为8。铯离子较高的配位数以及软度(形成共价键的趋势)是将其与其它阳离子分离的基础,在实践中用于对核废料的整治,也就是将137Cs+与大量的非放射性的K+分离[23]。
氟化铯(CsF)是一种易潮解的白色固体,经常用于有机氟化学中作为氟阴离子的来源[24]。氟化铯具有石盐结构,也就是Cs+和F−以和氯化钠中的Na+和Cl−相同的方式堆积成立方紧密堆积阵列[15]。值得注意,铯和氟在所有已知的元素中分别具有最高和最低的电负性。
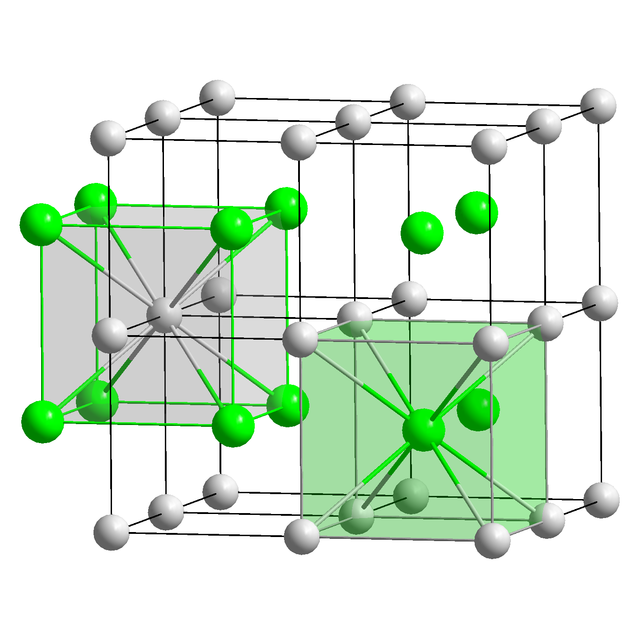
氯化铯以简单立方晶系结晶。该结构包含以双原子为基础的立方晶格原胞,每个配位数都是8,也被称为氯化铯结构[18]。氯原子位于立方的顶点上,而铯原子位于立方中央。该结构与溴化铯、碘化铯以及许多其它不包含铯离子的化合物相同。相反,大多数其它的碱金属卤化物采用氯化钠结构[18]。采用氯化铯结构的原因是Cs+的离子半径为174 pm,而Cl−
的半径为181 pm[25]。

11O
3 簇合物球棍模型
铯可以和氧形成比其它碱金属更多元的二元化合物。当铯在空气中燃烧时,主要产生超氧化铯(CsO
2)[26]。氧化铯(Cs
2O)为橙黄色的六方晶体[27],并且为仅有的反氯化镉结构氧化物[28]。它在250℃时挥发,并且在温度超过400℃时分解为金属铯和过氧化铯(Cs
2O
2)[29]。除了超氧化铯和臭氧化铯(CsO
3),[30][31],铯还有一些具有明亮颜色的低氧化物[32],包括Cs
7O、Cs
4O、Cs
11O
3、Cs
3O(暗绿色[33])、CsO、 Cs
3O
2[34]以及Cs
7O
2[35][36]。后者可以通过在真空中加热以产生Cs
2O[28]。铯也能与硫、硒以及碲等形成二元化合物[5]。
铯一共有39种已知的同位素,其质量数(原子核中的核子数)在112至151之间。其中一些同位素在年老的恒星中由较轻的元素通过捕获慢中子(S-过程)合成[37],也可以在超新星爆发的过程R-过程中合成[38]。然而,铯仅有唯一的稳定同位素,也就是具有78个中子的铯-133(133Cs)。尽管其原子核自旋量子数较大(7/2+),可以在其共振频率11.7 MHz处对该同位素进行核磁共振的研究[39]。
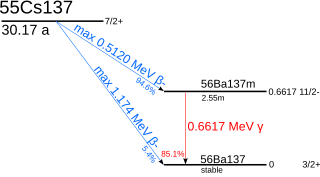
铯-137以94.6%的概率通过β衰变发射出512keV的电子衰变为钡-137m(I=11/2-,t=2.55分),随后以85.1%的概率通过662keV的伽玛衰变转变为钡-137。此外,铯-137可以以0.4%的概率通过beta衰变直接转变为钡-137。
放射性同位素135Cs具有非常长的半衰期,大约230万年,而137Cs 和134Cs的半衰期分别为30年和2年。137Cs通过β衰变转变为分解为寿命很短的137mBa,随后转变为非放射性的钡,而134Cs直接转变为134Ba。具有质量数为129、131、132以及136的同位素的半衰期在一天和两周之间,而大多数其它的同位素的半衰期仅数秒或者少于一秒。至少有21种亚稳核同质异能素,除了134mCs(半衰期少于3小时),都很不稳定,并且半衰期仅数分钟甚至更短[40][41]。
同位素135Cs是铀的长寿命裂变产物之一,可以在核反应堆中产生[42]。然而,其裂变产物产量在大多数反应堆中都会比较少,这是由于其前体,135Xe是极强的中子毒物,经常在衰变为135Cs之前嬗变为稳定的136Xe[43][44]。
由于铯137能够β衰变为137mBa,它是一种很强的伽玛射线发射体[45]。其半衰期使得它和90Sr一同成为中等寿命裂变产物。由于这两种同位素,乏核燃料在经过数年的冷却后仍在数百年内具有放射性[46]。例如,137Cs和90Sr一起成为了切尔诺贝利核事故之后其周围区域内最大的放射源[47] 。由于其较低的中子捕获率,无法通过中子捕获处理铯-137,所以必须让它进行衰变[48]。
几乎所有的核裂变产生的铯都由开始富含中子的裂变产物的β衰变产生,例如各种碘的同位素以及氙的同位素[49] 。由于碘和氙容易挥发,并且可以通过核燃料或者空气扩散,辐射性的铯经常在远离裂变地点的地方产生[50]。自从1945年开始进行核试验,铯-137被释放入大气层并作为放射性尘埃落回地球表面[5]。

铯是一种相对比较稀有的元素,估计在地壳中的化学元素丰度约为3ppm(百万分之三)[51]。铯在所有元素中丰度排第45名,而在所有金属中丰度排第36名。尽管如此,铯的丰度要高于锑、镉、锡以及钨,并且比银和汞的丰度高了两个数量级,然而其丰度仅为铷的3.3%[5]
由于其离子半径很大,铯是“不相容成分”之一[52]。在分级结晶的过程中,铯在液相中浓缩,并且最后结晶。因此,铯的大矿床为在富集过程中形成的伟晶岩。由于铯不像铷那样可以将钾置换出来,碱蒸发盐矿物天然氯化钾(KCl)和光卤石(KMgCl
3·6H
2O)中仅含0.002%的铯。所以铯仅能在若干种矿物中找到。铯含量较丰富的矿物包括绿柱石(Be
3Al
2(SiO
3)
6)和氟硼钾石((K,Cs)BF
4)。在密切相关的矿物铯柱石(Cs(Be2Li)Al2Si6O18)中Cs
2O的质量百分比可达15%,而在稀有矿物硼铯铝铍石((Cs,K)Al
4Be
4(B,Be)
12O
28)中可达8.4%,在分布更广的硼锂铍矿中含量较少[5]。铯榴石Cs(AlSi
2O
6)是唯一的有经济意义的含铯矿物,在世界上某些地方的伟晶岩中可以找到,并且它和有更重要的商业应用的锂矿石
锂云母和透锂长石共生。在伟晶岩中,晶粒比较大并且容易与矿石其它部分分离,是采矿的高品质矿石[53]。
世界上最重要的也是储量最丰富的铯产地是位于加拿大马尼托巴的伯尼克湖的堂科矿。估计其矿床中有35万吨铯榴石矿石,占世界储量的2/3[53][54] 尽管铯榴石中的铯的化学计量含量为42.6%,来自该矿床的纯净铯榴石样品中铯的含量仅约34%,平均含量24%[54]。商业用铯榴石包含19%的铯[55]。津巴布韦的比基塔伟晶岩矿床生产透锂长石,但是也有大量的铯榴石。纳米比亚的卡里比布沙漠中也在开采大量的铯榴石[54]。目前世界的年开采量为5-10吨,目前的储量可供开采数千年[5]。
生产
开采铯榴石是一种选别工艺,和其他大多数金属采矿相比仅以小规模进行生产。首先将矿石击碎,并且进行手工筛选,但是经常不做富集,然后将矿石粉碎。随后主要通过三种方式将铯从铯榴石中提取出来:酸消解、碱分解、以及直接还原[5][56]。
在酸消解中,硅酸盐铯榴石的岩石溶解在诸如盐酸(HCl)、硫酸(H
2SO
4)、氢溴酸(HBr)或者氢氟酸(HF)中。采用盐酸可以产生可溶解氯化物的混合物,而无法溶解的铯的氯化物复盐以氯化铯锑(Cs
4SbCl
7)、氯碘化铯(Cs2ICl)或者氯化铯铈(Cs
2(CeCl
6))的形式沉淀出来。分离之后,将提纯的沉淀复盐分解,在水分蒸发后得到纯的氯化铯。采用硫酸的消解的方法将得到无法溶解的复盐铯矾(CsAl(SO
4)
2·12H
2O)。铯矾与碳一起烘烤后将转化为不溶于水的氧化铝,得到的产物通过沥滤得到硫酸铯(Cs
2SO
4)溶液[5]。
将铯榴石与碳酸钙和氯化钙一同烘烤可以得到不易溶解的硅酸盐和可溶解的氯化铯。通过用水沥滤或者用氨水稀释,可以得到稀释的氯化铯溶液。该溶液可以通过蒸发以得到氯化铯或者转变为铯矾或者碳酸铯。还可以在真空罐中使用钾、钠或者钙对矿石直接还原以直接获得金属铯,但是该方法在经济上不可行。
大多数以盐的形式开采的铯直接转化为用于诸如油井等应用的甲酸铯(HCOO−Cs+)。为了向发展中的市场供货,卡博特公司在1997年在位于加拿大马尼托巴的伯尼克湖附近的堂科矿建立了生产厂,年产甲酸铯溶液1900m3[57]。铯的主要小规模商用化合物为氯化铯以及硝酸铯[58]。
此外,金属铯可以通过从矿石中得到的提纯化合物获得。氯化铯以及其它卤化铯可以在700℃至800℃的高温下与钙或者钡一同加热以将铯还原,然后通过蒸馏得到金属铯。采用相同的方法,碳酸铯以及氢氧化铯等等可以通过使用镁来还原[5]。铯还可以通过电解熔融的氰化铯来得到。极纯净并且无气体的铯可以通过以390℃加热叠氮化铯使其分解来得到,而叠氮化铯可以通过硫酸铯溶液和叠氮化钡反映得到[56]。在真空中,重铬酸铯可以和锆反应得到纯净的铯,而不产生其它气体产物[58]:
- Cs
2Cr
2O
7 + 2 Zr → 2 Cs + 2 ZrO
2+ Cr
2O
3。
2009年纯度为99.8%的铯(金属含量)大约为每克10美元,但是其化合物便宜很多[54]。
历史

1860年,罗伯特·威廉·本生和古斯塔夫·基尔霍夫在来自德国巴德迪尔克海姆的矿泉水中发现了铯。由于该元素在其发射光谱中明亮的蓝色线,他们选择了拉丁文中意为天蓝色的单词caesius为其命名[注 5][59][60] 。铯是第一种采用光谱学的方法发现的元素,与本生和基尔霍夫发明光谱仪相隔仅仅一年[9]。
为了获得纯净的铯样品,需要蒸发44000升水以得到240千克浓缩的盐溶液。碱土金属或者以硫酸盐的形式或者草酸盐的形式沉淀,而溶液中仅仅剩下碱金属。在转化为硝酸盐并采用乙醇提取后,可以获得不含钠的混合物。该混合物中的锂可以用碳酸铵沉淀出来。钾、铷和铯可以与氯铂酸形成不溶盐,然而这些盐在热水中的溶解度有差别。这样更不易溶于水的的铷和铯的六氯铂酸盐可以通过分级结晶的办法获得。在使用氢气还原六氯铂酸盐之后,可以利用铷和铯的碳酸盐在酒精中的溶解度差异分离开。该工艺可以从最初的44000升水中生产出9.2克氯化铷和7.3克氯化铯[59]。
本生和基尔霍夫使用所获得的氯化铯估计这种新元素的原子量为123.35(目前接受的值为132.9)[59]。他们试图使用电解熔融氯化铯的方法来生成铯单质,但是没有获得金属物质,只获得了一种蓝色的各项同性的物质,"不论用肉眼还是在显微镜下"都无法观察到最细微的金属物质的特征。因此,他们认为它是低氯化物Cs
2Cl。实际上他们获得的可能是金属铯和氯化铯的胶体混合物[61]。使用水银电极电解氯化铯的水溶液可以得到铯汞齐,在有水的条件下可以分解[59]。纯净的铯单质最终由德国化学家卡尔·赛特贝格在跟随凯库勒和本生读取博士学位的时候获得。1882年,他通过电解氰化铯获得了金属铯,而没有出现氯化铯的问题[62]。
历史上,铯的的最重要的用途是用于研究和开发,主要是用在化学和电子领域。20世纪20年代用于无线电真空管之前,铯几乎没有任何应用。铯在真空管中起两个作用,吸收制造完毕后剩余的氧气的吸气剂以及可以起到增加加热的阴极的导电性作用的涂层。一直到20世纪50年代,铯才开始被认为是高性能的工业金属[63]。无放射性的铯开始被用于光电池、光电倍增管、红外光谱仪、多种有机反应的催化剂,闪烁计数器以及磁流体发电[5]。
自从1967年,国际单位制基于铯的性质定义了其时间单位,也就是秒。国际单位制将一秒定义为不受外场干扰的铯-133的原子基态的两个超精细结构能级间跃迁所对应的辐射的9,192,631,770个周期的持续时间[64]。
应用
目前非放射性铯的最大的用途是石油提取工业中使用的基于甲酸铯的钻井液[5]。通过使氢氧化铯与甲酸反应制成的甲酸铯的水溶液(HCOO–Cs+)在20世纪90年代中期开始用于油井钻井以及完井液。甲酸铯作为钻井液的功能是润滑钻头,将切下来的岩石带至地表,并且在钻井期间维持对地层的压力。完井液的作用是在钻井完成后生产前辅助控制硬件进驻,而甲酸铯在其中的作用是维持压力[5]。
甲酸铯盐溶液的密度很高,达2.3 g/cm3[65],再加上大多数铯化合物所具有的相对良性的性质,减少了钻井液中有毒的高密度悬浮固体的需求。与其它许多高密度液体的成分不同,相对来说甲酸铯不会破坏环境[65]。因此该技术具有很大的技术优势、工程优势以及环境优势。甲酸铯盐溶液可以与甲酸钾、甲酸钠混合以将液体的密度降低至水的密度(1.0 g/cm3)。此外,甲酸铯还可以生物降解以及回收,并且可以循环使用,考虑到其较高的价格(每桶4000美元),这一点非常重要。[66]。碱金属的甲酸盐可以安全的处理,而且不像他们所替代的高密度盐溶液(如溴化锌溶液)那样具有腐蚀性,因此不会对生产底层或者井下的金属造成损害。使用这些甲酸盐也减少了清洁和处理的费用[5]。

铯原子钟观察铯-133原子在超精细结构之间跃迁产生的电磁辐射,并以此作为参考点。1955年,第一个精确的铯原子钟由路易斯·艾森在英国国家物理实验室建成[67]。在过去的半个多世纪中,人们不停的改进铯原子钟,并且使用它作为标准时间和频率测量的基准。这些钟测量频率的精度为2-3×10-14,相当于时间测量的精度为每天2纳秒,或者140万年1秒。目前最先进的铯原子钟的精度超过了10-15,这意味着从6600万年前恐龙灭绝的时代起其误差仅为2秒钟[5],被认为是“人类目前所达到的最精确的单位实现”[64]。
铯原子钟也用于监控手机时间传输以及互联网信息流的网络中[68]。
铯蒸气热离子发电机是将热能转化为电能的低功率装置。在双电机真空管转换器中,铯将在阴极聚集的空间电荷清除,并通过这种方式增强电流[69]。
铯也因其具有光电发射的性质而重要,它可以将光能转化为电流。由于诸如金属化合物K
2CsSb等的铯基阴极发射电子的电压阈值较低,通常将铯用于光电池中[70]。使用铯的光电发射装置包括光学字符识别装置、光电倍增管以及摄像管[71][72]。尽管如此,锗、铷、硒、硅、碲以及其他几种元素可以替代铯作为光电发射材料[5]。
碘化铯(CsI)、溴化铯(CsBr)以及氟化铯(CsF)晶体可以用于闪烁计数器中的闪烁体。由于闪烁计数器适用于检测伽玛射线和X射线,它们广泛的用于矿物勘探以及粒子物理学研究中。由于铯的原子量较大,可以提供较好的停止能力,因此可以提高检测能力。铯化合物也提供了更快的响应速度(CsF)并且不易吸水(CsI)。
铯蒸气用于许多普通磁强计中[73]。铯也在分光光度法中作为内部标准使用[74]。和其它碱金属类似,铯和氧的联系紧密,因此在真空管中铯被用作吸气剂[75]。铯还用于高能激光、蒸气辉光灯以及蒸气整流器中[5]。
由于其密度较高,氯化铯、硫化铯、以及三氟乙酸铯通常在分子生物学中用于密度梯度离心操作[76]。该技术主要用于分离生物样本中的病毒颗粒、细胞器以及核酸[77]。

铯在化学上的应用相对较少[78]。铯的化合物通常用于增强若干化学品生产中的金属-离子催化剂的作用,这些化学品包括丙烯酸、环氧乙烷、蒽醌、甲醇、邻苯二甲酸酐、苯乙烯、甲基丙烯酸甲酯单体以及各种烯烃等等。铯化合物也用于在硫酸生产中将二氧化硫催化转化为三氧化硫的过程中[5]。
氟化铯在有机化学中被用作碱[15]或者氟离子的来源[79]。铯盐在合成环状化合物、酯以及聚合等有机合成中有时用来替代钾盐或者钠盐。
铯-137在工业应用中是一种非常常见的作为伽玛射线发射源的同位素。其优势在于它的半衰期大约30年,可以通过核燃料循环获得,并且其最终产物钡-137是一种稳定的同位素。其较高的水溶性是其缺点,使得它无法用在用于食品和医疗用品的大型池式辐射器中[80]。铯-137已经被用在农业、癌症治疗、食品消毒、污水污泥处理以及外科手术设备中。[5][81]。铯的放射性同位素可以用在放射线疗法中针对某些癌症治疗[82],然而由于目前已经有了更好的替代品,且放射源中易溶于水的氯化铯可能造成大范围污染,放疗中逐渐不再采用铯放射源[83][84]。在许多工业测量计中都采用了铯-137,包括湿度计、密度计、水平仪以及厚度计[85]。测井设备中也会使用铯-137来测量与岩层中的电子密度[86]。
铯-137也用于水文学研究中。铯是核裂变反应的产物。自从大约1945年核试验开始,一直到20世纪80年代中期,铯137被释放进入大气层,然后立即被吸收入水溶液中。那个时期的年度变化与土壤和沉积层有相关性。铯-134以及含量更少的铯-135也用于水文学研究作为核电工业中产生的铯的度量。这两种同位素不像铯-133或者铯-137那样常见,而且仅能通过人为过程产生[87]。

在早期的为长距离星际航行的航天器推进器设计的离子推力器中使用铯和汞作为推进剂。在离子化方法中,需要通过与加载电压的钨电极接触剥去推进剂的外层电子。考虑到铯对飞船部件的腐蚀作用,对离子推进器的研发转向使用惰性气体推进剂,例如氙。在地面测试中处理惰性气体推进剂,并且其对飞船造成影响的可能性也更小[5]。最终在1998年发射的试验飞船深空1号中使用氙作为推进剂[88][89]。尽管如此,已经建造的场发射电子推进推力器仍然使用加速诸如铯等的金属离子的简单系统来形成推力。[90]
在红外照明弹中使用硝酸铯作为氧化剂和烟火着色剂来燃烧硅[91],例如LUU-19照明弹[92]。这是因为硝酸铯的大部分辐射光都位于近红外光谱中[93]。铯也被用来减少SR-71黑鸟式侦察机的尾焰的雷达特征[94]。铯也经常和铷一起以碳酸盐的形式加入玻璃以减少玻璃的导电性并且增加光纤与夜视设备的稳定性和持久性。氟化铯或者氟化铝铯也用在以含镁铝合金钎焊的焊剂配方中[5]。
健康以及安全危害

大多数人极少能接触到铯的化合物,但是由于铯的化学性质接近钾,大多数铯化合物只有轻微的毒性。暴露在大量的铯化合物中会引起应急过度以及痉挛,但是由于在自然情况下不会遇到这样大的剂量,铯并不是重要的化学环境污染物[95]。在小鼠试验中,氯化铯的半致死量(LD50)为每千克体重2.3克,与氯化钾和氯化钠的半致死量相近[96]。
| NFPA 704 |
|---|
| 金属铯的菱形警示危险标识。 |
金属铯是最活泼的元素之一,并且接触水后会发生爆炸。铯接触水后产生大量的热,加热了同时产生的氢气并将其点燃,引起猛烈地爆炸。其它的碱金属也能发生相似的情况,但是铯和水的反应最为剧烈,甚至和冷水也能发生爆炸性反应[5]。铯的自燃温度为-116°C,因此铯极度容易自燃,并且在空气中会发生爆炸性的燃烧,形成超氧化铯以及各种氧化物。超氧化铯是一种非常强的碱,可以迅速的腐蚀玻璃[97]。
由于人类的活动,生物圈中存在少量铯的放射性同位素铯-134和铯-137,并且在不同地点放射强度也有所不同。 放射性的铯不会像许多其它裂变产物(例如放射性碘和放射性锶)那样在人体内聚集。大约10%的吸收进人体的放射性铯会迅速通过汗和尿排出体外,而剩余的90%其生物半衰期在50天至150天[98]。放射性铯和钾类似,倾向于在植物的组织中聚集,如水果和蔬菜[99][100][101]。亦曾记录放射性污染的森林中的蘑菇将铯聚集在其子实体中[102] 。切尔诺贝利核事故之后,人们高度担心铯-137在湖水中聚集[103][104]。使用狗进行的实验表明每千克体重3.8毫居里的剂量(4.1微克铯-137)会在三周内致死[105] 较小剂量可能导致不育或者癌症[106]。国际原子能机构以及其它机构警告诸如铯-137的放射性材料可以用于放射性散布装置(亦称脏弹)中[107]。
注释
参考资料
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



