Kẽm
nguyên tố hóa học của nguyên tử số 30, kim loại màu trắng bạc From Wikipedia, the free encyclopedia
Kẽm là nguyên tố kim loại chuyển tiếp có ký hiệu là Zn và số nguyên tử là 30. Kẽm là nguyên tố đầu tiên trong nhóm 12 của bảng tuần hoàn. Kẽm là nguyên tố phổ biến thứ 24 trong lớp vỏ Trái Đất và có 5 đồng vị bền[4]. Quặng kẽm phổ biến nhất là quặng sphalerit, một loại kẽm sulfide. Hầu hết lượng kẽm được khai thác tại khai mỏ ở Úc, Canada và Hoa Kỳ, sau đó quặng bị tuyển nổi, thiêu kết, và điện phân để ra sản phẩm tinh khiết. Một mặt nào đó, kẽm có tính chất hóa học giống như là magnesi, vì ion của chúng có bán kính và số oxy hóa ở điều kiện thường (+2) như nhau.
| Kẽm, 30Zn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Các mảnh và khối kẽm với độ tinh khiết 99,995% | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Quang phổ vạch của kẽm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên, ký hiệu | Kẽm, Zn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Ánh kim bạc xám | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kẽm trong bảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử (Z) | 30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn (±) (Ar) | 65,38(2)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | kim loại chuyển tiếp | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm, phân lớp | 12, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | [Ar] 3d10 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 8, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Ánh kim bạc xám | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất rắn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | 692,68 K (419,53 °C, 787,15 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | 1.180 K (907 °C, 1.665 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | 7,14 g·cm−3 (ở 0 °C, 101.325 kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ ở thể lỏng | ở nhiệt độ nóng chảy: 6,57 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | 7,32 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | 123,6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | 25,470 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | 2, 1, 0, -2 Lưỡng tính | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 1,65 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 906,4 kJ·mol−1 Thứ hai: 1.733,3 kJ·mol−1 Thứ ba: 3.833 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính cộng hoá trị | thực nghiệm: 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 122±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lục phương | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vận tốc âm thanh | que mỏng: (Cuộn dây) 3850 m·s−1 (ở r.t.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ giãn nở nhiệt | 30,2 µm·m−1·K−1 (ở 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 116 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điện trở suất | ở 20 °C: 59,0 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Nghịch từ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun Young | 108 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun cắt | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun khối | 70 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hệ số Poisson | 0,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Mohs | 2,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Brinell | 412 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7440-66-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính: Đồng vị của Kẽm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Đồng thau (hợp kim của đồng và kẽm) đã được dùng ở Judea từ trước thế kỷ X TCN[5] và ở Hy Lạp cổ đại từ thế kỷ VII TCN.[6] Các mỏ kẽm tại Rajasthan đã được khai thác bởi con người từ thế kỷ VI TCN. Tuy nhiên, bằng chứng sớm nhất của con người tạo ra kẽm tinh khiết được tìm thấy ở Zawar, Rajasthan vào thế kỷ IX bằng cách chưng cất quặng kẽm. Mãi cho đến thế kỷ XII thì kẽm nguyên chất mới được sản xuất tại quy mô lớn ở Ấn Độ. Vào thời Trung cổ, trong giả kim thuật kẽm oxide được gọi là "len của nhà triết học" hoặc "tuyết trắng".
Năm 1746, nhà hóa học người Đức Andreas Sigismund Marggraf được công nhận là tách được kẽm kim loại tinh khiết. Năm 1800, Luigi Galvani và Alessandro Volta đã phát hiện ra các đặc tính điện hóa học của kẽm. Từ các tính chất của kẽm con người đã dùng nguyên tố đó để làm lớp phủ chống ăn mòn trên thép, pin kẽm, và các hợp kim. Nhiều hợp chất kẽm được sử dụng phổ biến như kẽm cacbonat, kẽm gluconat (bổ sung dinh dưỡng), kẽm chloride (chất khử mùi), kẽm pyrithion (dầu gội đầu trị gàu), kẽm sulfide (sơn huỳnh quang), và kẽm methyl hay kẽm diethyl sử dụng trong hóa hữu cơ ở phòng thí nghiệm.
Kẽm là một chất khoáng vi lượng thiết yếu cho sinh vật và sức khỏe con người, đặc biệt trong quá trình phát triển của thai nhi và trẻ sơ sinh.[7] Khoảng 2 tỷ người ở các nước đang phát triển bị thiếu kẽm.[8] Trẻ em bị thiếu kẽm sẽ bị chậm phát triển, phát triển cơ quan sinh dục trễ, dễ nhiễm trùng và tiêu chảy; mỗi năm khoảng 800.000 trẻ em trên thế giới chết do bị thiếu kẽm.[7] Các enzym liên kết với kẽm có vai trò quan trọng ở con người và nghiên cứu về hoá hữu cơ.[9] Tiêu thụ quá nhiều kẽm ở người có thể gây hôn mê, mệt mỏi và bị các triệu chứng của việc thiếu đồng.
Tính chất
Vật lý
Kẽm có màu trắng xanh, óng ánh và nghịch từ,[10] mặc dù hầu hết kẽm phẩm cấp thương mại có màu xám xỉn.[11] Phân bố tinh thể của kẽm loãng hơn sắt và có cấu trúc tinh thể sáu phương[12] với một kết cấu lục giác không đều, trong đó mỗi nguyên tử có sáu nguyên tử gần nhất (cách 265,9 pm) trong mặt phẳng riêng của chúng và sáu nguyên tử khác tại khoảng cách lớn hơn 290,6 pm.[13]
Kẽm kim loại cứng và giòn ở hầu hết cấp nhiệt độ nhưng trở nên dễ uốn từ 100 đến 150 °C.[10][11] Trên 210 °C, kim loại kẽm giòn trở lại và có thể được tán nhỏ bằng lực.[14] Kẽm dẫn điện khá.[10] So với các kim loại khác, kẽm có độ nóng chảy (419,5 °C, 787,1F) và điểm sôi (907 °C) tương đối thấp.[15] Điểm sôi của nó là một trong số những điểm sôi thấp nhất của các kim loại chuyển tiếp, chỉ cao hơn thủy ngân và cadmi.[15]
Một số hợp kim với kẽm như đồng thau, là hợp kim của kẽm và đồng. Các kim loại khác có thể tạo hợp kim 2 phần với kẽm như nhôm, antimon, bismuth, vàng, sắt, chì, thủy ngân, bạc, thiếc, magnesi, cobalt, nickel, teluride và natri.[16] Tuy cả kẽm và zirconi không có tính sắt từ, nhưng hợp kim của chúng ZrZn
2 lại thể hiện tính chất sắt từ dưới 35 K.[10]
Phân bố
Kẽm chiếm khoảng 75 ppm (0,0075%) trong vỏ Trái Đất, là nguyên tố phổ biến thứ 24. Đất chứa 5-770 ppm kẽm với giá trị trung bình 64 ppm. Nước biển chỉ chứa 30 ppb kẽm và trong khí quyển chứa 0,1-4 µg/m³.[17]

Nguyên tố này thường đi cùng với các nguyên tố kim loại thông thường khác như đồng và chì ở dạng quặng.[18] Kẽm là một nguyên tố ưa tạo quặng (chalcophile), nghĩa là nguyên tố có ái lực thấp với oxy và thường liên kết với lưu huỳnh để tạo ra các sulfide. Các nguyên tố ưa tạo quặng hình thành ở dạng lớp vỏ hóa cứng trong các điều kiện khử của khí quyển Trái Đất.[19] Sphalerit là một dạng kẽm sulfide, và là loại quặng chứa nhiều kẽm nhất với hàm lượng kẽm lên đến 60-62%.[18]
Các loại quặng khác có thể thu hồi được kẽm như smithsonit (kẽm cacbonat), hemimorphit (kẽm silicat), wurtzit (loại kẽm sulfide khác), và đôi khi là hydrozincit (kẽm cacbonat).[20] Ngoại trừ wurtzit, tất cả các khoáng trên được hình thành từ các quá trình phong hóa kẽm sulfide nguyên sinh.[19]
Tổng tài nguyên kẽm trên thế giới đã được xác nhận vào khoảng 1,9 tỉ tấn.[21] Các mỏ kẽm lớn phân bố ở Úc và Mỹ, và trữ lượng kẽm lớn nhất ở Iran, trong đó Iran có trữ lượng lớn nhất.[19][22][23] Với tốc độ tiêu thụ như hiện nay thì nguồn tài nguyên này ước tính sẽ cạn kiệt vào khoảng năm từ 2027 đến 2055.[24][25] Khoảng 346 triệu tấn kẽm đã được sản xuất trong suốt chiều dài lịch sử cho đến năm 2002, và theo một ước lượng cho thấy khoảng 109 triệu tấn tồn tại ở các dạng đang sử dụng.[26]
Đồng vị
Kẽm trong tự nhiên là hỗn hợp của 5 đồng vị ổn định 64Zn, 66Zn, 67Zn, 68Zn và 70Zn, trong đó đồng vị 64 là phổ biến nhất (48,6% trong tự nhiên)[27] với chu kỳ bán rã 43×1018 năm,[28] do đó tính phóng xạ của nó có thể bỏ qua.[29] Tương tự, 70
30Zn
(0,6%), có chu kỳ bán rã 13×1016 năm thường không được xem là có tính phóng xạ. Các đồng vị khác là 66
Zn (28%), 67
Zn (4%) và 68
Zn (19%).
Một số đồng vị phóng xạ đã được nhận dạng. 65
Zn có chu kỳ bán rã 243,66 ngày, là đồng vị tồn tại lâu nhất, theo sau là 72
Zn có chu kỳ bán rã 46,5 giờ.[27] Kẽm có 10 đồng phân hạt nhân.69mZn có chu kỳ bán rã 13,76 giờ.[27] (tham số mũ m chỉ đồng vị giả ổn định). Các hạt nhân của đồng vị giả ổn định ở trong trạng thái kích thích và sẽ trở về trạng thái bình thường khi phát ra photon ở dạng tia gamma. 61
Zn có 3 trạng thái kích thích và 73
Zn có 2 trạng thái.[30] Mỗi đồng vị 65
Zn, 71
Zn, 77
Zn và 78
Zn chỉ có một trạng thái kích thích.[27]
Cơ chế phân rã phổ biến của đồng vị phóng xạ kẽm có số khối nhỏ hơn 66 là bắt electron, sản phẩm tạo thành là một đồng vị của đồng.[27]
- n
30Zn
+ e⁻
→ n
29Cu
Cơ chế phân rã phổ biến của đồng vị phóng xạ kẽm có số khối lớn hơn 66 là phân rã beta (β-), sản phẩm tạo ra là đồng vị của gali.[27]
- n
30Zn
→ n
31Ga
+ e⁻
+ ν
e
Tính chất hóa học và các hợp chất
Khả năng phản ứng

Kẽm có cấu hình electron là [Ar]3d104s2 và là nguyên tố thuộc nhóm 12 trong bảng tuần hoàn. Nó là kim loại có độ hoạt động trung bình và là chất oxy hóa mạnh.[31] Bề mặt của kim loại kẽm tinh khiết xỉn nhanh, thậm chí hình thành một lớp thụ động bảo vệ là Hydrozincit, Zn
5(OH)
6(CO3)
2, khi phản ứng với cacbon dioxide trong khí quyển.[32] Lớp này giúp chống lại quá trình phản ứng tiếp theo với nước và hydro.
Kẽm cháy trong không khí cho ngọn lửa màu xanh lục tạo ra khói kẽm oxide.[33] Kẽm dễ dàng phản ứng với các acid, kiềm và các phi kim khác.[34] Kẽm cực kỳ tinh khiết chỉ phản ứng một cách chậm chạp với các acid ở nhiệt độ phòng.[33] Các acid mạnh như acid clohydric hay acid sulfuric có thể hòa tan lớp bảo vệ bên ngoài và sau đó kẽm phản ứng với nước giải phóng khí hydro.[33]
Tính chất hóa học của kẽm đặc trưng bởi trạng thái oxy hóa +2. Khi các hợp chất ở trạng thái này được hình thành thì các electron lớp s bị mất đi, và ion kẽm có cấu hình electron [Ar]3d10.[35] Quá trình này cho phép tạo 4 liên kết bằng cách tiếp nhận thêm 4 cặp electron theo quy tắc bộ tám. Dạng cấu tạo hóa học lập thể là tứ diện và các liên kết có thể được miêu tả như sự tạo thành của các orbitan lai ghép sp3 của ion kẽm.[36] Trong dung dịch, nó tạo phức phổ biến dạng bát diện là [Zn(H
2O)6]2+
.[37] Sự bay hơi của kẽm khi kết hợp với kẽm chloride ở nhiệt độ trên 285 °C chỉ ra sự hình thành Zn
2Cl
2, một hợp chất kẽm có trạng thái oxy hóa +1.[33] Không có hợp chất kẽm nào mà kẽm có trạng thái oxy hóa khác +1 hoặc +2.[38] Các tính toán chỉ ra rằng hợp chất kẽm có trạng thái oxy hóa +4 không thể tồn tại.[39]
Tính chất hóa học của kẽm tương tự tính chất của các kim loại chuyển tiếp nằm ở vị trí cuối cùng của hàng đầu tiên như nickel và đồng, mặc dù nó có lớp d được lấp đầy electron, do đó các hợp chất của nó là nghịch từ và hầu như không màu.[40] Bán kính ion của kẽm và magnesi gần như bằng nhau. Do đó một số muối của chúng có cùng cấu trúc tinh thể[41] và trong một số trường hợp khi bán kính ion là yếu tố quyết định thì tính chất hóa học của kẽm và magnesi là rất giống nhau.[33] còn nếu không thì chúng có rất ít nét tương đồng. Kẽm có khuynh hướng tạo thành các liên kết cộng hóa trị với cấp độ cao hơn và nó tạo thành các phức bền hơn với các chất cho N- và S.[40] Các phức của kẽm hầu hết là có phối vị 4 hoặc 6, tuy nhiên phức phối vị 5 cũng có.[33]
Hợp chất


Hợp chất hai nguyên tố của kẽm được tạo ra với hầu hết á kim và tất cả các phi kim trừ khí hiếm. ZnO là chất bột màu trắng và hầu như không tan trong các dung dịch trung tính, vì là một chất trung tính nó tan trong cả dung dịch acid và base.[33] Các chalcogenua khác (ZnS, ZnSe, và ZnTe) có nhiều ứng dụng khác nhau trong điện tử và quang học.[42] Pnictogenua (Zn
3N
2, Zn
3P
2, Zn
3As
2 và Zn
3Sb
2),[43][44] peroxide (ZnO
2), hydride (ZnH
2), và carbide (ZnC
2) cũng tồn tại.[45] Trong số 4 halide, ZnF
2 có đặc trưng ion nhiều nhất, trong khi các hợp chất halide khác (ZnCl
2, ZnBr
2, và ZnI
2) có điểm nóng chảy tương đối thấp và được xem là có nhiều đặc trưng cộng hóa trị hơn.[46]
Trong các dung dịch base yếu chứa các ion Zn2+
, hydroxide Zn(OH)
2 tạo thành ở dạng kết tủa màu trắng. Trong các dung dịch kiềm mạnh hơn, hydroxide này bị hòa tan và tạo zincat ([Zn(OH)4]2−
).[33] Nitrat Zn(NO3)
2, clorat Zn(ClO3)
2, sulfat ZnSO
4, phosphat Zn
3(PO4)
2, molybdat ZnMoO
4, cyanide Zn(CN)
2, asenit Zn(AsO2)
2, asenat Zn3(AsO4)2.8H2O và cromat ZnCrO
4 (một trong những hợp chất kẽm có màu) là một vài ví dụ về các hợp chất vô cơ phổ biến của kẽm.[47][48] Một trong những ví dụ đơn giản nhất về hợp chất hữu cơ của kẽm là acetat (Zn(O
2CCH3)
2).
Các hợp chất hữu cơ của kẽm là dạng hợp chất mà trong đó có các liên kết cộng hóa trị kẽm-cacbon. Diethyl kẽm ((C
2H5)
2Zn) là một thuốc thử trong hóa tổng hợp. Nó được công bố đầu tiên năm 1848 từ phản ứng của kẽm và ethyl iodide, và là hợp chất đầu tiên chứa liên kết sigma kim loại-cacbon.[49] Decamethyldizincocen chứa một liên kết mạnh kẽm-kẽm ở nhiệt độ phòng.[50]
Lịch sử
Thời kỳ cổ đại
Các mẫu vật riêng biệt sử dụng kẽm không nguyên chất trong thời kỳ cổ đại đã được phát hiện. Các loại quặng kẽm đã được sử dụng để làm hợp kim đồng-kẽm là đồng thau vài thế kỷ trước khi phát hiện ra kẽm ở dạng nguyên tố riêng biệt. Đồng thau Palestin có từ thế kỷ XIV TCN đến thế kỷ X TCN chứa 23% kẽm.[5]
Hiểu biết về cách sản xuất đồng thau phổ biến ở Hy Lạp cổ đại từ thế kỷ VII TCN, nhưng chỉ có vài mẫu được thực hiện.[6] Các đồ trang trí bằng hợp kim chứa 80-90% kẽm với chì, sắt, antimon và các kim loại khác cấu thành phần còn lại, đã được phát hiện có độ tuổi là 2.500 năm.[18] Một bức tượng nhỏ có thể từ thời tiền sử chứa 87,5% kẽm được tìm thấy ở di chỉ khảo cổ Dacia ở Transilvania (Romania ngày nay).[51]
Các viên thuốc cổ nhất được làm từ kẽm cacbonat hydrozincit và smithsonit. Các viên thuốc này được dùng để chữa đau mắt và được tìm thấy trên tàu La Mã Relitto del Pozzino bị đắm năm 140 TCN.[52][53]
Việc sản xuất đồ đồng thau đã được người La Mã biết đến vào khoảng năm 30 TCN,[54] họ sử dụng công nghệ nấu calamin (kẽm silicat hay cacbonat) với than củi và đồng trong các nồi nấu.[54] Lượng oxide kẽm giảm xuống và kẽm tự do bị đồng giữ lại, tạo ra hợp kim là đồng thau. Đồng thau sau đó được đúc hay rèn thành các chủng loại đồ vật và vũ khí.[55] Một số tiền xu từ người La Mã trong thời đại Công giáo được làm từ loại vật liệu có thể là đồng thau calamin.[56] Ở phương Tây, kẽm lẫn tạp chất từ thời cổ đại tồn tại ở dạng tàn dư trong lò nung chảy, nhưng nó thường bị bỏ đi vì người ta nghĩ nó không có giá trị.[57]
Bảng kẽm Bern là một tấm thẻ tạ ơn có niên đại tới thời kỳ Gaul La Mã được làm bằng hợp kim bao gồm phần lớn là kẽm.[58] Một số văn bản cổ đại dường như cũng đề cập đến kẽm. Sử gia Hy Lạp Strabo, trong một đoạn văn lấy từ nhà văn trước đó trong thế kỷ IV TCN, đề cập tới "những giọt bạc giả", được trộn lẫn với đồng để làm đồng thau. Điều này có thể đề cập đến một lượng nhỏ kẽm là phụ phẩm của quá trình nung chảy quặng sulfide.[59] Charaka Samhita, cho là đã được viết vào 500 TCN hay trước đó nữa, đề cập đến một kim loại mà khi bị oxy hóa, tạo ra pushpanjan, sản phẩm được cho là kẽm oxide.[60]
Các mỏ kẽm ở Zawar, gần Udaipur, Ấn Độ đã từng hoạt động từ thời đại Maurya vào cuối thiên niên kỷ 1 TCN. Việc nấu chảy và phân lập kẽm nguyên chất đã được những người Ấn Độ thực hiện sớm nhất vào thế kỷ XII.[61][62] Một ước tính cho thấy rằng khu vực này đã sản xuất ra khoảng vài triệu tấn kẽm kim loại và kẽm oxide từ thế kỷ XII đến thế kỷ XVI.[20] Một ước tính khác đưa ra con số sản lượng là 60.000 tấn kẽm kim loại trong giai đoạn này.[61] Rasaratna Samuccaya, được viết vào khoảng thế kỷ XIV, đề cập đến hai loại quặng chứa kẽm; một loại được sử dụng để tách kim loại và loại khác được dùng cho y học.[62]
Các nghiên cứu trước đây và tên gọi
Kẽm đã từng được công nhận là một kim loại có tên gọi ban đầu là Fasada theo như y học Lexicon được cho là của vua Hindu Madanapala và được viết vào khoảng năm 1374.[63] Nung chảy và tách kẽm nguyên chất bằng cách khử calamin với len và các chất hữu cơ khác đã được tiến hành vào thế kỷ XIII ở Ấn Độ.[10][64] Người Trung Quốc cho tới thế kỷ XVII vẫn chưa học được kỹ thuật này.[64]

Các nhà giả kim thuật đã đốt kẽm kim loại trong không khí và thu được kẽm oxide trong một lò ngưng tụ. Một số nhà giả kim thuật gọi loại kẽm oxide này là lana philosophica, tiếng Latin có nghĩa là "len của các nhà triết học", do nó được thu hồi từ búi len trong khi những người khác nghĩ nó giống như tuyết trắng và đặt tên nó là nix album.[65]
Tên gọi của kẽm ở phương Tây có thể được ghi nhận đầu tiên bởi nhà giả kim Đức gốc Thụy Sĩ Paracelsus, ông đã gọi tên kim loại này là "zincum" hay "zinken" trong quyển sách của mình là Liber Mineralium II được viết vào thế kỷ XVI.[64][66] Từ này có thể bắt nguồn từ tiếng Đức zinke, và có thể có nghĩa là "giống như răng, nhọn hoặc lởm chởm" (các tinh thể kẽm kim loại có hình dạng giống như những chiếc kim).[67] Zink cũng có thể ám chỉ "giống như tin (thiếc)" do mối quan hệ của nó (trong tiếng Đức zinn nghĩa là thiếc).[68] Một khả năng khác có thể là từ đó xuất phát từ tiếng Ba Tư سنگ seng nghĩa là đá.[69] Kim loại cũng có thể gọi là thiếc Ấn Độ, tutanego, calamin, và spinter.[18]
Nhà luyện kim người Đức Andreas Libavius đã nhận được một lượng vật liệu mà ông gọi là "calay" của Malabar từ một tàu chở hàng bắt được ở Bồ Đào Nha năm 1596.[70] Libavius đã miêu tả các thuộc tính của mẫu vật có thể là kẽm này. Kẽm thường được nhập khẩu đến châu Âu từ các nước phương Đông trong thế kỷ XVII và đầu thế kỷ XVIII,[64] nhưng rất đắt giá vào lúc đó.[note 1]
Tách kẽm

Việc tách kẽm kim loại đã được thực hiện ở Ấn Độ vào năm 1300,[71][72][73] sớm hơn nhiều so với phương Tây. Trước khi nó được thực hiện ở châu Âu, nó đã được nhập khẩu vào Ấn Độ khoảng năm 1600.[74] Việc tách kim loại kẽm ở phương Tây có thể đã đạt được những thành tựu một cách độc lập từ một số người. Universal Dictionary (Từ điển tổng hợp) của Postlewayt, một nguồn cung cấp thông tin kỹ thuật ở châu Âu, đã không đề cập đến kẽm trước năm 1751, nhưng nguyên tố này đã được nghiên cứu từ trước đó.[62][75]
Nhà luyện kim người Flanders là P.M. de Respour đã công bố rằng ông đã tách được kẽm kim loại từ kẽm oxide năm 1668.[20] Sau đó, Étienne François Geoffroy đã miêu tả cách thức mà kẽm oxide cô đặc lại thành các tinh thể màu vàng trên các thanh sắt được đặt bên trên các quặng kẽm đang nóng chảy.[20] Ở Anh, John Lane được cho là đã tiến hành các thí nghiệm để nung chảy kẽm, có thể ở Landore, trước khi ông phá sản năm 1726.[76]
Năm 1738, William Champion được cấp bằng sáng chế ở Đại Anh cho quá trình tách kẽm từ calamin trong một lò luyện theo kiểu bình cổ cong thẳng đứng.[77] Công nghệ của ông một phần nào đó giống với cách được sử dụng trong các mỏ kẽm ở Zawar thuộc Rajasthan nhưng không có bằng chứng nào cho thấy ông đã đến vùng phương đông.[74] Phương pháp của Champion được sử dụng suốt năm 1851.[64]
Nhà hóa học người Đức Andreas Marggraf được xem là có công trong việc phát hiện ra kẽm kim loại nguyên chất mặc dù nhà hóa học Thụy Điển là Anton von Swab đã chưng cất kẽm từ calamin 4 năm trước đó.[64] Trong thí nghiệm năm 1746 của ông, Marggraf đã nung hỗm hợp calamin và than củi trong một buồng kín không có đồng để lấy kim loại.[57] Quy trình này được ứng dụng ở quy mô thương mại từ năm 1752.[78]
Các công trình sau này

Một người anh em của William Champion là John đã nhận được bằng sáng chế năm 1758 về việc nung kẽm sulfide thành một oxide có thể sử dụng trong quy trình chưng cất bằng lò cổ cong.[18] Trước đó chỉ có calamin mới có thể được sử dụng để sản xuất kẽm. Năm 1798, Johann Christian Ruberg cải tiến quá trình nung chảy bằng cách xây dựng một lò nung chưng cất nằm ngang.[79] Jean-Jacques Daniel Dony đã xây dựng một lò nung chảy nằm ngang theo một kiểu khác ở Bỉ, lò nung này có thể xử lý nhiều kẽm hơn.[64] Bác sĩ người Ý Luigi Galvani khám phá ra vào năm 1780 rằng việc kết nối tủy sống của một con ếch vừa mới mổ với một sợi sắt có gắn một cái mốc bằng đồng thau sẽ làm cho chân ếch co giật.[80] Ông ta đã nghĩ không chính xác rằng ông đã phát hiện một khả năng của nơ ron và cơ để tạo ra điện và gọi đó là hiệu ứng "điện động vật".[81] Tế bào mạ và quá trình mạ đều được đặt tên theo Luigi Galvani và những phát hiện này đã mở đường cho pin điện, mạ điện và chống ăn mòn điện.[81]
Bạn của Galvani là Alessandro Volta đã tiếp tục nghiên cứu hiệu ứng này và đã phát minh ra pin Volta năm 1800.[80] Đơn vị cơ bản của pin Volta là các tế bào mạ điện được đơn giản hóa, chúng được làm từ một tấm đồng và một tấm kẽm được gắn kết với nhau ở bên ngoài và ngăn cách bởi một lớp điện ly. Các tấm này được xếp thành một chuỗi để tạo ra tế bào Volta, các tế bào này tạo ra điện bằng các dòng electron chạy từ tấm kẽm qua tấm đồng và cho phép kẽm ăn mòn.[80]
Tính chất không từ tính của kẽm và không màu của nó trong dung dịch đã làm trì hoãn việc phát hiện ra những tính chất quan trọng của chíng trong sinh hóa và dinh dưỡng.[82] Nhưng điều đó đã thay đổi vào năm 1940 khi mà cacbonic anhydrase, một loại enzym đẩy cacbon dioxide ra khỏi máu, đã cho thấy kẽm có vai trò quan trọng trong nó.[82] Enzym tiêu hóa carboxypeptidase là enzym chứa kẽm thứ hai được phát hiện năm 1955.[82]
Sản xuất
Khai thác mỏ và xử lý

Kẽm là kim loại được sử dụng phổ biến thứ 4 sau sắt, nhôm và đồng với sản lượng hàng năm khoảng 13 triệu tấn.[21] Nhà sản xuất kẽm lớn nhất thế giới là Nyrstar, công ty sáp nhập từ OZ Minerals của Úc và Umicore của Bỉ.[84] Khoảng 70% lượng kẽm trên thế giới có nguồn gốc từ khai thác mỏ, lượng còn lại từ hoạt động tái sử dụng.[85] Kẽm tinh khiết cấp thương mại có tên gọi trong giao dịch tiếng Anh là Special High Grade (SHG) có độ tinh khiết 99,995%.[86]
Trên toàn cầu, 95% kẽm được khai thác từ các mỏ quặng sulfide, trong đó ZnS luôn lẫn với đồng, chì và sắt sulfide.[87] Có nhiều mỏ kẽm trên khắp thế giới nhưng chủ yếu ở Trung Quốc, Úc và Peru. Trung Quốc sản xuất 29% lượng kẽm toàn cầu năm 2010.[21]
Kẽm kim loại được sản xuất bằng luyện kim khai khoáng.[88] Sau khi nghiền quặng, phương pháp tuyển nổi bọt được sử dụng để tách các khoáng dựa vào tính dính ướt khác nhau của chúng.[88] Ở bước cuối cùng này thì kẽm chiếm 50%, phần còn lại là lưu huỳnh (32%), sắt (13%), và SiO
2 (5%).[88]
Công đoạn thiêu kết sẽ chuyển kẽm sulfide thành kẽm oxide:[87]
- 2 ZnS + 3 O
2 → 2 ZnO + 2 SO
2
Lưu huỳnh dioxide sinh ra sẽ được thu hồi để sản xuất acid sulfuric. Nếu các mỏ có loại khoáng sản khác là kẽm cacbonat, kẽm silicat hoặc kẽm spinel như ở mỏ Skorpion, Namibia thì không sử dụng công đoạn thiêu kết này.[89]
Sau đó, người ta có thể dùng 2 phương pháp cơ bản trong luyện kim là nhiệt luyện (pyrometallurgy) hoặc điện chiết (electrowinning). Quá trình nhiệt luyện khử kẽm oxide với cacbon hoặc cacbon mônoxide ở 950 °C (1.740 °F) thành kim loại kẽm ở dạng hơi.[90] Hơi kẽm được thu hồi trong bình ngưng.[87] Quá trình được biểu diễn theo các phương trình dưới đây:[87]
- 2 ZnO + C → 2 Zn + CO
2 - 2 ZnO + 2 CO → 2 Zn + 2 CO
2
Quá trình điện chiết tách kẽm từ quặng tinh bằng acid sulfuric:[91]
- ZnO + H
2SO
4 → ZnSO
4 + H
2O
Sau đó, người ta dùng phương pháp điện phân để sản xuất kẽm kim loại.[87]
- 2 ZnSO
4 + 2 H
2O → 2 Zn + 2 H
2SO
4 + O
2
Acid sulfuric sinh ra được tái sử dụng trong bước trước đó.
Kẽm có mặt ở dạng bụi trong lò hồ quang điện do sử dụng nguyên liệu mạ kẽm được thu hồ bởi nhiều quá trình, chủ yếu là quá trình Waelz (90% đến năm 2014).[92]
Tác động môi trường
Quá trình sản xuất từ quặng kẽm sulfide thải ra một lượng lớn lưu huỳnh dioxide và hơi cadmi. Xỉ nóng chảy và các chất cặn khác trong quá trình sản xuất cũng chứa một lượng kim loại nặng đáng kể. Có khoảng 1,1 triệu tấn kẽm kim loại và 130 ngàn tấn chì đã được khai thác và nung chảy ở các thị trấn La Calamine và Plombières của Bỉ trong khoảng thời gian từ năm 1806 tới năm 1882.[93] Bãi thải của mỏ trước đây rò rỉ kẽm và cadmi, và các trầm tích trong sông Geul chứa một lượng kim loại nặng đáng kể.[93] Từ khoảng cách đây 2000 năm, lượng phát thải kẽm từ các nguồn khai thác mỏ và nung chảy đã thải ra tổng cộng 10 ngàn tấn mỗi năm. Đến năm 1850, lượng phát thải tăng lên gấp 10 lần, phát thải kẽm ở mức đỉnh vào khoảng 3,4 triệu tấn mỗi năm trong thập niên 1980 và giảm xuống 2,7 triệu tấn vào thập niên 1990, mặc dù theo một nghiên cứu năm 2005 về tầng đối lưu Bắc Cực chỉ ra rằng nồng độ kẽm không giảm. Các phát thải nhân tạo và tự nhiên xảy ra với tỷ lệ 20 trên 1.[94]
Hàm lượng kẽm trong các con sông chảy qua các khu công nghiệp và khu vực khai thác mỏ vào khoảng 20 ppm.[95] Công tác xử lý nước thải hiệu quả đã làm giảm đáng kể hàm lượng này; ví dụ như công tác xử lý nước thải dọc theo sông Rhine đã làm giảm lượng kẽm xuống còn 50 ppb.[95] Nồng độ kẽm ở mức 2 ppm ảnh hưởng xấu đến hàm lượng oxy trong máu cá.[96]
Đất ô nhiễm kẽm từ hoạt động khai thác quặng chứa kẽm, tuyển, hoặc nơi sử dụng bùn chứa kẽm để làm phân, có thể chứa hàm lượng kẽm ở mức vài gam kẽm/kg đất khô. Hàm lượng kẽm trong đất cao hơn 500 ppm ảnh hưởng tới khả năng hấp thu các kim loại cần thiết khác của thực vật, như sắt và mangan. Kẽm ở mức 2.000 ppm đến 180.000 ppm (18%) đã được ghi nhận trong một số mẫu đất.[95]
Ứng dụng



Kẽm là kim loại được sử dụng phổ biến hàng thứ tư sau sắt, nhôm, đồng tính theo lượng sản xuất hàng năm. Các ứng dụng chính của kẽm (số liệu là ở Hoa Kỳ)[99]
- Mạ kẽm (55%)
- Hợp kim (21%)
- Đồng thau và đồng điếu (16%)
- Khác (8%)
Chống ăn mòn và pin
Kim loại kẽm chủ yếu được dùng làm chất chống ăn mòn,[100] ở dạng mạ. Năm 2009 ở Hoa Kỳ, 55% tương đương 893 nghìn tấn kẽm kim loại được dùng để mạ.[99]
Kẽm phản ứng mạnh hơn sắt hoặc thép và do đó nó sẽ dễ bị oxy hóa cho đến khi nó bị ăn mòn hoàn toàn.[101] Một lớp tráng bề mặt ở dạng bằng oxide và cacbonat (Zn
5(OH)
6(CO
3)
2) là một chất ăn mòn từ kẽm.[102] Lớp bảo vệ này tồn tại kéo dài ngay cả sau khi lớp kẽm bị trầy xước, nhưng nó sẽ giảm theo thời gian khi lớp ăn mòn kẽm bị tróc đi.[102] Kẽm được phủ lên theo phương pháp hóa điện bằng cách phun hoặc mạ nhúng nóng.[17] Mạ kẽm được sử dụng trên rào kẽm gai, rào bảo vệ, cầu treo, mái kim loại, thiết bị trao đổi nhiệt, và các bộ phận của ô tô.[17]
Độ hoạt động tương đối của kẽm và khả năng của nó bị oxy hóa làm nó có hiệu quả trong việc hi sinh anot để bảo vệ ăn mòn catot. Ví dụ, bảo vệ catot của một đường ống được chôn dưới đất có thể đạt hiệu quả bằng cách kết nối các anot được làm bằng kẽm với các ống này.[102] Kẽm có vai trò như một anot (âm) bằng các ăn mòn một cách chậm chạp khi dòng điện chạy qua nó đến ống dẫn bằng thép.[102][note 2] Kẽm cũng được sử dụng trong việc bảo vệ các kim loại được dùng làm catot khi chúng bị ăn mòn khi tiếp xúc với nước biển.[103] Một đĩa kẽm được gắn với một bánh lái bằng sắt của tàu sẽ làm chậm tốc độ ăn mòn so với không gắn tấm kẽm này.[101] Các ứng dụng tương tự như gắn kẽm vào chân vịt hoặc lớp kim loại bảo vệ lườn tàu.

Với một thế điện cực chuẩn (SEP) 0,76 vôn, kẽm được sử dụng làm vật liệu anot cho pin. Bột kẽm được sử dụng theo cách này trong các loại pin kiềm và các tấm kẽm kim loại tạo thành vỏ bọc và cũng là anot trong pin kẽm-cacbon.[104][105] Kẽm được sử dụng làm anot hoặc nhiên liệu cho tế bào nhiêu liệu kẽm/pin kẽm-không khí.[106][107][108] Pin dòng oxy hóa khử kẽm-xêri cũng dựa trên một nửa tế bào âm kẽm.[109]
Hợp kim
Hợp kim của kẽm được sử dụng rộng rãi nhất là đồng thau, bao gồm đồng và khoảng từ 3% đến 45% kẽm tùy theo loại đồng thau.[102] Đồng thau nhìn chung giòn và cứng hơn đồng và có khả năng chống ăn mòn rất cao.[102] Các tính chất này giúp nó được sử dụng nhiều trong các thiết bị truyền thông, phần cứng máy tính, dụng cụ âm nhạc, và các van nước.[102]

Các ứng dụng rộng rãi khác của hợp kim chứa kẽm bao gồm nickel bạc, máy đánh chữ bằng kim loại, hàn nhôm và mềm, và đồng điếu thương mại.[10] Kẽm cũng được sử dụng trong các bộ phận đường ống hiện đại như là một sản phẩm thay thế các đường ống trước đây sử dụng hợp kim chì/thiếc.[110] Các hợp kim chiếm 85-88% kẽm, 4-10% đồng, và 2-8% nhôm được sử dụng hạn chế trong một số trường hợp của các bệ nâng đỡ máy. Kẽm là một kim loại ban đầu được sử dụng trong việc sản xuất các đồng tiền 1 cent của Hoa Kỳ từ năm 1982.[111] Lõi kẽm được áo một lớp đồng mỏng để tạo độ bắt mắt của đồng tiền bằng đồng. Năm 1994, 33.200 tấn (36.600 tấn Mỹ) kẽm được sử dụng để sản xuất 13,6 triệu đồng xu ở Hoa Kỳ.[112]
Các hợp kim chủ yếu là kẽm với một lượng nhỏ đồng, nhôm, và magnesi có ích trong việc đúc áp lực cũng như đúc quay, đặc biệt trong các ngành công nghiệp tự động, điện tử, và phần cứng.[10] Các hợp kim này được chào bán trên thị trường với tên gọi là Zamak.[113] Ví dụ về hợp kim kẽm nhôm, nó có điểm nóng chảy thấp và độ nhớt thấp nên có thể chế tạo ra những vật có hình dạng nhỏ và phức tạp. Nhiệt độ gia công thấp làm cho các sản phẩm đúc nguội nhanh và do đó có thế lắp ráp chúng một cách nhanh chóng.[10][114] Một hợp kim khác được chào bán trên thị trường với tên gọi là Prestal chứa 78% kẽm và 22% nhôm và được cho là có độ cứng gần bằng thép nhưng lại dẻo như nhựa.[10][115] Tính chất siêu nhựa này của hợp kim cho phép đúc chúng dễ dàng trong các khuôn bằng sứ và xi măng.[10]
Các hợp kim tương tự khi có thêm vào một lượng nhỏ chì có thể cán nguội thành các tấm. Hợp kim có 96% kẽm và 4% nhôm được sử dụng để làm khuôn dập cho các ứng dụng có tốc độ sản xuất thấp mà khuôn dập bằng kim loại đen có thể quá đắt.[116] Trong việc xây các bề mặt ngoài, mái nhà hoặc các ứng dụng khác, kẽm được sử dụng ở dạng tấm kim loại và có thể dùng để cán, cuộn hoặc uốn người ta sử dụng các hợp kim của kẽm với titan và đồng.[117]
Là một vật liệu dễ gia công, không đắt mà nặng, kẽm được sử dụng để thay thế cho chì. Do ngộ độc chì ngày càng nhiều nên kẽm được dùng làm vật nặng trong nhiều ứng dụng khác nhau như câu cá[118] đến cân bằng lốp và bánh đà (bánh trớn).[119]
Kẽm cadmi tellurua (CZT) là một hợp kim bán dẫn có thể được chia thành một chuỗi các thiết bị cảm ứng nhỏ.[120] Các thiết bị này tương tự như mạch tích hợp và có thể phát hiện nguồn năng lượng của các photon tia gama.[120] Khi được đặt sau một mặt nạ hấp thụ, thiết bị cảm ứng CZT cũng có thể được sử dụng để xác định hướng của các tia gamma.[120]
Các ứng dụng công nghiệp khác

Gần 1/4 tổng sản lượng kẽm của Hoa Kỳ (2009) được dùng ở dạng hợp chất kẽm;[99] có nhiều loại được dùng ở quy mô công nghiệp. Kẽm oxide được sử dụng rộng rãi để làm chất tạo màu trắng trong sơn, và làm chất xúc tác trong công nghiệp chế biến cao su. Nó cũng được dùng làm chất phân tán nhiệt cho cao su và phản ứng để bảo vệ các polyme của cao su trước các tia tử ngoại (cách bảo vệ chống tia tử ngoại tương tự cũng được cho vào nhựa chứa oxide kẽm).[17] Các tính chất bán dẫn của kẽm oxide hữu ích trong các varistor và sản phẩm máy photocopy.[121] Vòng tuần hoàn kẽm-kẽm oxide là một quy trình gồm 3 bước hóa nhiệt trong đó dùng kẽm và kẽm oxide để sản xuất hydro.[122]
Kẽm cloura thường được cho vào gỗ để làm chất bắt cháy[123] và có thể được sử dụng để bảo quản gỗ.[124] Nó cũng được dùng để tạo các hóa chất khác.[123] Kẽm methyl (Zn(CH3)
2) được dùng trong nhiều phản ứng tổng hợp hữu cơ.[125] Kẽm sulfide (ZnS) được dùng làm chất tạo màu phát quang như trên các đồng hồ đeo tay, màn hình ti vi và tia X, và sơn phát quang.[126] Các tinh thể kẽm được dùng trong các tia laser hoạt động trong dãi quang phổ hồng ngoại giữa.[127] Kẽm sulfat là một chất hóa học trong nhuộm và tạo màu.[123] Kẽm pyrithion được dùng trong sơn chống gỉ.[128]
Bột kẽm đôi khi được dùng làm chất tạo lực đẩy trong các mô hình tên lửa.[129] Khi một hỗn hợp nén gồm 70% bột kẽm và 30% bột lưu huỳnh bị đốt cháy sẽ tạo ra một phản ứng hóa học mãnh liệt.[129] Phản ứng này tạo ra kẽm sulfide cùng một lượng lớn khí nóng, nhiệt và ánh sáng.[129] Kim loại kẽm dạng tấm được dùng để chế ra các thanh kẽm.[130]
64
Zn, là đồng vị phổ biến nhất của kẽm, rất dễ bị kích hoạt neutron, được chuyển hóa thành 65
Zn phóng xạ rất cao, hạt nhân mới này có chu kỳ bán rã 244 ngày và sinh ra các tia phóng xạ gamma cường độ cao. Do vậy, kẽm oxide được dùng trong các lò phản ứng hạt nhân để làm chất chống ăn mòn cạn kiệt của 64
Zn trước khi sử dụng. Vì lý do tương tự, kẽm đã được đề xuất ở dạng vật liệu muối dùng trong các vũ khí hạt nhân (coban là một ví dụ khác, là một loại vật liệu muối phổ biến hơn).[131] Một lớp áo kẽm 64
Zn được làm giàu đồng vị có thể được chiếu xạ mởi một dòng neutron cường độ năng lượng cao từ việc kích nổ vũ khí nhiệt hạt nhân, tạo thành một lượng lớn đồng vị 65
Zn làm tăng đáng kể bụi phóng xạ của vũ khí hạt nhân.[131] Vũ khí như thế này không biết là đã có chế tạo, thử nghiệm hay sử dụng chưa.[131] 65
Zn cũng được dùng làm đồng vị vết trong nghiên cứu làm thế nào mà các hợp kim chứa kẽm ăn mòn, hoặc con đường và vai trò của kẽm trong sinh vật.[132]
Các phức kẽm dithiocarbamat được dùng làm thuốc diệt nấm trong nông nghiệp; chúng gồm Zineb, Metiram, Propineb và Ziram.[133] Kẽm naphthenat được dùng là chất bảo quản gỗ.[134] Kẽm ở dạng ZDDP cũng được dùng làm chất phụ gia chống ăn mòn trong các bộ phận kim loại của các động cơ chạy dầu.[135]
Bổ sung trong khẩu phần ăn

Kẽm có trong hầu hết các khẩu phần ăn cung cấp dưỡng chất và vitamin hàng ngày.[136] Các sản phẩm chế biến gồm kẽm oxide, kẽm acetat, và kẽm gluconat.[136] Nó được tin là có tính chất chống oxy hóa, chúng có thể chống lại sự gia tăng tốc độ lão hóa của da và cơ trong cơ thể; các nghiên cứu chỉ ra sự khác biệt về các hiệu quả của nó.[137] Kẽm cũng giúp làm tăng tốc sự hồi phục vết thương.[137] Nó cũng có những tác dụng có lợi cho hệ miễn dịch của cơ thể. Do vậy, sự thiếu hụt kẽm có thể tác động đến hầu hết các phần của hệ miễn dịch ở con người.[138] Hiệu quả của các hợp chất kẽm khi sử dụng để làm giảm thời gian hoặc mức độ nghiên trọng của triệu chứng cảm vẫn còn là vấn đề gây tranh cãi.[139] Một cuộc đánh giá một cách có hệ thống năm 2011 kết luận rằng việc bổ sung kẽm sẽ làm giảm nhẹ thời gian và độ nghiêm trọng của bệnh cảm.[140]
Kẽm đóng vai trò là một công cụ đơn giản, rẻ tiền và quan trọng trong điều trị các cơn tiêu chảy ở trẻ em ở những nước đang phát triển. Khi tiêu chảy kẽm trong cơ thể giảm, nhưng các nghiên cứu gần đây chỉ ra rằng kẽm bổ sung trong vòng 10 đến 14 điều trị có thể giảm thời gian và độ nghiêm trọng của những côn tiêu chảy và cũng có thể chống lại các cơn tiêu chảy trong vòng 3 tháng sau đó.[141]

Nghiên cứu bệnh về mắt liên quan đến tuổi tác xác định rằng kẽm góp một phần trong việc điều trị hiệu quả bệnh thoái hóa điểm vàng liên quan đến tuổi.[142] Bổ sung kẽm là một cách điều trị hiệu quả bệnh rối loại di truyền liên quan đến hấp thu kẽm mà trước đây gây tử vong ở những trẻ mới mắc bệnh này bẩm sinh.[54]
Viêm dạ dày giảm mạnh khi uống kẽm, và hiệu ứng này có thể là do tính chất kháng khuẩn mạnh của các ion kẽm trong đường tiêu hóa, hoặc đối với sự hấp thụ kẽm và tái giải phóng từ các tế bào miễn dịch (tất cả hạch bạch cầu đều tiết ra kẽm), hoặc cả hai.[143][144][note 3] Năm 2011, các nghiên cứu viên ở trường cao đẳng tư pháp hình sự John Jay thông báo rằng việc cung cấp kẽm trong khẩu phần ăn có thể làm ẩn đi sự hiện diện của ma túy trong nước tiểu. Các tuyên bố tương tự cũng được đăng trên các diễn đàn về chủ đề đó.[145]
Mặc dù chưa thử nghiệm trong điều trị ở người, dấu hiệu của một cơ thể đang phát triển ám chỉ rằng kẽm có thể ưu tiên tiêu diệt tế bào ung thư tuyến tiền liệt. Do kẽm có mặt tự nhiên trong tuyến tiền liệt và vì tuyến này dễ xâm nhập với các phương thức không xâm lấn một cách tương đối, tiềm năng của nó như là một tác nhân hóa trị loại bệnh ung thư này thể hiện nhiều hứa hẹn.[146] Tuy nhiên, các nghiên cứu khác đã minh họa rằng sử dụng kẽm bổ sung lâu dài với liều lượng vượt mức cho phép có thể thực tế làm gia tăng cơ hội phát triển ung thư tuyến tiền liệt, cũng có thể là do sự tích tụ tự nhiên của kim loại nặng này trong tuyến tiền liệt.[147]
Viên ngậm kẽm và trị cảm thông thường
Những kết quả tích cực nhất trong việc sử dụng viên ngậm kẽm được phát hiện trong nghiên cứu trên kẽm acetat, thể hiện qua việc acetat không liên kết với các ion kẽm.[148][149] Các nghiên cứu cho đến nay cũng chưa đưa ra kết luận nhưng đã chỉ ra rằng các viên kẽm làm giảm các triệu chứng kẽm trong khi có thể gây ra tác dụng phụ như buồn nôn.[150] Những lợi ích của kẽm dùng trong điều trị cảm đã được mô tả là "rất ít".[151]
Cơ chế sinh học của tác dụng này chưa rõ, nhưng lợi ích của các loại kẽm thoi có vẻ bị gây nên bởi các hiệu ứng tại chỗ trong vùng hầu họng, vì điều trị kẽm qua đường mũi cũng rút ngắn thời gian cảm.[152][153]
Dùng làm thuốc ngoài da
Kẽm dùng trong điều trị ngoài da thường được làm từ kẽm oxide. Các hợp chất này có thể chống cháy nắng trong mùa hè và khô vì lạnh trong mùa đông.[54] Thoa một lớp mỏng trên vùng mặc tã của bé (perineum) mỗi lần thay tã lót có thể bảo vệ khỏi hăm do tã.[54]
Kẽm lactat được dùng trong kem đánh răng để chống chứng hôi miệng.[154] Kẽm pyrithion được sử dụng rộng rãi trong dầu gội đầu do nó có chức năng chống gàu.[155] Các ion kẽm là chất chống vi sinh rất hiệu quả thậm chí ở nồng độ thấp.[156]
Hóa hữu cơ
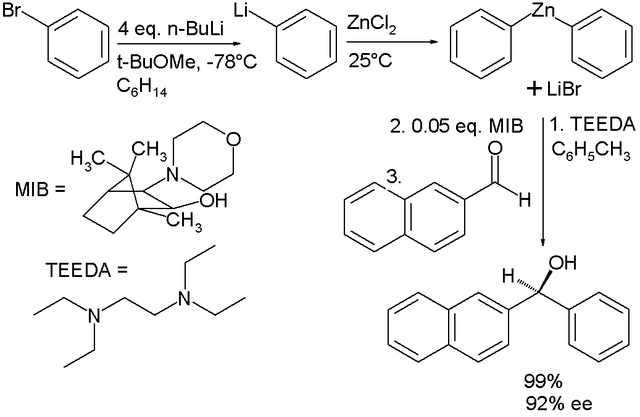
Có nhiều hợp chất kẽm hữu cơ quan trọng. Hóa học kẽm hữu cơ là một khoa học nghiên cứu về các hợp chất vô cơ của kẽm miêu tả đặc điểm vật lý, sự tổng hợp và các phản ứng của chúng.[157][158][159][160] Trong số các ứng dụng quan trọng phải kế đến là phản ứng Frankland-Duppa theo đó một oxalat ester(ROCOCOOR) phản ứng với alkyl halide R'X, kẽm và acid clohydrit để tạo ra ester α-hydroxycarboxylic RR'COHCOOR,[161] phản ứng Reformatskii biến đổi α-halo-ester và aldehyde thành β-hydroxy-ester, phản ứng Simmons-Smith theo đó kẽm carbenoid (iodomethyl) iodide phản ứng với alken (hoặc alkin) và biến đổi chúng thành cyclopropan, phản ứng thêm vào của các hợp chất kẽm hữu cơ tạo thành các hợp chất carbonyl. Phản ứng Barbier (1899) là sự cân bằng kẽm của phản ứng Grignard magnesi và tốt hơn là cả hai phản ứng. Sự có mặt của một lượng nước bất kỳ trong sự thành tạo magnesi hữu cơ halide sẽ không thành công, ngược lại phản ứng Barbier có thể thậm chí diễn ra trong môi trường nước. Mặt khác các kẽm hữu cơ ít ái nhân hơn Grignards, rất đắt và khó vận chuyển. Các hợp chất kẽm có hai gốc hữu cơ có trên thị trường là kẽm dimetyl, kẽm dietyl và kẽm diphenyl. Trong một nghiên cứu[162][note 4] hợp chất kẽm hữu cơ hoạt động được xem là rẽ hơn nhiều so với tiền chất brom hữu cơ:
Phản ứng song hợp Negishi cũng là một phản ứng quan trọng để tạo thành các liên kết carbon-carbon mới giữa các nguyên tử carbon không no trong alken, aren và alkyn. Các chất xúc tác là nickel và palladi. Một bước quan trọng trong chu vòng tuần hoàn xúc tác đó là kẽm halide trao đổi bằng cách thay thế gốc hữu cơ của nó với một halogen khác bằng kim loại palladi (nickel). Phản ứng song hợp Fukuyama là một kiểu phản ứng khác như phản ứng này có 3 gốc ester tham gia phản ứng để tạo thành một xeton.
Kẽm có nhiều ứng dụng làm chất xúc tác trong tổng hợp hữu cơ như tổng hợp bất đối xứng, là một phương pháp rẻ và dễ thực hiện thay cho các chất phức kim loại quý. Các kết quả thu được bằng cách sử dụng chất điện phân kẽm chiral có thể so sánh với phương pháp thu được palladi, rutheni, iridi và các kim loại khác và do đó kẽm trở thành kim loại được lựa chọn ngày càng nhiều cho mục đích này.[163]
Vai trò sinh học
Kẽm là nguyên tố cần thiết để duy trì sự sống của con người[164] cũng như các động vật khác,[165] thực vật,[94] và vi sinh vật.[166] Kẽm được tìm thấy trong gần 100 loại enzym đặc biệt[167] (các nguồn khác[168] cho rằng tới 300), có vai trò là các ion cấu trúc trong yếu tố phiên mã và được lưu trữ và vận chuyển ở dạng thionein kim loại.[169] Nó là "kim loại chuyển tiếp phổ biến thứ 2 trong sinh vật" sau sắt và nó là kim loại duy nhất có mặt trong tất cả các lớp enzym.[94]
Trong các protein, các ion kẽm thường liên kết với các chuỗi amino acid của acid aspartic, acid glutamic, cystein và histidin.[170] Việc miêu tả lý thuyết và tính toán của các liên kết kẽm trong các protein này cũng như đối với các kim loại chuyển tiếp khác còn khó khăn.[170]
Có từ 2-4 gam kẽm[171] phân bố trong khắp cơ thể con người. Hầu hết kẽm nằm trong não, cơ, xương, thận và gan, tuy nhiên nồng độ kẽm cao nhất tập trung trong tuyến tiền liệt và các bộ phận của mắt.[172] Tinh dịch đặc biệt rất giàu kẽm, vì đây là yếu tố quan trọng trong chức năng của tuyến tiền liệt và giúp phát triển cơ quan sinh dục.[173]
Kẽm đóng vai trò sinh học quan trọng đối với con người.[7] Nó tương tác với một loạt các phối tử hữu cơ,[7] và có vai trò quan trọng trong quá trình trao đổi chất của RNA và DNA, truyền tín hiệu và biểu hiện gen. Nó cũng quyết định quá trình chết rụng tế bào. Một nghiên cứu năm 2006 ước tính rằng khoảng 10% protein người (2.800) có thể phụ thuộc vào kẽm, thêm vào đó hàng trăm protein vận chuyển kẽm; một nghiên cứu tương tự về in silico trong loài thực vật Arabidopsis thaliana đã tìm thấy 2.367 protein liên quan đến kẽm.[94]
Trong não, kẽm được lưu trữ trong các synaptic vesicles đặc biệt bởi các tế bào thần kinh glutamatergic[174] và có thể "điều chỉnh khả năng kích thích não".[7] Nó có vai trò quan trọng trong synaptic plasticity và cũng như trong việc học.[175] Tuy nhiên, nó được gọi là "ngựa đen của não" ("the brain's dark horse")[174] vì nó cũng có thể là một chất độc thần kinh, homeostasis kẽm đóng vai trò quan trọng trong chức năng bình thường của não và hệ thần kinh trung ương.[174]
Enzym


Kẽm là một acid Lewis, là một chất xúc tác có ích trong quá trình hydroxyl hóa và các phản ứng enzym khác.[167] Kim loại kẽm cũng là một chất có phối hợp hình học linh động, điều này cho phép các protein sử dụng nó để thay đổi cấu trúc protein một cách nhanh chóng để thực hiện các phản ứng sinh học.[176] Hai ví dụ về các enzym chứa kẽm là carbonic anhydrase và carboxypeptidase, đây là các enzym cần thiết trong các quá trình của chuyển hóa cacbon dioxide (CO
2) và tiêu hóa protein theo thứ tự.[177]
Trong máu của động vật có xương sống, carbonic anhydrase chuyển hóa CO
2 thành bicacbonat và cùng enzym đó chuyển bicacbonat trở lại thành CO
2 khi thở qua phổi.[178] Nếu không có enzym này, sự biến đổi này có thể diễn ra chậm hơn khoảng 1 triệu lần[179] đối với máu bình thường có pH là 7 hoặc không thì pH phải 10 hoặc lớn hơn.[180] Anhydrase không liên quan β-carbonic là cần thiết cho sự hình thành lá ở thực vật, sự tổng hợp indole acid acetic (auxin) và hô hấp kị khí (lên men rượu).[181]
Carboxypeptidase tách các liên kết peptit trong quá trình tiêu hóa protein. Liên kết cộng hóa trị phối hợp được tạo ra giữa các peptit đầu cuối và nhóm C=O gắn với kẽm, làm cho cacbon tích điện dương. Yếu tố này giúp tạo ra một hốc kị nước trên enzym gần kẽm, làm hút phần không phân cực của protein bị tiêu hóa.[177]
Các protein khác
Kẽm có vai trò cấu trúc toàn bộ trong cụm, xoắn và ngón tay kẽm.[182] Các kẽm finger tạo thành các bộ phận của một số yếu tố phiên mã (transcription factor), chúng là các protein nhận dạng trình tự DNA trong quá trình phiên mã và sao chép DNA. Mỗi ion Zn2+
thứ 9 hoặc 10 trong ngón tay kẽm giúp duy trình cấu trúc của các ngón tay bằng cách tạo liên kết với 4 amino acid trong nhân tố phiên mã.[179] Yếu tố phiên mã bao bọc xung quanh xoắn DNA và sử dụng các finger của nó để liên kết một cách chính xác với chuỗi DNA.
Trong huyết tương, kẽm bị ràng buộc và bị vận chuyển bởi albumin (60%, ái lực thấp) và transferrin (10%).[171] Vì transferrin cũng vận chuyển sắt, khi lượng sắt tăng quá cao làm giảm khả năng hấp thụ kẽm và ngược lại. Phản ứng tương tự cũng xảy ra đối với đồng.[183] Hàm lượng kẽm trong huyết tương ở mức tương đối ổn định bất kể lượng kẽm tiêu thụ vào là bao nhiêu.[184] Các tế bào trong tuyến nước bọt, tuyến tiền liệt, hệ miễn dịch và ruột sử dụng tín hiệu kẽm như là cách để liên lạc với các tế bào khác.[185]
Kẽm có thể được giữ trong thionein kim loại trong vi sinh vật hoặc trong ruột hoặc gan động vật.[186] Thionein kim loại trong các tế bào ruột có thể điều chỉnh sự hấp thụ kẽm khoảng 15-40%.[187] Tuy nhiên thiếu hoặc thừa kẽm có thể gây hại; đặc biệt thừa kẽm làm giảm hấp thụ đồng do thionein kim loại hấp thụ cả hai kim loại như đã phân tích ở trên.[188]
Chế độ ăn uống

Ở Mỹ, chế độ ăn chỉ định (Recommended Dietary Allowance - RDA) là 8 mg/ngày đối với nữ giới và 11 mg/ngày đối với nam giới.[189] Chế độ ăn trung bình ở Mỹ năm 2000 là 9 mg/ngày đối với nữ giới và 14 mg/ngày đối với nam giới.[190] Hàu, tôm hùm[191] và các loại thịt đỏ, đặc biệt là thịt bò, thịt cừu và gan bò là các thực phẩm có hàm lượng kẽm cao.[173]
Hàm lượng kẽm trong thực vật thay đổi tùy theo hàm lượng nguyên tố này trong đất. Khi đất có đủ lượng kẽm, thực phẩm từ thực vật chứa kẽm nhiều như lúa mì, và các loại hạt khác (mè, anh túc, cỏ linh lăng, cần tây, mù tạc).[192] Các nguồn thức ăn tự nhiên giàu kẽm khác bao gồm: các loại quả có nhân, ngũ cốc nguyên vẹn, hạt bí hay hạt hướng dương.[193]
Các nguồn khác trong thực phẩm tăng cường và chế độ ăn uống bổ sung cũng có nhiều dạng. Một báo cáo năm 1998 kết luận rằng kẽm oxide, là một trong những chất bổ sung phổ biến nhất ở Mỹ, và kẽm cacbonat là loại gần như không hòa tan và kém được hấp thu trong cơ thể.[194] Bài báo này trích dẫn các nghiên cứu phát hiện rằng các hàm lượng kẽm plasma thấp sau khi ăn kẽm oxide và kẽm cacbonat so với những trường hợp sau khi tiêu thụ kẽm acetat và kẽm sulfat.[194] Tuy nhiên, bổ sung kẽm vượt mức gây hại là một vấn đề trong số những người tương đối giàu, và có thể không nên vượt quá 20 mg/ngày ở người khỏe mạnh,[195] mặc dù Hội đồng Nghiên cứu quốc gia Hoa Kỳ đưa ra mức trần là 40 mg/ngày.[196]
Tuy nhiên, trong việc tăng cường kẽm, một đánh giá năm 2003 cho rằng kẽm oxide trong ngũ cốc rẽ, ổn định và dễ hấp thu hơn các loại đắt tiền hơn.[197] Một nghiên cứu năm 2005 phát hiện rằng nhiều hợp chất kẽm bao gồm cả dạng oxide và sulfat, không cho thấy sự khác biệt đáng kể về thống kê trong việc hấp thụ khi thêm vào bánh ngô.[198] Một nghiên cứu năm 1987 cho thấy rằng kẽm picolinat được hấp thụ tốt hơn so với kẽm gluconat hay kẽm citrat.[199] Tuy nhiên, một nghiên cứu công bố năm 2008 khẳng định rằng kẽm glycinat được hấp thụ tốt nhất trong bốn loại bổ sung kẽm trên thị trường.[200]
Thiếu kẽm
Thiếu kẽm thường là do dinh dưỡng thiếu kẽm, nhưng cũng có thể liên quan đến sự hấp thu kẽm kém, acrodermatitis enteropathica, bệnh gan mãn tính, bệnh thận mãn tính, bệnh hồng cầu hình liềm, tiểu đường, bệnh ác tính và các bệnh mãn tính khác.[8] Các triệu chứng thiếu kẽm nhẹ rất đa dạng.[190] Biểu hiện lâm sàng bao gồm chậm tăng trưởng, tiêu chảy, bất lực và chậm phát dục, rụng tóc, tổn thương da và mắt, giảm cảm giác ngon miệng, thay đổi nhận thức, làm suy giảm khả năng bảo vệ của cơ thể, khiếm khuyết trong việc sử dụng carbohydrat, và sinh quái thai.[184] Thiếu kẽm nhẹ làm giảm miễn dịch,[201] mặc dù dư thừa kẽm cũng giảm miễn dịch.[171] Động vật có chế độ ăn thiếu kẽm thì cần lượng thức ăn tăng gấp đôi để bù lại lượng kẽm so với các động vật được cung cấp đủ kẽm.[126]
Các nhóm có nguy cơ thiếu kẽm bao gồm người già, và những người suy thận. Kẽm chelat phytat được tìm thấy trong hạt và ngũ cốc cám có thể góp phần vào việc kém hấp thu kẽm.[8]
Mặc dù có những lo ngại,[202] nhưng những người ăn chay phương Tây không được phát hiện là thiếu hụt kẽm nhiều so với những người ăn thịt.[203] Các nguồn thực vật cung cấp kẽm như đậu khô, rau biển, ngũ cốc tăng cường, thực phẩm từ đậu nành, đậu phụng, các loại hạt, đậu Hà Lan, mầm hạt.[202] Tuy nhiên, phytat trong nhiều loại hạt và chất xơ trong thực phẩm có thể ảnh hưởng đến việc hấp thụ kẽm và uống kẽm gần giới hạn biên có các hiệu ứng chưa được rõ. Có một vài bằng chứng cho thấy rằng sử dụng lượng kẽm nhiều hơn so với tiêu chuẩn của US RDA (15 mg) hàng ngày có thể là cần thiết cho những người có chế độ ăn uống mà phytat cao, như một số người ăn chay.[202] Việc tính toán này phải được cân đối với thực tế rằng có một lượng ít ỏi các chỉ số sinh học kẽm đầy đủ, và là chỉ số được sử dụng rộng rãi nhất, kẽm plasma, có độ nhạy và độ đặc hiệu kém.[204] Chẩn đoán thiếu kẽm là một thách thức lâu dài.[7]
Thiếu kẽm là trường hợp thiếu vi chất dinh dưỡng phổ biến nhất ở thực vật, đặc biệt là trong đất có độ pH cao. Đất thiếu kẽm được canh tác trong các cánh đồng của phân nửa Thổ Nhĩ Kỳ và Ấn Độ, 1/3 ở Trung Quốc và hầu hết miền Tây Úc, và có những phản hồi đáng kể về việc bổ sung phân kẽm đã được báo cáo ở các khu vực này.[94] Thực vật phát triển trong các loại đất thiếu kẽm dễ bị mắc bệnh hơn. Kẽm về cơ bản được bổ sung vào đất thông qua quá trình phong hóa từ các loại đá, nhưng con người đã đưa kẽm vào trong đất qua quá trình đốt nhiên liệu hóa thạch, chất thải mỏ, phân lân, đá vôi, phân, bùn thải và các hạt từ các bề mặt mạ kẽm. Kẽm dư thừa là chất độc đối với cây, mặc dù độ độc của kẽm ít phổ biến.[94]
Gần 2 tỉ người ở các nước đang phát triển bị thiếu kẽm.[8] Ở trẻ em, thiếu kẽm làm gia tăng nhiễm trùng và tiêu chảy làm khoảng 800.000 trẻm em thiệt mạng mỗi năm trên toàn cầu.[7] WHO có chủ trương bổ sung kẽm cho trẻ suy dinh dưỡng nặng và tiêu chảy.[205] Bổ sung kẽm giúp ngăn ngừa bệnh tật và giảm tử vong, đặc biệt là trẻ em sinh thiếu cân hoặc chậm phát triển.[205] Tuy nhiên, bổ sung kẽm không nên được phân phối một cách riêng lẻ vì một số trường hợp thiếu kẽm ở các quốc gia đang phát triển có thể liên quan đến sự tương tác của kẽm với các vi chất dinh dưỡng khác.[206]
Phục hồi đất
Ericoid Mycorrhizal Fungi Calluna, Erica và Vaccinium có thể phát triển trên đất giàu kẽm.[207]
Nông nghiệp
Thiếu kẽm trong nông nghiệp là sự thiếu hụt vi chất dinh dưỡng phổ biến nhất những loài cây trồng; đặc biệt phổ biến trong đất có pH cao.[208] Thiếu kẽm trong đất trồng chiếm nửa diện tích của Thổ Nhĩ Kỳ và Ấn Độ, 1/3 ở Trung Quốc, và hầu hết ở Tây Úc, và phản ứng chủ yếu đối với phân kẽm đã được báo cáo ở những khu vực này.[94] Thực vật phát triển trên đất thiếu kẽm dễ bị sâu bệnh. Kẽm được bổ sung vào đất chủ yếu từ quá trình phong hóa đá, nhưng con người đã thêm kẽm qua việc đốt các nhiên liệu hóa thạch, chất thải mỏ, phân phosphat, thuốc trừ sâu (kẽm photphit), đá vôi, phân, bùn thải, và các hạt ở dạng xi mạ. Thừa kẽm cũng là chất độc đối với cây trồng, mặc dù ngộ độc kẽm ít phổ biến hơn.[94]
Cảnh báo
Độc tính
Mặc dù kẽm là vi chất cần thiết cho sức khỏe, tuy nhiên nếu hàm lượng kẽm vượt quá mức cần thiết sẽ có hại cho sức khỏe. Hấp thụ quá nhiều kẽm làm ngăn chặn sự hấp thu đồng và sắt.[188] Ion kẽm tự do trong dung dịch là chất có độc tính cao đối với thực vật, động vật không xương sống, và thậm chí là cả động vật có xương sống.[209] Mô hình hoạt động của ion tự do đã được công bố trong một số ấn phẩm, cho thấy rằng chỉ một lượng mỏ mol ion kẽm tự do cũng giết đi một số sinh vật. Một thí nghiệm gần đây cho thấy 6 micromol giết 93% Daphnia trong nước.[210]
Ion kẽm tự do là một acid Lewis mạnh đến mức có thể ăn mòn. Acid dịch vị chứa acid clohydric, mà hàm lượng kẽm kim loại trong đó dễ hòa tan trong đó gây ăn mòn kẽm chloride. Nuốt đồng xu 1 cent của Mỹ năm 1982 (97,5% kẽm) có thể làm hỏng niêm mạc dạ dày do khả năng hòa tan cao của các ion kẽm trong dịch vị.[211]
Có bằng chứng về sự thiếu hụt đồng khi uống ở mức thấp một lượng kẽm 100–300 mg/ngày; một thử nghiệm gần đây cho thấy số người nhập viện cao hơn liên quan đến các biến chứng tiết niệu so với "thuốc trấn an" trong số đàn ông lớn tuổi uống 80 mg/day.[212] USDA RDA khuyến khích uống 11 và 8 mg Zn/ngày theo thứ tự đối với đàn ông và phụ nữ.[189] Thậm chí ở các mức thấp hơn, gần với tiêu chuẩn RDA, có thể can thiệp với việc uống đồng và sắt, chống lại ảnh hưởng của cholesterol.[188] Hàm lượng kẽm vượt quá 500 ppm trong đất gây rối cho khả năng hấp thụ các kim loại cần thiết khác của thực vật, như sắt và mangan.[95] Có những tình huống gọi là sự run kẽm hay ớn lạnh kẽm sinh ra do hít phải các dạng bột oxide kẽm nguyên chất phát sinh trong quá trình mạ vật liệu.[126] Kẽm là thành phần bổ biến của hàm răng giả, nó có thể chứa 17 đến 38 mg kẽm/gram. Đã có những kiện cáo do mất chức năng, và thậm chí tử vong do sử dụng nhiều sản phẩm này.[213]
Cơ quan quản lý thuốc và thực phẩm Hoa Kỳ (FDA) đã khuyến cáo rằng kẽm phá hủy các thụ thể thần kinh trong mũi gây ra chứng mất khứu giác. Các báo cáo về chứng mất khứu giác cũng được quan sát trong thập niên 1930 khi các công tác chuẩn bị kẽm để sử dụng trong một nỗ lực không thành công để ngăn chặn sự lây nhiễm bệnh bại liệt.[214] Ngày 16 tháng 6 năm 2009, FDA thông báo rằng những người sử dụng kẽm nên dừng sử dụng các sản phẩm trị cúm có gốc kẽm và yêu cầu loại bỏ các sản phẩm đó trong các cửa hàng. FDA nói rằng việc không cảm nhận được mùi có thể đe dọa đời sống vì người dân không thể cảm nhận được sự rò rỉ của gas hoặc khói và không thể nhận biết rằng thực phẩm có bị hư trước khi họ ăn.[215] Nghiên cứu gần đây cho rằng kẽm pyrithion kháng khuẩn có thể gây phản ứng sốc nhiệt tiềm ẩn cảm ứng hơn có thể làm giảm tích toàn vẹn bộ gen với sự cảm ứng của PARP.[216]
Ngộ độc
Năm 1982, United States Mint bắt đầu đúc xu bằng đồng mạ kẽm nhưng chủ yếu là làm từ kẽm. Với các đồng kẽm mới, có khả năng gây ngộ độc kẽm, và có thể gây tử vong. Một trường hợp ăn liên tục trong thời gian dài 425 đồng xu kẽm (hơn 1 kg kẽm) gây tử vong do nhiễm vi khuẩn đường ruột và nhiễm trùng máu, trong khi một bệnh nhân khác ăn 12 gram kẽm chỉ cho thấy hôn mê và bất động.[217] Một số ca khác liên quan đến ngộ độc kẽm từ việc nuốt các đồng xu kẽm cũng được ghi nhận.[218][219]
Các con chó đôi khi cũng nuốt các đồng xu và chỉ có cách dùng thuốc để loại chúng ra khỏi cơ thể. Hàm lượng kẽm trong một số đồng xu có thể gây ra ngộ độc kẽm, mà thường gây tử vong ở chó, vì nó gây ra các chứng thiếu máu (hemolytic anemia) nghiêm trọng, và cũng làm cho gan và thận bị tổn thương; các chứng nôn mửa và tiêu chảy.[220] Kẽm có độc tính cao đối với vẹt và sự ngộ độc có thể làm chết chúng.[221] Việc cho các con vẹt uống các loại nước ép trái cây trong các hộp mạ kẽm có thể làm cho chúng bị ngộ độc kẽm hàng loạt.[54]
Ghi chú
- Một tàu của Công ty Đông Ấn chở các hàng hóa là kim loại kẽm gần như nguyên chất từ phương Đông đã chìm ngoài khơi bờ biển Thụy Điển năm 1745.(Emsley 2001, tr. 502)
- Dòng điện chuyển động tự nhiên giữa kẽm và sắt nhưng trong một số trường hợp các anot trơ được dùng với nguồn điện DC ngoài.
- Trong thử nghiệm lâm sàng, cả kẽm gluconat và kẽm gluconat glycin (công thức được dùng trong lozenges) đã cho thấy làm rút ngắn đi thời gian của các triệu chứng cảm thông thường.
- Godfrey, J. C.; Godfrey, N. J.; Novick, S. G. (1996). "Zinc for treating the common cold: Review of all clinical trials since 1984". Alternative Therapies in Health and Medicine. Quyển 2 số 6. tr. 63–72. PMID 8942045.
{{Chú thích tạp chí}}: Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- Hulisz, Darrell T. "Zinc and the Common Cold: What Pharmacists Need to Know". US Pharmacist. uspharmacist.com. Bản gốc lưu trữ ngày 22 tháng 12 năm 2008. Truy cập ngày 9 tháng 4 năm 2012.
{{Chú thích web}}: Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- Godfrey, J. C.; Godfrey, N. J.; Novick, S. G. (1996). "Zinc for treating the common cold: Review of all clinical trials since 1984". Alternative Therapies in Health and Medicine. Quyển 2 số 6. tr. 63–72. PMID 8942045.
- Trong trường hợp này phản ứng 1-pot bromobenzene được chuyển thành phenyllithium bằng phản ứng tương đương với 4 n-butyllithium, sau đó tạo kim loại hữu cơ với kẽm chloride tạo thành kẽm diphenyl, sản phẩm này tiếp tục phản ứng ở dạng bất đối xứng trước với MIB ligand và sau đó với 2-naphthylaldehyde tạo thành alcohol. Trong phản ứng này, sự thành tạo kẽm diphenyl cùng với lithi chloride, mà chưa được kiểm tra, các chất xúc tác mà không liên quan MIB để tạo thành cồn racemic. Muối được loại bỏ một cách có hiệu quả bằng cách thải với tetraethylethylene diamine (TEEDA) tạo ra enantiomeric excess chiếm 92%.
Tham khảo
Tham chiếu
Liên kết ngoài
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



