Bảng tuần hoàn
bảng các nguyên tố hóa học From Wikipedia, the free encyclopedia
Bảng tuần hoàn (tên đầy đủ là Bảng tuần hoàn các nguyên tố hóa học, còn được biết với tên Bảng tuần hoàn Mendeleev, là một phương pháp liệt kê các nguyên tố hóa học thành dạng bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng. Các nguyên tố được biểu diễn theo trật tự số hiệu nguyên tử tăng dần, thường liệt kê cùng với ký hiệu hóa học trong mỗi ô. Dạng tiêu chuẩn của bảng gồm các nguyên tố được sắp xếp thành 18 cột và 7 dòng, với hai dòng kép nằm riêng nằm bên dưới cùng.

Các hàng trong bảng gọi là các chu kỳ, trong khi các cột gọi là các nhóm, một số có tên riêng như halogen hoặc khí hiếm. Bởi vì theo định nghĩa một bảng tuần hoàn thể hiện những xu hướng tuần hoàn, bất kỳ bảng dưới dạng nào cũng có thể dùng để suy ra mối quan hệ giữa các tính chất của nguyên tố và tiên đoán tính chất của những nguyên tố mới, chưa được khám phá hoặc chưa tổng hợp được. Do đó, một bảng tuần hoàn-dù ở dạng tiêu chuẩn hay các biến thể-cung cấp khuôn khổ hữu ích cho việc phân tích thuộc tính hóa học, và các bảng như vậy được sử dụng rộng rãi trong hóa học và các ngành khoa học khác.
Mặc dù có những người tiên phong trước đó, Dmitri Ivanovich Mendeleev thường được xem là người công bố bảng tuần hoàn phổ biến đầu tiên vào năm 1869. Ông đã phát triển bảng tuần hoàn của mình để minh họa các xu hướng tuần hoàn trong thuộc tính các nguyên tố đã biết khi đó. Mendeleev cũng tiên đoán một số thuộc tính của các nguyên tố chưa biết mà ông hi vọng sẽ lấp vào những chỗ trống trong bảng này. Hầu hết những tiên đoán của ông tỏ ra chính xác khi các nguyên tố đó lần lượt được phát hiện. Bảng tuần hoàn của Mendeleev từ đó đã được mở rộng và hiệu chỉnh với sự khám phá hoặc tổng hợp thêm những nguyên tố mới và sự phát triển của các mô hình lý thuyết để giải thích thuộc tính hóa học.
Tất cả các nguyên tố có số nguyên tử từ 1 (Hydro) đến 118 (oganesson) đã được phát hiện hoặc ghi nhận tổng hợp được, trong khi các nguyên tố 113, 115, 117 và 118 vẫn chưa được thừa nhận rộng rãi. 98 nguyên tố đầu tồn tại trong tự nhiên mặc dù một số chỉ tìm thấy sau khi đã tổng hợp được trong phòng thí nghiệm và tồn tại với lượng cực nhỏ.[chú thích 1] Các nguyên tố có số hiệu nguyên tử từ 99 đến 118 chỉ được tổng hợp ra, hoặc được tuyên bố là đã tổng hợp được trong phòng thí nghiệm. Người ta hiện vẫn đang theo đuổi việc tạo ra các nguyên tố có các số hiệu nguyên tử lớn hơn, cũng như tranh cãi về câu hỏi rằng bảng tuần hoàn có thể cần phải hiệu chỉnh ra sao để tương thích với những nguyên tố mới sẽ thêm vào.
Bố cục
| Nhóm → | 1A | 2A | 3B | 4B | 5B | 6B | 7B | 8B | 8B | 8B | 1B | 2B | 3A | 4A | 5A | 6A | 7A | 8A | |
| ↓ Chu kỳ | |||||||||||||||||||
| 1 | 1 H |
2 He | |||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |
| 6 | 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 Fr |
88 Ra |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * Họ Lanthan | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||
| ** Họ Actini | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||
| |||||
|
| Kim loại kiềm | Kim loại kiềm thổ | Họ Lanthan | Họ Actini | Kim loại chuyển tiếp |
| Kim loại yếu | Á kim | Phi kim | Halogen | Khí hiếm |
- Chú thích: Đây là bố cục bảng tuần hoàn 8 cột phổ biến nhất, được gọi là dạng thông thường hoặc dạng tiêu chuẩn, hoặc có khi gọi là dạng bảng dài để so với dạng bảng ngắn hay bảng kiểu Mendeleev Lưu trữ ngày 17 tháng 12 năm 2013 tại Wayback Machine, thường các nhóm từ 3 tới 12 bằng cách gộp vào nhóm chính. Bảng tuần hoàn rộng khác ở chỗ chứa luôn cả họ lanthan và họ actini, thay vì tách chúng khỏi phần thân chính của bảng. Bảng tuần hoàn mở rộng thì thêm các chu kì 8 và 9 chứa các nguyên tố xa hơn nhóm actini.
Tất cả các phiên bản của bảng tuần hoàn chỉ bao gồm các nguyên tố hóa học, không bao gồm hỗn hợp, hợp chất hay các hạt hạ nguyên tử.[chú thích 2] Mỗi nguyên tố hóa học có một số hiệu nguyên tử đặc trưng đại diện cho số proton có trong hạt nhân của nó. Hầu hết các nguyên tố có thể có số neutron khác nhau giữa các nguyên tử, các biến thể này gọi là các đồng vị của nguyên tố đó. Chẳng hạn, cacbon có 3 đồng vị tồn tại trong tự nhiên: hầu hết cacbon tự nhiên có 6 proton và 6 neutron, nhưng cỡ khoảng 1% có 8 neutron và một lượng rất nhỏ có 7 neutron. Đồng vị không tách rời mà gộp lại trong một ô của bảng tuần hoàn như một nguyên tố duy nhất với khối lượng trung bình theo hàm lượng. Những nguyên tố không có đồng vị bền nào có khối lượng nguyên tử bằng của đồng vị bền nhất và được đặt trong dấu ngoặc đơn.[1]

Trong bảng tuần hoàn tiêu chuẩn, các nguyên tố được liệt kê theo thứ tự số hiệu nguyên tử tăng dần. Một hàng mới (tức một chu kỳ) bắt đầu khi một lớp electron mới thêm vào. Các cột (tức nhóm) được xác định bởi cấu hình electron của nguyên tử; những nguyên tố có cùng số electron trong một phân lớp cụ thể rơi vào cùng cột (chẳng hạn oxi và seleni nằm cùng cột bởi vì chúng đều có 4 electron ở phân lớp p ngoài cùng). Các nguyên tố với tính chất hóa học tương tự nhau thường nằm trong cùng nhóm, mặc dù ở khối f và ít nhiều ở khối d, các nguyên tố cùng chu kì cũng thường có tính chất tương tự nhau. Do đó, người ta có thể tiên đoán tương đối dễ dàng tính chất hóa học của một nguyên tố nếu biết tính chất của các nguyên tố xung quanh nó.[2]
Tính tới tháng 12 năm 2016, bảng tuần hoàn có 118 nguyên tố đã được xác nhận, bao gồm các nguyên tố từ 1 (hiđrô) tới 118 (oganesson) trong đó các nguyên tố 113, 115, 117 và 118 đã được tổng hợp trong phòng thí nghiệm và những tuyên bố tổng hợp thành công chúng đã được IUPAC chính thức công nhận lần lượt là nihoni (Nh), moscovi (Mc), tennessine (Ts), và oganesson (Og).[3][4][5][6]
Tổng cộng 98 nguyên tố xuất hiện trong tự nhiên; 20 nguyên tố còn lại, từ ensteini tới oganesson, chỉ xuất hiện trong phép tổng hợp nhân tạo. Trong số 98 nguyên tố đó, 84 là nguyên tố nguyên thủy, nghĩa là xuất hiện trước khi Trái Đất hình thành. 14 nguyên tố còn lại chỉ xuất hiện trong các chuỗi phân rã của các nguyên tố nguyên thủy.[7] Không có nguyên tố nào nặng hơn einsteini (số hiệu 99) từng quan sát thấy với lượng vĩ mô ở dạng tinh khiết.[8]
Phương pháp sắp xếp
Nhóm
Một nhóm, còn gọi là một họ, là một cột đứng trong bảng tuần hoàn. Các nhóm thường thể nhiều xu hướng tuần hoàn quan trọng hơn là các chu kỳ và các khối. Các thuyết về cấu trúc nguyên tử trong cơ học lượng tử hiện đại giải thích rằng các nguyên tố trong cùng một nhóm có cấu hình electron như nhau trong lớp hóa trị của chúng,[9] và do đó các nguyên tố trong cùng một nhóm có tính chất hóa học giống nhau và thể hiện một xu hướng rõ ràng trong các tính chất với số hiệu nguyên tử tăng dần.[10] Tuy nhiên, trong một vài phần của bảng tuần hoàn, như các khối d và f, tính tương đồng theo chiều ngang có thể quan trọng không kém, hoặc thậm chí quan trọng hơn, tính tương đồng theo chiều dọc.[11][12][13]
Theo quy ước đặt tên quốc tế, các nhóm đánh số từ 1 đến 18 từ cột đầu tiên bên trái (kim loại kiềm) đến cột cuối cùng bên phải (khí hiếm).[14] Trước đây, chúng được đánh thứ tự theo số La Mã. Ở Hoa Kỳ (và một số nước khác) trước kia, người ta phân các nhóm vào loại "A" nếu nhóm đó chỉ chứa lớp s hoặc p, hoặc "B" nếu nhóm đó chứa lớp d. Số La Mã bằng hàng đơn vị của thứ tự cột từ trái sang phải (chẳng hạn, cột thứ 4 là nhóm IVB, và cột thứ 14 là IVA). Các nhóm thứ 8, 9, 10 được xếp chung thành một nhóm lớn là VIIIB. Tiêu chuẩn cũ của IUPAC từng lưu hành ở châu Âu cũng tương tự, trừ chữ "A" được dùng nếu nhóm nằm trước 10 và "B" được dùng cho nhóm 10 trở về sau; ngoài ra nhóm VIIIB ở đây gọi là nhóm VIII còn nhóm VIIIA là nhóm 0. Năm 1988, hệ thống đặt tên IUPAC mới có hiệu lực, và các tên gọi nhóm cũ theo chữ số La Mã đã bị loại bỏ,[15] nhưng vẫn tồn tại ở một số nước như Việt Nam. Tham khảo các cách gọi tên nhóm cũ và mới ở bảng phía dưới.
Một số nhóm này có tên thông thường, chẳng hạn nhóm 2 được gọi là nhóm kim loại kiềm thổ. Nhóm 3–10 không có tên chung của 3 nhóm và được xem là đơn giản bởi các nhóm của chúng hoặc bởi tên gọi của nhóm đầu tiên trong nhóm của chúng (như 'nhóm scandi' cho nhóm 3), vì chúng thể hiện các xu hướng ít tương đồng hơn theo phương đứng.[14]
Các nguyên tố cùng nhóm có khuynh hướng thể hiện các dáng điệu tương tự về bán kính nguyên tử, năng lượng ion hóa, và độ âm điện. Từ trên xuống trong cùng một nhóm, bán kính nguyên tử tăng dần. Do có nhiều mức năng lượng được lấp đầy hơn, các electron hóa trị xuất hiện ở xa hạt nhân hơn. Từ trên xuống, các nguyên tố sau có mức năng lượng ion hóa thấp hơn, tức là dễ tách electron ra khỏi nguyên tử bởi liên kết lỏng lẻo đi. Tương tự, trong một nhóm từ trên cuống sẽ giảm độ âm điện do khoảng cách giữa các electron hóa trị và hạt nhân tăng dần.[16] Tuy nhiên các xu hướng này cũng có ngoại lệ, ví dụ trong nhóm 11 thì độ âm điện tăng từ trên xuống.[17]
| Số nhóm | 1 | 2 | 3b | 4 | 5 | 6 | 7 | 8 | [[Nhóm nguyên văn y học, THCS Nguyễn Thị Minh 16:53, ngày 1 tháng 12 năm 2024 (UTC)2001:EE0:51FE:3950:902B:164A:32A5:8DB1 (thảo luận)[19]|9]] | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ACS (Hoa Kỳ) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||
| IUPAC (châu Âu) | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | Nhóm 0 | |||
| Tên thông thường | Kim loại kiềm | Kim loại kiềm thổ | Kim loại bay hơi | Crystallogen | Pnictogen | Chacogen | Halogen | Khí hiếm | |||||||||||
| Theo nguyên tố đại diện | Nhóm Liti | Nhóm Beri | Nhóm Scanđi | Nhóm Titan | Nhóm Vanađi | Nhóm Crom | Nhóm Mangan | Nhóm Sắt | Nhóm Coban | Nhóm Nickel | Nhóm Đồng | Nhóm kẽm | Nhóm Bo | Nhóm Cacbon | Nhóm Nitơ | Nhóm Oxi | Nhóm Flo | Nhóm Heli (hoặc Neon) | |
| Chu kỳ 1 | H | He | |||||||||||||||||
| Chu kỳ | Li | Be | B | C | N | O | F | Ne | |||||||||||
| Chu kỳ 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| Chu kỳ 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zinc | Ga | Ge | As | Se | Br | Kr | |
| Chu kỳ 5 | Rb | Sr | khối fb | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Chu kỳ 6 | Cs | Ba | La–Yb | Lub | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Chu kỳ7 | Fr | Ra | Ac–No | Lrb | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| a Hiđro (H), mặc dù ở cột 1, không được xem là kim loại kiềm. | |||||||||||||||||||
| b Nhóm 3: có nguồn cho Luteti (Lu) và Lawrenci(Lr) thêm vào; khối f (với các họ lantan và actini cũng có thể có mặt. | |||||||||||||||||||
| c Cách đặt tên này đã bị IUPAC đề xuất bãi bỏ. | |||||||||||||||||||
Chu kỳ
Một chu kỳ là một hàng ngang trong bảng tuần hoàn. Mặc dù nhóm thông thường có các xu hướng quan trọng hơn, có những vùng trong bảng mà xu hướng theo chiều ngang quan trọng hơn chiều dọc, như ở khối f, với các họ Lanthan và họ Actini tạo nên hai chuỗi hàng ngang quan trọng.[20]
Trong một chu kì từ trái sang phải, bán kính nguyên tử giảm dần do mỗi nguyên tố thêm vào proton khiến cho electron lớp ngoài bị kéo lại gần hạt nhân hơn.[21] Bán kính nguyên tử giảm làm năng lượng ion hóa và độ âm điện tăng dần[16] Ái lực electron cũng ít nhiều có một xu hướng, với kim loại (phía trái) thường có ái lực electron thấp hơn phi kim (phía bên phải) với ngoại lệ là các khí hiếm.[22]
Khối

Các vùng khác nhau trên bảng tuần hoàn đôi khi được xem là "khối" (tiếng Anh: "block") theo cách mà các vỏ electron của các nguyên tố được lấp đầy. Mỗi lớp được đặt tên theo sự sắp xếp các electron cuối cùng trong vỏ.[23][chú thích 3] Khối s gồm hai nhóm đầu tiên (kim loại kiềm và kiềm thổ) cũng như hydro và heli. Khối p gồm 6 nhóm cuối từ số 13 đến 18 theo IUPAC (3A đến 8A theo bảng hiện hành ở Việt Nam), trong đó có tất cả các á kim và một số kim loại cùng phi kim. Khối d gồm các nhóm thứ 3 đến 12 theo IUPAC (tức 3B đến 2B) và chứa tất cả kim loại chuyển tiếp. Khối f, thường xếp riêng bên dưới bản tuần hoàn, gồm những nguyên tố kim loại thuộc các họ lanthan và actini.[24]
Phân loại và các quy ước khác
Tùy theo tính chất, các nguyên tố trong bảng tuần hoàn có thể chia làm các loại chính là kim loại, phi kim và á kim. Kim loại thường nằm bên trái và phía dưới bảng tuần hoàn. Đặc trưng của chúng là chất rắn, có ánh kim, dẫn điện và nhiệt tốt, có thể tạo thành hợp kim với nhau và hợp chất với phi kim. Phi kim nằm ở bên phải và phía trên. Chúng thường là các khí có màu hoặc không màu, cách điện và nhiệt, hình thành hợp chất hóa trị với nhau. Ở giữa kim loại và phi kim là á kim, có tính chất trung gian hoặc kết hợp giữa hai loại trên.[25]
Kim loại và phi kim có thể chia làm các tiểu loại thể hiện nguyên tố giảm tính kim loại và tăng tính phi kim từ trái sang phải. Kim loại chia làm kim loại kiềm hoạt động mạnh, kim loại kiềm thổ ít hoạt động hơn, rồi đến các họ lanthan và actini, rồi tới các kim loại chuyển tiếp nguyên hình, và kết thúc ở các kim loại yếu hơn về hóa học lẫn vật lý. Các phi kim đơn giản chia làm phi kim đa nguyên tử, nằm gần á kim nhất, thể hiện chút ít đặc tính kim loại, các phi kim hai nguyên tử, thể hiện tính phi kim rõ ràng, và cuối cùng là các phi kim đơn nguyên tử tức khí hiếm, gần như hoàn toàn trơ và phi kim. Các loại đặc biệt như kim loại chịu nhiệt và các kim loại hiếm đều thuộc vào kim loại chuyển tiếp[26] và đôi khi cũng được thể hiện trong bảng tuần hoàn.[27] Việc phân loại như thế này tồn tại từ rất lâu, ít nhất là từ năm 1869 khi Hinrichs khẳng định rằng có thể vạch những đường đơn giản trên bảng tuần hoàn để chia ra thành kim loại, phi kim hay nguyên tố khí.[28] Thực tế cách phân loại này không hoàn hảo vì có rất nhiều chồng lấn về tính chất ở gần biên của các loại trên bảng tuần hoàn, và có những nguyên tố, như beryli, khó mà phân vào một loại nào.[29]
| Bố cục bảng tuần hoàn | |
|---|---|
 |
 |
| Họ lanthan và actini tách biệt (trái) hoặc trong hàng (phải) | |
Trong cách biểu diễn bảng tuần hoàn, họ lanthan và họ actini thường thể hiện thành hai hàng dưới thân chính của bảng tuần hoàn, với các vị trí giữa bari và hafni, giữa radi và rutherfordi được đánh dấu bằng ký hiệu hoặc bằng một nguyên tố đại diện (lanthan và actini hoặc luteti và lawrenci)[30] Quy ước này thuần túy là một vấn đề thẩm mỹ và tính tiện lợi; một dạng bảng rộng hiếm gặp chèn các họ nguyên tố này vào vị trí chính xác của chúng, tức là một phần của các hàng (chu kỳ) 6 và 7. Một quy ước khác cũng hay gặp là một đường chia giữa kim loại và phi kim, tuy đường này cũng có những biến thể khác nhau và không nằm trong bảng tuần hoàn chính thức của IUPAC.[31]
Xu hướng tuần hoàn

Cấu hình electron

Cấu hình electron, tức cách phân bố electron quay quay xung quanh các nguyên tử trung hòa, thể hiện một dáng điệu tuần hoàn. Electron chiếm một chuỗi các lớp vỏ electron (đánh dấu bằng các chữ cái in hoa từ K,L,M,N,... ứng với số lượng tử chính n=1,2,3,4,...). Mỗi lớp lại chứa một hoặc nhiều phân lớp (gọi là s,p,d,f và g, ứng với số lượng tử phụ m=0,1,2,3,4). Khi số hiệu nguyên tử tăng, số electron sẽ lần lượt lấp đầy các lớp và phân lớp này theo quy tắc Klechkowski hay quy tắc thứ tự năng lượng thể hiện ở giản đồ hình bên. Trong bảng tuần hoàn, mỗi khi electron bắt đầu chiếm một lớp mới tương ứng với một chu kỳ mới bắt đầu bởi một kim loại kiềm.[32][33]
Vì tính chất cả một nguyên tố chủ yếu phụ thuộc vào cấu hình electron của nó, cho nên những tính chất này cũng thể hiện dáng điệu tuần hoàn. Chính tuần hoàn này đã dẫn tới sự hình thành định luật tuần hoàn (tính chất của các nguyên tố lặp lại với những khoảng đều nhau) và những bảng tuần hoàn đầu tiên, mặc dù biểu hiện của nó chỉ nhận được sự chú ý khi mô hình Bohr về cấu trúc nguyên tử ra đời.[32][33]
Bán kính nguyên tử

Bán kính nguyên tử thay đổi theo cách có thể dự đoán và giải thích được trong toàn bảng tuần hoàn. Ví dụ, bán kính nguyên tử thường giảm dọc theo mỗi chu kỳ của bảng tuần hoàn, từ các kim loại kiềm đến các khí hiếm; và tăng theo chiều từ trên xuống trong mỗi nhóm. Bán kính tăng mạnh giữa khí hiếm ở cuối mỗi chu kỳ và kim loại kiềm ở đầu chu kỳ tiếp theo. Các xu hướng này của bán kính nguyên tử (cũng như nhiều tính chất vật lý và hóa học khác của các nguyên tố) có thể giải thích bằng lý thuyết về lớp vỏ electron của nguyên tử; chúng cung cấp bằng chứng quan trọng cho sự phát triển và xác nhận của cơ học lượng tử.[34]
Các electron trong phân lớp 4f, được lấp đầy dần dần từ xeri (Z = 58) đến ytterbi (Z = 70) tỏ ra không hiệu quả trong việc che chắn điện tích hạt nhân tăng lên từ các phân lớp ra ngoài. Kết quả là các nguyên tố ngay sau nhóm lanthan có bán kính nguyên tử nhỏ hơn như dự đoán và hầu như bằng đúng bán kính nguyên tử các nguyên tố nằm ngay phía trên chúng.[35] Hiện tượng này được gọi là sự co ở họ lanthan, mổi bật từ đầu họ này tới platin (Z = 78), từ sau đó bị che khuất bởi một hiệu ứng tương đối tính gọi là "hiệu ứng cặp trơ" [chú thích 5][36] Một hiệu ứng có nguồn gốc và biểu hiện tương tự, sự co khối d, xảy ra giữa khối d và khối p và khó nhận thấy hơn so với sự co ở họ lanthan.[35]
Năng lượng ion hóa

Mức năng lượng ion hóa thứ nhất (IE1 hay I1) là năng lượng cần thiết để tách một electron ra khỏi nguyên tử, và các mức năng lượng thứ 2, thứ 3,.. định nghĩa tương tự. Đối với một nguyên tử cho trước, các mức năng lượng ion hóa tiếp theo tăng theo mức độ ion hóa. Các electron ở các orbital càng gần thì chịu lực hút tĩnh điện càng lớn; do đó lượng năng lượng cần thiết để tách electron tăng càng nhiều. Năng lượng ion hóa tăng về phía trên bên phải của bảng tuần hoàn.[36]
Các bước nhảy lớn trong năng lượng ion hóa phân tử liên tiếp xuất hiện khi tách một electron khỏi cấu hình khí hiếm (lớp vỏ bão hòa). Chẳng hạn, năng lượng ion hóa thứ nhất và thứ hai của magnesi lần lượt là 738 kJ/mol và 1450 kJ/mol, nhưng năng lượng ion hóa thứ ba, từ Mg2+ (có cấu hình khí hiếm 1s22s22p2) xuống Mg3+(1s22s22p1) đạt tới 7730 kJ/mol.[36]
Độ âm điện

Độ âm điện là khuynh hướng một nguyên tử hút các electron.[37] Độ âm điện của nguyên tử chịu ảnh hưởng của cả số hiệu nguyên tử và khoảng cách giữa các electron hóa trị và các hạt nhân. Độ âm điện càng cao thì khả năng hút electron càng mạnh. Khái niệm này được Linus Pauling đề xuất đầu tiên năm 1932 và thang Pauling vẫn là cơ sở tham chiếu rộng rãi cho độ âm điện tới ngày nay, tuy cũng tồn tại các phương pháp khác.[38] Nhìn chung, độ âm điện tăng từ trái qua phải trong một chu kỳ, và giảm từ trên xuống trong một nhóm. Do đó fluor có độ âm điện lớn nhất trong các nguyên tố,[chú thích 6]trong khi Caesi có độ âm điện thấp nhất, chí ít là theo các nguồn dữ liệu chủ chốt đã có.[17]
Có những ngoại lệ về nguyên tắc chung này. Galli và germani có độ âm điện cao hơn nhôm và silic theo thứ tự do sự co khối d. Những nguyên tố của chu kỳ 4 nằm ngay sau dòng đầu tiên của các kim loại chuyển tiếp có bán kính nguyên tử nhỏ bất thường do các electron 3d không che chắn hiệu quả điện tích hạt nhân gia tăng, và kích thước nguyên tử nhỏ hơn tương ứng độ âm điện lớn hơn.[17] Độ âm điện cao bất thường của chì, nhất là khi so sánh với thalli và bismuth, dường như là một hệ quả của sự chọn lọc dữ liệu công bố (cũng như sự thiếu thốn dữ liệu)-các phương pháp tính toán khác phương pháp Pauling đều thể hiện xu hướng tuần hoàn bình thường của các nguyên tố này.[39]
Ái lực electron

Ái lực electron của một nguyên tử là lượng năng lượng giải phóng ra khi electron thêm vào nguyên tử trung hòa để tạo thành ion âm. Mặc dù ái lực electron thay đổi với những khoảng rất lớn, người ta vẫn quan sát thấy có những dáng điệu nhất định. Nhìn chung, phi kim có giá trị ái lực electron dương nhiều hơn kim loại, với clo có giá trị ái lực electron cao hơn cả. Ái lực electron của khí hiếm chưa đo đạc được một cách thuyết phục, cho nên chúng có hoặc không có các giá trị âm nhỏ.[42]
Ái lực electron tăng theo chu kỳ. Điều này là do sự lấp đầy lớp vỏ hóa trị của nguyên tử; một nguyên tử nhóm 17 giải phóng nhiều năng lượng hơn nguyên tử nhóm 1 nhận một electron vì nó đạt đến lớp vỏ hóa trị bão hóa và do đó bền hơn.[42] Với cách giải thích tương tự, ta có thể trông đợi quan sát thấy xu hướng giảm ái lực electron từ trên xuống trong một nhóm. Electron thêm vào sẽ rơi vào orbital nằm xa hạt nhân hơn. Do vậy electron này sẽ ít bị hút vào hạt nhân hơn và có thể giải phóng ít năng lượng hơn khi được thêm vào. Tuy nhiên, theo chiều từ trên xuống, khoảng 1/3 các nguyên tố là bất thường, với các nguyên tố nặng hơn có ái lực electron cao hơn so với nguyên tố cùng nhóm mà nhẹ hơn. Phần lớn điều này là do sự che chắn kém bởi các electron lớp d và f. Việc giảm đều đặn ái lực electron chỉ đúng với các nguyên tử nhóm 1.[43]
Tính kim loại
Năng lượng ion hóa, độ âm điện và ái lực electron càng thấp thì tính kim loại càng mạnh và ngược lại, tính phi kim tăng thì các giá trị trên càng lớn.[44] Theo đó, tính kim loại có khuynh hướng giảm trong chu kỳ và, với một số vị trí không đều đặn chủ yếu do khả năng chắn hạt nhân kém bởi electron các phân lớp d và f cùng hiệu ứng tương đối tính,[45] có khuynh hướng tăng dần trong một nhóm. Vì vậy, hầu hết các nguyên tố có tính kim loại mạnh nhất (như xezi và franci) nằm ở góc dưới bên trái của bảng tuần hoàn truyền thống và hầu hết các nguyên tố có tính phi kim mạnh nhất (ôxi, fluor, clo) ở góc trên bên phải. Sự kết hợp các xu hướng theo chiều đứng và chiều ngang của tính kim loại giải thích ranh giới gấp khúc chia tách giữa kim loại và phi kim trên một số phiên bản bảng tuần hoàn, và việc xếp nhóm một số nguyên tố nằm cạnh đường ranh này thành á kim.[46][47]
Lịch sử
Những nỗ lực hệ thống hóa đầu tiên

Năm 1789, Antoine Lavoisier công bố danh sách 33 nguyên tố hóa học, xếp nhóm thành các chất khí, kim loại, phi kim và "đất".[48] Các nhà hóa học đã dành cả một thế kỉ sau đó để tìm kiếm một sơ đồ phân loại chính xác hơn. Năm 1829, Johann Wolfgang Döbereiner nhận thấy nhiều nguyên tố có thể nhóm thành các bộ ba dựa trên tính chất hóa học. Lithi, natri và kali chẳng hạn, có thể xếp vào nhóm các kim loại mềm, dễ phản ứng. Döbereiner cũng nhận thấy rằng khi sắp xếp theo khối lượng, nguyên tố thứ hai trong mỗi bộ ba thường gần bằng trung bình cộng của hai nguyên tố kia;[49] sau này được gọi là "định luật bộ ba nguyên tố".[50] Nhà hóa học Đức Leopold Gmelin làm nghiên cứu hệ thống này, và tới năm 1843 ông đã nhận diện được 10 bộ ba, ba nhóm bộ 4 và 1 nhóm bộ 5. Năm 1857 Jean-Baptiste Dumas công bố công trình mô tả mối quan hệ giữa các nhóm kim loại khác nhau. Mặc dù nhiều nhà khoa học có thể nhận diện mối quan hệ giữa các nhóm nguyên tố nhỏ, họ chưa thể dựng lên một sơ đồ định hướng toàn bộ chúng.[49]
Năm 1858, August Kekulé quan sát thấy rằng cacbon thường có 4 nguyên tử khác liên kết với nó. Ví dụ như Metan có một nguyên tử cacbon và 4 nguyên tử hiđrô. Quan niệm hóa trị hình thành từ đây; các nguyên tố khác nhau liên kết với những số nguyên tử khác nhau.[51]
Năm 1862, Alexandre-Emile Béguyer de Chancourtois, một nhà địa chất Pháp, công bố một dạng bảng tuần hoàn sơ khai, mà ông gọi là "đường xoắn teluride" hay "đinh vít teluride" (tiếng Pháp: vis tellurique). De Chancourtois là người đầu tiên nhận thấy tính tuần hoàn của các nguyên tố. Khi tố xếp theo một đường xoắn trên một hình ống theo khối lượng nguyên tử tăng dần, ông chỉ ra rằng các ngyên tố với tính chất tương tự nhau dường như xuất hiện theo những khoảng cách đều đặn. Bảng mà de Chancourtois đề xuất bao gồm một số ion và hợp chất bên cạnh các nguyên tố. Bài viết của ông cũng sử dụng các thuật ngữ địa chất hơn là hóa học và không sử dụng một giản đồ nào; kết quả là nó không nhận được chú ý cho đến khi công trình của Dmitri Mendeleev xuất hiện.[52]
Năm 1864, Julius Lothar Meyer, một nhà hóa học Đức, công bố một bảng bao gồm 44 nguyên tố xếp theo hóa trị. Bảng này chỉ ra các nguyên tố với tính chất tương tự thường có chung hóa trị.[53] Đồng thời, nhà hóa học William Odling cũng công bố một bảng sắp xếp 57 nguyên tố dựa trên khối lượng nguyên tử. Với một số chỗ trống và tính không đều đặn, ông nhận thấy rằng cái có vẻ như là tính tuần hoàn về khối lượng nguyên tử trong số các nguyên tố đó và rằng điều này tương ứng với "các cách ghép nhóm được ghi nhận của chúng." [54] Odling ám chỉ tới ý tưởng về một định luật tuần hoàn nhưng không theo đuổi đến cùng.[55] Về sau (năm 1870) ông quay sang đề xuất một sự phân loại nguyên tố dựa trên hóa trị.[56]

Nhà hóa học người Anh John Newlands công bố một loạt bài báo từ năm 1863 tới năm 1866 ghi nhận rằng khi các yếu tố được xếp theo thứ tự khối lượng nguyên tử tăng dần, các tính chất vật lý và hóa học tái tục theo những khoảng 8 đơn vị, ông gọi chúng là "octave" (bộ tám) theo cách gọi các quãng tám trong âm nhạc.[57][58] Điều này cũng được gọi là Định luật về các bộ tám, tuy nhiên bị những người cùng thời chế diễu, và Hội Hóa học Luân Đôn từ chối ấn hành công trình này.[59] Tuy nhiên Newlands đã thảo ra một bảng nguyên tố và dùng nó để tiên đoán sự tồn tại của những nguyên tố còn thiếu, chẳng hạn germani.[60] Hội Hóa học chỉ ghi nhận ý nghĩa những khám phá của ông 5 năm sau khi họ công nhận Mendeleev.[61]
Năm 1867, Gustavus Hinrichs, một nhà hóa học gốc Đan Mạch làm việc ở Hoa Kỳ, công bố một hệ thống tuần hoàn xoắn ốc dựa trên phổ và khối lượng nguyên tử, và những tính tương đồng hóa học. Công trình của ông bị xem là lập dị, khoe mẽ, rắm rối và điều này có thể đã cản trở sự thừa nhận của cộng đồng khoa học.[62][63]
Bảng tuần hoàn của Mendeleev


Hai nhà hóa học, Dmitri Mendeleev người Nga và Julius Lothar Meyer người Đức độc lập với nhau đã công bố bảng tuần hoàn lần lượt vào năm 1869 và 1870.[64] Bảng của Mendeleev là phiên bản đầu tiên của ông công bố, bản của Meyer là phiên bản mở rộng của một bảng khác năm 1864.[65] Cả hai đều xây dựng bảng bằng cách liệt kê các nguyên tố theo hàng hoặc cột theo thứ tự khối lượng nguyên tử và bắt đầu mỗi hàng hoặc cột mới khi các thuộc tính của nguyên tố bắt đầu lặp lại.[66]
Sự ghi công dành cho bảng của Mendeleev đến từ hai quyết định quan trọng của ông. Thứ nhất là ông để dành chỗ trống mà dường như tương ứng với những nguyên tố còn chưa được khám phá.[67] Mendeleev không phải là nhà khoa học đầu tiên làm vậy, nhưng ông là người đầu tiên được công nhận là sử dụng các xu hướng trong bảng tuần hoàn để tiên đoán tính chất của những nguyên tố bị thiếu, như galli và germani.[68] Quyết định thứ hai là đôi khi bỏ qua trật tự cứng nhắc theo khối lượng nguyên tử và hoán chuyển các nguyên tố lân cận, chẳng hạn như teluride và iod, để phân loại chúng thành các họ hóa học tốt hơn. Với sư phát triển của các lý thuyết về cấu trúc nguyên tử, người ta nhận thấy rõ ràng là Mendeleev đã vô tình liệt kê các nguyên tố theo trật tự số hiệu nguyên tử (hay điện tích hạt nhân) tăng dần.[69]
Tầm quan trọng của số hiệu nguyên tử đối với việc tổ chức bảng tuần hoàn không được thừa nhận cho tới khi sự tồn tại và tính chất của proton và neutron được nghiên cứu chi tiết hơn. Các bảng tuần hoàn của Mendeleev sử dụng khối lượng nguyên tử thay vì số hiệu nguyên tử để tổ chức các nguyên tố, thông tin có thể xác định với độ chính xác tương đối cao ở thời bấy giờ. Khối lượng nguyên tử thỏa mãn hầu hết các trường hợp, đem lại một sự mô tả có khả năng tiên đoán tính chất của các nguyên tố chưa biết chính xác hơn bất kỳ phương pháp cùng thời nào khác. Việc thay thế bằng số hiệu nguyên tử sau này đem lại mỗi chuỗi xác định, dựa trên số nguyên cho nguyên tố vẫn được sử dụng tới ngày nay ngay cả khi các nguyên tố tổng hợp đang được chế tạo và nghiên cứu.[70]
Những phát triển về sau
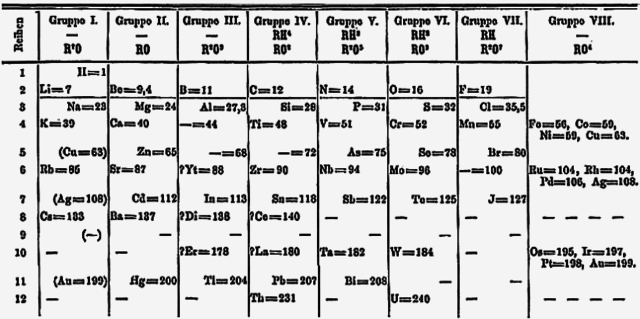

Năm 1871, Mendeleev công bố một dạng bảng tuần hoàn, có các nhóm nguyên tố tương tự nhau xếp thành các cột từ I tới VIII (như hình trên). Ông cũng đưa ra các tiên đoán chi tiết về tính chất của các nguyên tố mà trước đó ông từng ghi nhận là bị khuyết nhưng hẳn phải tồn tại.[71] Những khoảng trống này lần lượt lấp đầy khi các nhà khoa học khám phá thêm những nguyên tố tồn tại trong tự nhiên.[72] Người ta từng nghĩ rằng nguyên tố tự nhiên cuối cùng được khám phá là franci (mà Mendeleev gọi eka-caesium) vào năm 1939.[73] Nhưng một nguyên tố được tổng hợp lần đầu tiên vào năm 1940 là plutoni về sau (1971) lại tìm thấy với một lượng rất nhỏ xuất hiện trong tự nhiên,[74] và tới năm 2011 người ta biết rằng tất cả các nguyên tố cho tới californi có thể xuất hiện trong tự nhiên ít nhất là dưới dạng vết (hàm lượng cực nhỏ) trong các mỏ quặng urani do bắt giữ neutron và phân rã beta.[7]
Dạng bảng tuần hoàn phổ biến hiện nay[23], thường gọi là dạng tiêu chuẩn hay dạng thông thường, là bản do Horace Groves Deming hiệu chỉnh. Năm 1923, nhà hóa học Hoa Kỳ này công bố các bảng tuần hoàn dạng ngắn (gọi là kiểu Mendeleev) và vừa (dạng 18 cột)[75][chú thích 7] Merck and Company chuẩn bị dạng bảng vừa 18 cột của Deming năm 1928 và phát hành rộng rãi trong các trường học ở Hoa Kỳ. Tới những năm 1930 bảng của Deming đã xuất hiện trong các cuốn sổ tay và từ điển bách khoa hóa học. Sự phổ biến của nó cũng một phần nhờ được Sargent-Welch Scientific Company phát hành trong nhiều năm.[77][78][79]
Với sự phát triển của các lý thuyết cơ học lượng tử về cấu hình electron trong nguyên tử, người ta nhận thấy rằng mỗi chu kỳ (hàng) trong bảng ứng với sự lấp đầy một lớp vỏ lượng tử electron. Những nguyên tử lớn hơn có nhiều phân lớp electron hơn, cho nên các bảng về sau có những chu kỳ ngày càng dài hơn.[80]

Năm 1945, Glenn Seaborg, một nhà khoa học Hoa Kỳ, đề xuất rằng các nguyên tố họ actini, cũng giống họ lanthan lấp đầy một phân lớp f. Trước đó họ actini được cho là tạo thành một hàng khối d thứ tư. Đồng nghiệp của Seaborg khuyên ông không nên công bố một đề xuất táo bạo như vậy vì nó có thể làm hỏng toàn bộ sự nghiệp của ông. Seaborg vẫn bất chấp công bố và giả thuyết này về sau được chứng minh là đúng, góp phần giúp ông nhận giải Nobel Hóa học năm 1951.[81][82][chú thích 8]
Mặc dù những lượng rất nhỏ một vài nguyên tố siêu urani tồn tại trong tự nhiên,[7] con người biết tới chúng đầu tiên qua tổng hợp nhân tạo. Việc chế tạo ra chúng đã mở rộng bảng tuần hoàn đáng kể, với thành viên đầu tiên là neptuni (1939).[84] Vì nhiều nguyên tố siêu urani hết sức không bền và phân rã nhanh chóng, chúng thách thức việc phát hiện và tìm hiểu tính chất. Đã có nhiều tranh cãi liên quan tới việc các phòng thí nghiệm khác nhau đòi ghi công phát minh và kéo theo đó là quyền đặt tên cho các nguyên tố mới. Các nguyên tố có tên riêng chính thức được công nhận gần đây nhất là flerovi (nguyên tố 114) và livermori (nguyên tố 116), cả hai được đặt tên ngày 31 tháng 5 năm 2012.[85] Năm 2010, một nhóm cộng tác nghiên cứu giữa Nga và Hoa Kỳ ở Dubna, Moskva, Nga, tuyên bố tổng hợp thành công 6 nguyên tử của nguyên tố thứ 117 ununsepti, khiến nó trở thành nguyên tố được tuyên bố phát hiện gần đây nhất.[86]
Các kiểu bố trí khác

Có nhiều bảng tuần hoàn với dạng khác dạng tiêu chuẩn. Trong khoảng 100 năm từ khi bảng của Mendeleev xuất hiện năm 1869 người ta ước tính có khoảng 700 phiên bản bảng tuần hoàn khác nhau ấn hành.[87] Cùng với rất nhiều biến thể hình chữ nhật, cũng có những hình dạng khác, như các dạng tròn, lập phương, ống trụ, mặt tiền (kiều ngôi nhà), chuỗi xoắn, lăng trụ 8 cạnh, kim tự tháp, dạng chia cắt, dạng cầu, tam giác và, lemniscate,....[chú thích 9] Mục đích của những bảng này thường là nhằm tô đậm hoặc nêu bật các thuộc tính hóa học hoặc vật lý của các nguyên tố khó nhận thấy trong bảng tuần hoàn thông thường.[87]
Trong số các biến thể, một phiên bản khá phổ biến là bản của Theodor Benfey (1960)[88], trong đó các nguyên tố được sắp xếp theo một chuỗi xoắn ốc liên tục, với hiđrô ở trung tâm và các nguyên tố kim loại chuyển tiếp, các họ lanthan và actini chiếm các bán đảo.[89]
Hầu hết các bảng tuần hoàn ở dạng phẳng nhưng cũng có những phiên bản ba chiều tồn tại ít nhất là từ năm 1862 (trước cả bảng 2 chiều của Mendeleev). Các ví dụ gần đây hơn bao gồm Phân loại Tuần hoàn của Courtines (1925),[90] Hệ thống Phiến của Wringley (1949),[91] Chuỗi xoắn tuần hoàn của Giguère (1965)[92][chú thích 10] và Cây Tuần hoàn của Dufour (1996).[94] Đi xa hơn nữa, Stowe mô tả Bảng tuần hoàn cho Nhà vật lý (1989) của mình[95] là 4 chiều (ba chiều không gian và một chiều màu sắc).[96]
Các dạng bảng khác nhau được cho là nằm trên một continuum hóa-lý.[97] Về cực điểm phía hóa học trong continuum này có thể thấy bảng Bảng tuần hoàn hóa học của Nhà hóa học vô cơ 'vô nguyên tắc'[98] của Rayner-Canham (2002),[99] nhấn mạnh các xu hướng và hình thái tuần hoàn, và các mối quan hệ cùng thuộc tính hóa học dị thường. Ở gần cực vật lý là Bảng tuần hoàn hóa học bước trái của Janet (1928). Bảng này có một cấu trúc thể hiện mối liên hệ gần gũi hơn với mức độ lấp đầy lớp vỏ electron và do đó gầm hơn với cơ học lượng tử.[100] Ở khoảng giữa là dạng tiêu chuẩn phổ biến, được xem là mô tả các xu hướng tuần hoàn thực nghiệm trong các trạng thái vật lý, tính dẫn điện và dẫn nhiệt, và các số oxy hóa, cùng các nguyên tố khác dễ dàng suy ra từ các kĩ thuật truyền thống trong phòng thí nghiệm hóa học.[101]
| 1s | H | He | ||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra |
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | Uue | Ubn |
| khối f | khối d | khối p | khối s | |||||||||||||||||||||||||||||
| Dạng bảng tuần hoàn này phù hợp với trật tự trong đó các lớp electron lấp đầy, thể hiện theo chuỗi kèm theo ở lề phải phải (đọc từ trên xuống dưới, từ trái sang phải). Vị trí của hêli (một khí hiếm) nằm trên beri (một kim loại kiềm thổ) bị nhiều nhà hóa học chỉ trích mạnh mẽ. | ||||||||||||||||||||||||||||||||
Các vấn đề và tranh cãi liên quan
Các nguyên tố chưa biết thuộc tính hóa học
Mặc dù tất cả những nguyên tố cho tới ununocti đã được khám phá, trong số các nguyên tố sau hassi (nguyên tố 108), chỉ có copernici (nguyên tố thứ 112) là đã xác định được tính chất hóa học. Các nguyên tố khác có thể biểu hiện khác với cách ngoại suy từ các chu kỳ thấp hơn, do các hiệu ứng tương đối tính; chẳng hạn, người ta tiên đoán flevori là thể hiện tính chất giống khí hiếm, mặc dù nó hiện được đặt trong nhóm cacbon.[102] Tuy nhiên các thí nghiệm gần đây lại đề xuất rằng flevori lại biểu hiện hóa học giống như chì do vị trí trong bảng tuần hoàn của nó.[103]
Mở rộng bảng tuần hoàn trong tương lai
Người ta hiện không rõ liệu các nguyên tố mới có tiếp tục theo trật tự bảng tuần hoàn hiện tại, làm thành chu kỳ 8 hay không, hay sẽ cần những sự cải tiến hay hiệu chỉnh thêm. Glenn T. Seaborg cho rằng chu kỳ 8 sẽ đi theo đúng trật tự, bao gồm một khối s hai nguyên tố cho các nguyên tố 119 và 120, một khối g mới cho 18 nguyên tố tiếp theo, và 30 nguyên tố tiếp tiếp tục các khối f, d và p.[104] Gần đây, các nhà vật lý như Pekka Pyykkö đưa ra giả thuyết rằng những nguyên tố này sẽ không theo quy tắc Klechkowski về cách thức lấp đầy lớp vỏ electron và do đó sẽ ảnh hưởng tới hình dạng bảng tuần hoàn hiện tại.[105]
Quy mô tối hậu
Các nhà khoa học cũng chưa biết có thể có tất cả bao nhiêu nguyên tố. Từ năm 1911 Elliod Adams đã đề xuất, dựa trên sự sắp xếp các nguyên tố theo các hàng ngang của bàng tuần hoàn, rằng các nguyên tố với khối lượng lớn hơn khoảng 256 khối lượng hiđrô (tức bằng khoảng giữa nguyên tố 99 và 100 hiện nay) không tồn tại, một tiên đoán sớm tỏ ra sai lầm.[106] Một ước tính gần đây hơn là bảng tuần hoàn có thể kết thúc ngay sau miền đảo ổn định,[107] có tâm xung quanh nguyên tố 126, do sự mở rộng bảng tuần hoàn các nguyên tố (cũng như các nuclid nói chung) bị giới hạn bởi proton và neutron trong những thứ gọi là "đường nhỏ giọt" (tức các đường giới hạn của tính ổn định hạt trong bảng nuclid).[108] Các tiên đoán khác bảng tuần hoàn kết thúc ở nguyên tố 128 như bởi John Emsley,[7] nguyên tố 137 như bởi Richard Feynman[109] và nguyên tố 155 bởi Albert Khazan.[110][chú thích 11]
Hạn chế của các mô hình cơ học lượng tử hiện tại khiến cho việc xác định nguyên tố cuối cùng khả dĩ của bảng tuần hoàn trở nên khó khăn. Mô hình Bohr tiên đoán rằng với số hiệu nguyên tử lớn hơn 137, một nguyên tử sẽ cần electron phân lớp 1s di chuyển nhanh hơn vận tốc ánh sáng, một điều bất khả; nhưng mô hình này chưa chính xác vì không xét tới hiệu ứng tương đối tính.[112] Các phương trình tương đối tính của Paul Dirac cũng gặp vấn đề với các nguyên tố có nhiều hơn 137 proton. Với các nguyên tố như vậy, hàm sóng của trạng thái Dirac cơ bản có tính dao động hơn là liên kết, và không có khoảng cách nào giữa các phổ năng lượng dương và âm, như trong nghịch lý Klein.[113] Các bổ chính đưa vào liên quan tới hiệu ứng kích thước hữu hạn của hạt nhân chỉ ra rằng năng lượng liên kết thứ nhất sẽ vượt giới hạn cho các nguyên tố nhiều hơn 137 proton. Đối với những nguyên tố nặng hơn, nếu orbital trong cùng (1s) không bão hoàn, trường điện từ của hạt nhân sẽ kéo một electron ra khỏi chân không, dẫn tới bức xạ positron tự phát;[114] tuy nhiên điều này không xảy ra nếu 1s bão hòa, do đó nguyên tố 137 không nhất thiết là điểm tận cùng của bảng tuần hoàn.[109]
Các vị trí không tương hợp
Bảng tuần hoàn có một số phần không tương hợp gây nên các tranh luận tới ngày nay. Một trong số đó là vị trí của hiđrô và heli thường được đặt ở những vị trí không tương ứng với cấu hình electron của chúng. Hiđrô nằm trên lithi trong bảng tiêu chuẩn, nhưng có khi nằm trên fluor, hoặc thậm chí cacbon vì tính chất ít nhiều tương tự với các nguyên tố này.[115] Đôi khi hiđrô được đặt ở một nhóm riêng, vì biểu hiện của nó không đủ giống với bất kì nguyên tố nào khác để nằm chung một nhóm.[116] heli thường đặt ở trên neon, nhưng cũng có lúc nằm trên beryli theo cấu hình electron(heli: 1s2; beryli: [He] 2s2).[23]
Một vấn đề khác liên quan tới các nhóm chứa các kim loại chuyển tiếp. Định nghĩa của IUPAC về kim loại chuyển tiếp là những nguyên tố có nguyên tử với phân lớp d chưa hoàn thành, hoặc có thể tạo ra các cation với phân lớp d chưa hoàn thành.[117] Theo định nghĩa này tất cả các nguyên tố trong các nhóm từ 3 tới 11 là kim loại chuyển tiếp. Tuy nhiên một số nhà hóa học vẫn xem "nguyên tố khối d" và "kim loại chuyển tiếp" là những thuật ngữ hoán đổi được cho nhau, và do đó bao gồm cả nhóm 12 (kẽm, cadmi, thủy ngân), mặc dù nhóm này là ngoại lệ với các electron phân lớp d thường không tham gia vào liên kết hóa học. Gần đây người ta phát hiện ra rằng thủy ngân có thể sử dụng electron phân lớp d để hình thành thủy ngân fluorrit (HgF4), cổ vũ cho lập luận rằng thủy ngân (và do đó nhóm 12) nên được chính thức công nhận là kim loại chuyển tiếp.[118] Tuy nhiên, những nhà bình luận như Jensen cho rằng sự hình thành một hợp chất HgF4 chỉ xảy ra dưới những điều kiện hết sức không bình thường; và do đó thủy ngân không thể được xem là kim loại chuyển tiếp theo bất cứ cách diễn giải hợp lý về nghĩa thông thường của thuật ngữ này.[119]. Cũng đi theo cách diễn giải về hóa tính, một số nhà hóa học khác đi xa hơn tới chỗ loại trừ các nguyên tố nhóm 3 ra khỏi nhóm kim loại chuyển tiếp. Lập luận của họ là nhóm 3 không hình thành bất kì ion nào có phân lớp d bị chiếm giữ một phần và do đó không thể hiện bất kì tính chất nào đặc trưng cho kim loại chuyển tiếp.[120]
Ngoài ra, ở nhóm 3 cũng có một vấn đề khác liên quan tới các chu kỳ sau của nhóm này. Người ta không thống nhất được hai nguyên tố sau scandi và ytri là gì, một số cho là lanthan và actini[121], nhưng số khác cho là luteti và lawrenci.[122] Có một vài lập luận, dựa trên cả hóa học và vật lý, ủng hộ mạnh mẽ cách sắp xếp sau nhưng không phải ai cũng cảm thấy chúng đủ thuyết phục.[123] Bảng tuần hoàn chính thức của IUPAC hiện nay chọn cách thể hiện tất cả họ lanthan và actini bằng cách đánh dấu chúng trong một ô của nhóm 3.[124] Định nghĩa của IUPAC về thuật ngữ "lanthanoid" (hay "lanthanide", tức họ lanthan) bao gồm 15 nguyên tố gồm cả lanthan và luteti, và "transition element" (nguyên tố chuyển tiếp) áp dụng cho lanthan và actini, cũng như luteti nhưng không có lawrenci, bởi vì nó không tương hợp với nguyên lý Aufbau.[117] Thông thường electron thứ 103 sẽ đi vào phân lớp d, nhưng các nghiên cứu cơ học lượng tử cho thấy cấu hình thực tế là [Rn]5f147s27p1[chú thích 12] do hiệu ứng tương đối tính. IUPAC hiện không khuyến nghị một dạng cụ thể nào cho khối f trong hàng của bảng tuần hoàn, khiến cho vấn đề còn để ngỏ..[125][126]
Dạng tối ưu
Sự tồn tại nhiều dạng bảng tuần hoàn khác nhau làm dấy lên câu hỏi liệu có một dạng tối ưu xác định rõ ràng của bảng tuần hoàn. Câu trả lời có lẽ phụ thuộc vào liệu tính tuần hoàn hóa học xảy ra với các nguyên tố có một chân lý ngầm ẩn, gắn kết vào bản thể vũ trụ, hay là tính tuần hoàn đó chỉ là sản phẩm của cách diễn dịch chủ quan của con người, tùy thuộc vào hoàn cảnh, niềm tin và thiên kiến của người quan sát. Bất kì cơ sở khách quan nào về tính tuần hoàn hóa học cũng sẽ phải giải quyết các câu hỏi về vị trí của hiđrô và heli hay cấu tạo của nhóm 3 như đã nêu trên. Một chân lý như thế, nếu tồn tại, hiện nay vẫn chưa tìm thấy cho nên với sự vắng mặt của nó, các dạng bảng tuần hoàn khác nhau có thể dược xem như là những biến thể trên chủ đề về tính tuần hoàn hóa học, mỗi biến thể khám phá và nhấn mạnh những khía cạnh, tính chất và những mối quan hệ khác nhau giữa các nguyên tố.[chú thích 13] Sự phổ biến của dạng bảng vừa của Deming mà ngày nay ta gọi là dạng "tiêu chuẩn" có thể là kết quả của sự cân bằng tốt giữa kích thước và cấu trúc tiện dụng, và sự minh họa trật tự nguyên tử và các xu hướng tuần hoàn.[55][129]
Xem thêm
Chú thích
- Các nguyên tố phát hiện ban đầu nhờ tổng hợp nhưng về sau tìm thấy trong tự nhiên là techneti (Z=43), promethi (61), astatin (85), franci (87), neptuni (93), plutoni (94), americi (95), curi (96), berkeli (97) và californi (98).
- Một số bảng bao gồm cả nguyên tố 0 (tức chất thuần túy bao gồm neutron, tuy nhiên điều này rất hiếm, như ở thiên hà nguyên tố của Philip Stewart.
- Có sự không nhất quán và không liên tục trong quy ước này. Theo đó, heli đặt vào khối p nhưng thực ra là một nguyên tố khối s, và phân lớp d trong khối thực ra lấp đầy khi tới nhóm 11 thay vì nhóm 12.
- Các khí hiếm, astatin, franci, và tất cả các nguyên tố nặng hơn americi bị loại ra vì không có dữ liệu liên quan.
- Tiếng Anh: inert pair effect, là khuynh hướng electron ở orbital ngoài cùng không ion hóa hoặc không bị dùng chung.Sidgwick, Nevil Vincent (1927). The Electronic Theory of Valency. Oxford: Clarendon. tr. 178–81.
- Một tiền thân của bảng 17 cột của Deming có thể thấy trong Bảng tuần hoàn 16 cột của Adams năm 1911. Adams tách các nguyên tố đất hiếm và các 'nguyên tố phóng xạ', tức họ actini, khỏi phần thân và thể hiện chúng dưới dạng còn khuyết chỉ để tiết kiệm không gian (các nguyên tố đất hiếm nằm giữa Ba và eka-Yt; các nguyên tố phóng xạ ở giữa eka-Te và eka-I).[76]
- Một hàng rất dài các nguyên tố, bao gồm những nguyên tố đã biết và chưa biết với khối lượng nguyên tử lớn hơn bismut đã được đề cập từ năm 1892. Hầu hết những nhà nghiên cứu tin rằng chúng tương đồng với các nguyên tố chuyển tiếp ở chuỗi thứ ba. Sự tồn tại của một chuỗi chuyển tiếp trong thứ hai, dưới dạng họ actini, chỉ được cháp nhận khi bằng chứng cho thấy chúng có cấu trúc electron tương tương tự với họ lanthan.[83]
- Xem minh họa về các loại biến thể ở The Internet database of periodic tables.
- Karol (2002, tr. 63) quả quyết rằng hiệu ứng hấp dẫn sẽ trở nên đáng kể khi số hiệu nguyên tử bắt đầu trở nên cực lớn, do đó vượt qua các hiện ứng mất ổn định khác của hạt nhân siêu nặng, và các sao neutron có thể được xem như là đại diện cho những nguyên tố nặng nhất (với nguyên tử số lên tới cỡ 1021) trong toàn vũ trụ.[111]
- Cấu hình được kỳ vọng của lawrenci nếu nó tuân theo nguyên lý Aufbau sẽ là [Rn]5f146d17s2, với phân lớp 6d chưa hoàn thành nằm trong trạng thái trung hòa.
Trích dẫn
Thư mục tham khảo
Liên kết ngoài
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
