Loading AI tools
інфекційне захворювання З Вікіпедії, вільної енциклопедії
Туберкульоз (лат. tuberculosis; або ТБ — скорочення від туберкульозна бактерія; заст. сухоти[25][26]) — поширене й у багатьох випадках летальне інфекційне захворювання з хронічним перебігом і частою багатосистемністю уражень. Трапляється як серед людей, так і серед тварин. Його спричинюють різні види мікобактерій, частіше за все Mycobacterium tuberculosis.[27] Найчастіше патологічний процес зосереджується в легенях (легеневий туберкульоз), також може уражати інші органи тіла (позалегеневий туберкульоз) — мозкові оболони, нирки, печінка, кістки, шкіра тощо. Передається повітряно-крапельним механізмом передачі інфекції, коли хворі на активний легеневий або гортанний туберкульоз кашляють, чхають або іншим чином виділяють слину у повітря.[28] Велика частка випадків хвороби є субклінічними і латентними. Приблизно кожна 10-та латентна інфекція прогресує до активного процесу.
| Туберкульоз | |
|---|---|
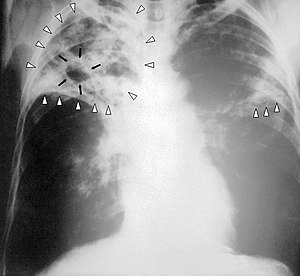 Рентгенограма органів грудної клітки пацієнта з прогресуючим туберкульозом. Білі стрілки вказують на вогнища хвороби в обох легенях. Чорні стрілки вказують на сформовану порожнину (каверну). | |
| Спеціальність | інфекційні хвороби і пульмонологія |
| Симптоми | кашель[1], кровохаркання, схуднення[1], гарячка[1], нічні потиd[2], біль за грудиною[1], втома[1] і озноб[1] |
| Причини | M. tuberculosis[3][4] |
| Метод діагностики | рентгенографія грудної кліткиd[5], КТ грудної клітиниd[6], проба Манту[7], біопсія легеньd[8], радіологія туберкульозуd[9], флюорографія грудної клітиниd[10], посів мокротинняd[11], GeneXpert MTB/RIFd[12], TB-LAM in the Diagnosis of TBd[13][14], QuantiFERONd[15], Фарбування за Цілем — Нільсеном[16] і T-SPOT.TBd[17] |
| Ведення | протитуберкульозні лікиd |
| Препарати | Циклосерин[18], етіонамід[18], Парааміносаліцилова кислота[18], Етамбутол[18], Капреоміцин[18], Піразинамід[18], ізоніазид[18], ізоніазид[19], Біоміцин[20], Піразинамід[21], Циклосерин[22], етіонамід[23] і рифампіцин[24] |
| Частота | 0.043—0.045% (Суринам), 0.00033—0.00053% (Ісландія), 0.077—0.079% (Еквадор), -0.99—1.01% (Норвегія), -0.00088—0.00112% (Франція), 0.0029% (Сполучені Штати Америки), 0.0028% |
| Класифікація та зовнішні ресурси | |
| МКХ-10 | A15-A19 |
| OMIM | 607948 |
| DiseasesDB | 8515 |
| MedlinePlus | 000077 |
| eMedicine | med/2324 emerg/618 radio/411 |
| MeSH | D014376 |
| | |
Хоча більшість випадків туберкульозу спричинює Mycobacterium tuberculosis, для яких люди є основним резервуаром, і саме такий туберкульоз називають класичним, але подібне захворювання іноді породжують інші мікобактерії — M. bovis, M. africanum та M. microti, які разом з M. tuberculosis відомі як видовий комплекс Mycobacterium tuberculosis.
Класичними проявами активної туберкульозної інфекції є хронічний кашель з кровохарканням, гарячкою, нічною пітливістю і втратою ваги. Ураження інших органів зумовлює широкий спектр симптомів. Діагностування активного туберкульозу проводиться шляхом виявлення збудника і його слідів, рентгенологічними дослідженнями, найчастіше рентгенографією грудної клітки й комп'ютерною томографією. Діагностування латентного туберкульозу засноване на туберкуліновій шкірній пробі. Лікування складне і вимагає вживання декількох видів протитуберкульозних препаратів упродовж тривалого часу. Контактних людей також перевіряють і, за необхідності, лікують. Резистентність до антибіотиків є проблемою при цій хворобі, особливо у випадку мультирезистентного туберкульозу. Для попередження туберкульозу потрібно масово перевіряти людей на наявність його та проводити вакцинацію за допомогою вакцини БЦЖ, яка створює імунітет проти зараження Mycobacterium tuberculosis.


У 1993 році Всесвітня організація охорони здоров'я оголосила туберкульоз «глобальною загрозою для здоров'я».[31] 2006 року Товариство подолання туберкульозу розробило Глобальний план подолання туберкульозу, згідно з яким до 2015 року планувалося врятувати 14 мільйонів життів.[32] Але за оновленими даними це зберегло 53 млн життів станом на 2016 рік. Певні цілі, які товариство поставило перед собою не були досягнуті до 2015 року, в основному через зростання нових випадків захворювання на ВІЛ-асоційований туберкульоз та виникнення мультирезистентного туберкульозу (MDR-TB).[31] Загалом захворюваність на туберкульоз падає приблизно на 2 % на рік. Це потрібно прискорити до 4-5 % річного зниження, щоб досягти у 2020-х найважливіших етапів «Стратегії подолання туберкульозу» (WHO End TB Strategy), прийнятої у 2014 році на Генеральній Асамблеї ВООЗ. Завершення епідемії туберкульозу до 2030-го року є кінцевою метою цієї стратегії.
Експерти Всесвітньої організації охорони здоров'я (ВООЗ) вважають, що хвороба входить до переліку 10-ти найбільш смертельних хвороб[33]. У 2007 р. по всьому світу було приблизно 13,7 мільйонів хронічних хворих.[34] 2016 року 10,4 мільйона людей захворіли на туберкульоз, а 1,7 мільйона людей померли від цієї хвороби (у тому числі 0,4 мільйона серед людей із ВІЛ-інфекцією). Більше 95 % випадків смерті від туберкульозу виникають у країнах з низьким та середнім рівнем доходів (країнах, що розвиваються). У 2016 році близько 1 мільйона дітей захворіли на туберкульоз, а 250 тисяч дітей померли від нього (у тому числі дітей, хворих на ВІЛ-інфекцію).[33][35] Усе більше людей у країнах, що розвиваються, захворюють на туберкульоз через знижений імунітет. Зазвичай вони захворюють на туберкульоз через наявність ВІЛ-інфекції, яка з часом переходить у СНІД.[31] Туберкульоз є провідною причиною смерті ВІЛ-позитивних людей: у 2016 році 40 % випадків летальності від ВІЛ-інфекції були пов'язані з туберкульозом. У людей, що інфіковані ВІЛ, до 30 разів частіше розвивається активний туберкульоз.[33]. У 2016 році найбільша кількість нових випадків туберкульозу відбулось в Азії (45 %), а потім в Африці (25 %). 87 % нових випадків відбулось у 30 країнах з високим тягарем туберкульозу. Сім країн мають 64 % випадків від загальної кількості захворілих, на чолі з Індією це Індонезія, Китай, Філіппіни, Пакистан, Нігерія та Південна Африка[33]. Мультирезистентний туберкульоз залишається кризою громадської охорони здоров'я та загрозою для здоров'я. За оцінками ВООЗ, було зареєстровано 600 000 нових випадків стійкості до рифампіцину — найбільш ефективного протитуберкульозного препарату першої лінії, з яких 490 000 хворих мали мультирезистентність[33].
Приблизно в однієї чверті населення у світі спостерігається латентний туберкульоз, а це означає, що ці люди заражені збудниками туберкульозу, але ще не хворіли на хворобу і не можуть передати далі збудника. 15 % людей з латентною формою ризикують захворіти на активний туберкульоз протягом життя. Проте, люди з скомпрометованою імунною системою (які живуть з ВІЛ, мають недоїдання або цукровий діабет, або люди, які курять, тощо) мають набагато більший ризик виникнення активного тяжкого захворювання. Зокрема, 8 % випадків захворювання на туберкульоз у всьому світі пов'язані з курінням. Коли у людини розвивається активний туберкульоз, його симптоми можуть бути невиразними протягом багатьох місяців. Це може призвести до затримки діагностики, лікування та передачі збудника іншим. Люди з активним туберкульозом можуть заразити 10-15 інших людей за умови тісного контакту протягом року. Без належного лікування в середньому близько 45 % ВІЛ-негативних людей з туберкульозом і майже всі ВІЛ-позитивні з туберкульозом помруть[33].
Абсолютне число захворювань на туберкульоз зростає з 2005 року. Кількість нових захворювань на туберкульоз («захворюваність») почала зменшуватись у 2002 році.[36] Зокрема у Китаї було досягнуто значного прогресу. У Китаї рівень смертності від туберкульозу зменшився приблизно на 80 % у період з 1990 по 2010 рік.[37] У багатьох країнах Азії та Африки приблизно у 80 % населення результати туберкулінової проби є позитивними, в той час як в США тільки 5-10 % є позитивними.[27] Експерти сподівалися, що туберкульоз можна буде повністю контролювати. Однак є декілька факторів, через які повний контроль над туберкульозом є малоймовірним:
У 2007 році Свазіленд став країною з найвищим припустимим рівнем захворюваності на туберкульоз: там було зареєстровано 1200 випадків захворювання на 100 000 осіб. Загалом найбільший загальний рівень захворюваності зафіксовано в Індії, де за повідомленнями зареєстровано 2 мільйони випадків нових захворювань.[34] У розвинених країнах туберкульоз є менш поширеним, в основному він поширений у міських районах. У 2010 році рівень захворюваності на туберкульоз на 100 000 осіб у різних частинах світу складав: у світі — 178, в Африці — 332, в Америці — 36, у Східному Середземномор'ї — 173, у Європі — 63, у Південно-Східній Азії — 278 та у західній частині Тихого океану — 139.[37] У Канаді та Австралії на туберкульоз значно частіше хворіє корінне населення, особливо у віддалених районах.[38][39] У Сполучених Штатах від туберкульозу корінне населення помирає у п'ять разів частіше.[40]
Рівень захворюваності на туберкульоз залежить від віку. В Африці на туберкульоз хворіють діти від 12 до 18 років, а також молоді люди.[41] Однак у країнах, де рівень захворюваності значно зменшився (таких як Сполучені Штати), на туберкульоз переважно хворіють люди похилого віку та люди з порушеною імунною системою.[27][42]
Пандемія коронавірусної хвороби 2019 змінила багаторічний глобальний прогрес у боротьбі з туберкульозом і вперше за більш ніж десятиліття летальність від туберкульозу зросла за 2021 рік[43][44].
На цьому місці має відображатися графік чи діаграма, однак з технічних причин його відображення наразі вимкнено. Будь ласка, не видаляйте код, який викликає це повідомлення. Розробники вже працюють для того, щоби відновити штатне функціонування цього графіка або діаграми. |
У 1995 році в Україні проголошена епідемія туберкульозу — захворюваність стрімко збільшувалась і перевищила епідемічний поріг — 50 випадків на 100 тис. населення. З 1995 року рівень захворюваності на туберкульоз збільшився майже удвічі і в 2005 році, коли реєстрували найвищий рівень цього показника, він становив — 84,1 випадки на 100 тис. населення. 2013 року захворюваність на туберкульоз в Україні становила 67,9 випадки на 100 тис. населення, смертність від туберкульозу — 14,1 на 100 тис. населення. Відповідно до соціальної структури вперше виявлених хворих (за даними 2013 року) показав, що серед тих, які вперше захворіли 56,0 % складали безробітні особи працездатного віку, 12,9 % — пенсіонери, 3,0 % — особи без постійного місця проживання; 1,0 % — особи, які повернулись з місць позбавлення волі. Серед захворілих соціально незахищені верстви населення становили більше 70 %.
Захворюваність дітей на органний туберкульоз в Україні у 2013 році становила 11,7 на 100 тис. населення. Завдяки системі ранньої діагностики і профілактики туберкульозу у дітей відсоток вперше діагностованих хворих дітей серед загальної кількості вперше діагностованих хворих у країні склав 1,8 %, що значно нижче, ніж у більшості країн (за даними ВООЗ цей відсоток коливається від 3 % до 25 % і вище). Захворюваність на туберкульоз у дітей підліткового віку в 3 рази вища, ніж у дітей до 14 років і склала в останні роки 24–28,1 на 100 тис. (у 2013 р. — 24,7 на 100 тис.). В умовах епідемії відбувається високе інфікування дітей.
За даними прес-служби Міністерства охорони здоров'я України, на сучасному етапі Україна віднесена до групи країн з високим рівнем захворюваності на туберкульоз та посідає за цим показником сьоме місце в Європейському регіоні Всесвітньої організації охорони здоров'я після Росії, Грузії, Киргизстану, Румунії, Молдови та Казахстану[45].
Так, у 2007 році на диспансерному обліку у протитуберкульозних закладах України перебувало 498 643 хворих, у тому числі хворих на активні форми туберкульозу — 93 195 осіб. Найвищі показники захворюваності на всі форми туберкульозу залишалися у південно-східних регіонах України: у Херсонській області — 151,4 на 100 тисяч населення (у 2006 році — 155,7); Кіровоградській — відповідно 101,9 (у 2006 році — 113,4); Луганській — 103,5 (у 2006 році — 111,7). У структурі захворюваності на туберкульоз найбільший відсоток припадає на безробітних працездатного віку.
Показник смертності від туберкульозу за 15 останніх років[яких?] збільшився у 2,9 рази. «Цей показник у 2005 році становив 25,6 на 100 тис. населення. У 2007 році він у порівнянні з попереднім 2006 роком також не мав тенденції до зниження, і становив 22,6 на 100 тис. населення», — зазначено з цього приводу у повідомленні МОЗ.
Епідемія туберкульозу в Україні має дві особливості. По-перше, спостерігається взаємозалежність швидкості поширення туберкульозу від епідемії ВІЛ-інфекції/СНІДу та поширенням наркоманії. Друга — високий рівень хіміорезистентних форм: первинної — 30 % та вторинної — 75 %. За даними ВООЗ, станом на 2012 рік в Україні мультирезистентний туберкульоз мають 16 % хворих, яким вперше встановили діагноз туберкульозу, та 44 % хворих із рецидивом захворювання.
Водночас очевидно недостатнє фінансування регіональних програм протидії туберкульозу. Крім того, у жодному регіоні не забезпечується належне харчування хворих на туберкульоз та інфікованих мікобактеріями туберкульозу за нормами, передбаченими відповідною постановою уряду.
У фтизіатричній службі найболючішим питанням залишається недостатнє кадрове забезпечення в усіх регіонах країни, а також висока захворюваність на туберкульоз серед медичних працівників. Зокрема, станом на 1 січня 2008 року у закладах охорони здоров'я системи МОЗ України зареєстрована 3 601 штатна посада лікарів-фтизіатрів, на яких працює 2 604 лікарів-фізичних осіб, що водночас обіймають 3 289 лікарських посад. Кількість лікарів (у закладах охорони здоров'я з урахуванням санаторіїв) скорочується: у 2004 р. їх було 3147, у 2007 р. — 2951. Найнижчі показники укомплектованості — у Кіровоградській (56,5 %), Миколаївській (62,8 %), Донецькій (61,8 %) областях.
Щодо причин, через які неможливо в найкоротші терміни покращити епідеміологічну ситуацію з туберкульозом, у МОЗ України вказують, що епідемія туберкульозу є надзвичайно «інерційною системою» у своїй реакції на навіть правильну і вчасну протидію епідемічним проявам. Тобто, регресія епідемії туберкульозу в Україні може бути відстрочена у часі на 5-6 років.
Крім того, існують як об'єктивні, так і суб'єктивні причини, насамперед: швидкі темпи зростання кількості хворих на ВІЛ-асоційований туберкульоз та туберкульоз із медикаментозною стійкістю до протитуберкульозних препаратів; вкрай незадовільне матеріально-технічне забезпечення протитуберкульозних закладів та лабораторій; відсутність лабораторії, яка б у повному обсязі виконувала функції центральної лабораторії країни, і забезпечувала контроль за якістю діагностики туберкульозу; високий відсоток хворих, які переривають лікування (від 4,9 до 33 %), що є однією з основних причин розвитку стійких до протитуберкульозних препаратів форм туберкульозу тощо.
У 2016 році загальна кількість пацієнтів в Україні склала близько 365 тис. людей, у той час, як за 4 роки до того, в 2012 році, їх було 457 тис. Пояснити «зникнення» із статистики майже 100 тис. пацієнтів тільки їхнім вилікуванням, еміграцією, залишенням на окупованих територіях і смертю неможливо, тому ймовірним здається втручання «парамедичних» факторів, про природу яких можна тільки здогадуватися. Подібне здивування викликає і інформація про зменшення захворюваності на туберкульоз у 2015 році, порівняно з 2014 роком, з 82 до 60 випадків на 100 тис. населення. За розрахунками міжнародних експертів, цей показник для України насправді має бути більше 100 випадків на 100 тисяч населення. У республіці Білорусь він складає 40, в Польщі — 17, а для країн ЄС у середньому 12[46].
Проте Україна, за даними ВООЗ, належить до п'ятірки країн з найбільшою кількістю зареєстрованих випадків туберкульозу з розширеною резистентністю[47].

Основна причина туберкульозу — Mycobacterium tuberculosis, невелика аеробна нерухома бактерія[48], яку раніше називали бацилою. Багато унікальних клінічних характеристик цього патогену пояснюються високим вмістом ліпідів.[49] Мікобактерія ділиться кожні 16—20 годин, що є вкрай невеликою швидкістю порівняно з іншими бактеріями, для яких цикл ділення становить менше години.[50] Мікобактерії мають подвійний ліпідний шар на зовнішній мембрані.[51], а сама мембрана є кислотопоглинаючою. Через це мікобактерії не забарвлюються карболфуксином. Якщо проводиться фарбування за Грамом, мікобактерія або сприймає фарбу слабо позитивно, або не втримує барвника, оскільки клітинна мембрана має високий вміст ліпідів і міколової кислоти.[52] Мікобактерія є стійкою до слабких дезінфекційних засобів і є стійкою до висушування протягом кількох тижнів. У природі бактерія росте тільки в клітинах організму хазяїна, але культуру M. tuberculosis можна виростити і штучно на особливих поживних середовищах в лабораторії.[53]
За допомогою гістологічних барвників, якими зафарбовують частки харкотиння, які відкашляла людина, іноді можна ідентифікувати мікобактерії при звичайній світловій мікроскопії. Існують два найбільш розповсюджені методи кислотостійкого забарвлювання: фарбування за Цілем — Нельсеном, у результаті якого мікобактерії набувають яскраво-червоного кольору, чітко видимого на блакитному тлі[54], та аураміно-родамінове фарбування, після якого мазок вивчають під флуоресцентним мікроскопом.[55]
Комплекс M. tuberculosis включає чотири інші мікобактерії, які спричинюють класичний туберкульоз: M. bovis, M. africanum, M. canetti та M. microti.[56] M. africanum не є широко поширеною, але є частою причиною туберкульозу в деяких частинах Африки.[57][58] M. bovis була частою причиною людського туберкульозу, але запровадження пастеризації молока в цілому усунуло цю мікобактерію як загрозу громадському здоров'ю в розвинених країнах.[27][59] M. canetti є рідкісною, ймовірно її поширення обмежене Африканським Рогом, хоча кілька випадків спостерігалися серед емігрантів з Африки в Європі.[60][61] M. microti також зустрічається рідко і в основному серед людей із імунодефіцитом, хоча цей патоген може бути більш поширеним, ніж вважається.[62]
Серед інших відомих патогенних мікобактерій — M. avium та M. kansasii. Останні два види класифікують як «нетуберкульозні мікобактерії». Вони не спричинюють класичний туберкульоз, але є причиною легеневих хвороб, подібних до нього.[63] Особливе місце займають M. leprae і M. lepromatosis, які спричинюють тяжке захворювання проказу (лепру).

Джерелом інфекції є хвора на активний туберкульоз людина. Якщо вона не лікується, то може інфікувати 10-15 (або більше) осіб на рік. Зазвичай хворобу передають лише люди з активним туберкульозом. Особи з прихованою інфекцією не вважаються джерелами.[27]
Провідним механізмом передачі є повітряно-крапельний. Коли люди з активним легеневим туберкульозом кашляють, чхають, розмовляють, співають або плюють, вони виділяють у повітря інфіковані аерозольні частинки діаметром від 0,5 до 5 мкм. Наприклад, унаслідок одного чхання у повітрі може опинитися до 40 000 таких частинок.[64] Кожна частинка може переносити збудників, оскільки необхідна кількість для інфікування туберкульозом дуже мала. Людина, яка вдихнула менше 10 бактерій, вже може бути інфікована.[65]
Люди, які вступають у тривалі, часті або близькі контакти з хворими на туберкульоз, знаходяться під високим ризиком зараження — приблизно 22 %.[66]. Для запобігання масовій передачі від однієї людини до іншої необхідно ізолювати людей із активним («відкритим») туберкульозом та розпочати курс лікування. Приблизно через два тижні після ефективного лікування люди з активним нерезистентним туберкульозом зазвичай уже не є заразними для інших[66]. Імовірність передачі від однієї людини до іншої залежить від декількох факторів. Ці фактори включають кількість інфікованих аерозольних частинок, що виділяє джерело інфекції, ефективність вентиляції у середовищі, де знаходиться ця людина, тривалість контакту, вірулентність штаму M. tuberculosis, а також рівень імунітету здорової людини.[67]
Декілька факторів ризику роблять людей вразливішими до туберкульозу. Найбільш значущий фактор ризику по всьому світу — це ВІЛ-інфекція. Ця проблема є поширеною у Субсахарській Африці, де рівень захворюваності на ВІЛ-інфекцію є високим.[68][69] Туберкульоз тісно пов'язаний із перенаселенням і поганим харчуванням. Це робить туберкульоз однією з основних хвороб бідності.[31] Наступні категорії людей входять до групи високого ризику інфікування на туберкульоз:
Ще одним серйозним фактором ризику є хронічні хвороби легенів. Так силікоз збільшує ризик приблизно у 30 разів.[71] Люди, що палять цигарки, знаходяться під удвічі більшим ризиком, ніж ті, що не вживають тютюну.[72] Інші захворювання також можуть збільшити ризик виникнення туберкульозу, включно з алкоголізмом[31] і цукровим діабетом, які потроюють ризик.[73] Вживання деяких ліків, наприклад глюкокортикостероїдів та інфліксімабу (моноклональне анти-αTNF антитіло), призводить до все більшого ризику, особливо в розвинених країнах.[31] Крім того, існує деяка генетична вразливість[74], але науковці ще не дослідили, наскільки важливим є її значення.[31]
Туберкульозне ураження починається, коли мікобактерії досягають альвеол в легенях, де вони проникають в ендосоми альвеолярних макрофагів і розмножуються в них.[27][75] Первинна локалізація патологічного процесу в легенях, також відоме як «вогнище Гона» (Антон Гон, австрійський патолог), розташоване у верхній частині нижньої частки або у нижній частині верхньої.[27] Туберкульоз легенів також може розвиватися через проникнення мікобактерій з кровотоку, тоді розвивається вогнище Сімона. Ураження в такій ситуації зазвичай спостерігається у верхній частині легенів.[76] Така гематогенна передача, також може поширювати збудників до більш віддалених ділянок, таких як периферійні лімфовузли, нирки, мозок, кістки тощо.[27][77] Туберкульозні мікобактерії уражають усі органи організму, хоча з невідомих причин рідко пошкоджують серце, скелетні м'язи, підшлункову або щитоподібну залозу.[78]
Туберкульоз класифікують як одне з гранульоматозних запальних захворювань. Гранульоми містять в собі окрім збудників макрофаги, T-лімфоцити, B-лімфоцити, та фібробласти. Лімфоцити оточують інфіковані макрофаги. Утворення гранульом попереджує поширення мікобактерій по організму. Бактерії всередині гранульоми можуть перейти у фазу латенції (сплячки), що призведе до тривалої латентної інфекції. Ще одна ознака гранульом — утворення некрозу в центрі. При візуальному огляді некроз нагадує м'який білий сир і називається казеозним[79]. Уражена тканина через дію захисних сил організму замінюється рубцевою. Але можливе утворення порожнин (каверн), заповнених казеозним некротичним матеріалом. Протягом активної стадії хвороби у деяких з цих каверн відбувається прорив до бронхів і тоді казеозний вміст може викашлюватися. Він містить живі бактерії і призводить до швидкого поширення збудників. Лікування відповідними антибіотиками вбиває бактерії і дозволяє настати одужанню. Після вилікування хвороби уражені ділянки повністю замінюються рубцевою тканиною.[79]
Туберкульозні бактерії з первинного вогнища в разі неефективності місцевого імунного захисту здатні потрапити до кровотоку. Вони можуть поширюватися по всьому організму і створювати багато туберкульозних вогнищ.[80] Розвивається міліарний туберкульоз, при якому вогнища є малими в діаметрі, як зернятко. Така форма туберкульозу найбільш поширена серед дітей і людей з ВІЛ-інфекцією.[81] Люди з цієї формою туберкульозу мають високі показники летальності навіть в разі проведення лікування (приблизно 30 %).[82][83]
У багатьох випадках за відсутності адекватної терапії через прогресуючу інтоксикацію розвивається кахексія, яка разом з дихальною недостатністю призводить до смерті пацієнта.
Згідно з міжнародним класифікатором хвороб 10-го перегляду туберкульоз класифікується в окремій підрозділ «A.15-A.19»:
У програмах охорони здоров'я населення використовують систему класифікації туберкульозу, яку розробили в Американському торакальному товаристві.[84]

1. Локалізація і поширеність: — у легенях за номерами (назвами) сегментів, назвами часток легені, а в інших органах і системах — за анатомічними назвами локалізації ураження. 2. Фаза:
3. Метод підтвердження:
4. Етап туберкульозного процесу (із зазначенням дати його встановлення):
Первинний туберкульоз розвивається лише в 7–10 % інфікованих, частіше у дітей, в інших інфікування виявляється лише віражем туберкулінових проб. Виникає при інфікуванні збудником і розвитку первинної туберкульозної інфекції без локальних ознак, що верифікується рентгенологічними та іншими методами обстеження. Туберкульозна інтоксикація виявляється у дітей та підлітків із вперше позитивними реакціями на туберкулін, що посилюються в процесі спостереження, а також з гіперергічними реакціями. При ній така активність туберкульозу, що відбувається погіршання загального стану хворого, виявляється періодичним субфебрилітетом, зниженням апетиту, появою підвищеної нервової збудливості або її пригніченням, головним болем, тахікардією, незначним збільшенням периферичних лімфатичних вузлів (мікрополіаденопатія) з явищами періаденіту, невеликим збільшенням печінки, рідше селезінки; зупинкою фізіологічного приросту або дефіцитом маси тіла, схильністю до інтеркурентних захворювань, змінами в клінічному аналізі крові (нерізко виражене підвищення ШОЕ, зрушення нейтрофілів вліво, еозинофілія, лімфоцитоз, можлива лімфопенія), зміною імунологічного статусу (зниженням кількості Т-лімфоцитів та їхньої функціональної активності).
Первинний туберкульозний комплекс характеризується розвитком запалення у легеневій тканині, ураженням регіонарних внутрішньогрудних лімфатичних вузлів і лімфангітом. Він частіше відбувається в дитячому віці, значно рідше в осіб 18–25 років, перебігаючи з «віражем» туберкулінової реакції. Клінічні прояви первинного комплексу залежать від фази процесу, особливостей перебігу і реактивності організму. Він може мати малосимптомний перебіг, однак частіше наявні ознаки туберкульозної інтоксикації, особливо при залученні серозних оболонок (плеврит, полісерозит) і бронхів.
Розрізняють неускладнений і ускладнений клінічний перебіг первинного комплексу. При ускладненому перебігу може спостерігатися великий інфільтрат з ураженням сегмента або частки легені, розпад з утворенням первинної каверни, ураження бронхів, розвиток ателектазу в інших ділянках легені, лімфогенне і гематогенне поширення, а також перехід у первинний туберкульоз з хронічним перебігом. Можуть бути параспецифічні алергічні реакції, підвищена чутливість до туберкуліну.
У сучасних умовах у більшості хворих первинний комплекс, особливо під впливом хіміотерапії, має малосимптомний перебіг, підлягаючи розсмоктуванню, ущільненню й звапненню. Звапнення первинного вогнища в легенях і лімфатичних вузлах у дорослих буває рідко. За останні десятиріччя все рідше спостерігається первинний туберкульозний комплекс із типовою біполярністю.
Туберкульоз внутрішньогрудних лімфатичних вузлів розвивається внаслідок первинного інфікування збудником дітей, підлітків і дорослих молодого віку. Рідше виникає внаслідок ендогенної реактивації туберкульозних змін, що були у внутрішньогрудних лімфатичних вузлах. Розрізняють інфільтративний, так звані «малі» та пухлиноподібний варіанти туберкульозу внутрішньогрудних лімфатичних вузлів:
У випадках пізнього виявлення і неефективного лікування можливе формування первинного туберкульозу з хронічним хвилеподібним перебігом, поліморфізмом морфологічних змін у лімфатичних вузлах (кальцинація, фіброз, свіже запалення). У такій ситуації періодично виникають різні клінічні прояви гіперсенсибілізації, описані як «маски» хронічного первинного туберкульозу (вузлувата еритема, фліктени, поліартрит тощо). При всіх варіантах туберкульозу внутрішньогрудних лімфатичних вузлів, а найчастіше за хронічного його перебігу, можливі ускладнення у вигляді запальної реакції плеври (плеврит), специфічного ураження бронхів з розвитком сегментарних або часткових ателектазів, дисемінації в легені й різні органи (бронхолегеневі форми процесу).
Дисемінований туберкульоз легень характеризується появою множинних, зазвичай в обох легенях, вогнищ дисемінації гематогенного, лімфогенного або змішаного генезу різної давнини; з різноманітним співвідношенням ексудативного і продуктивного запалення, гострим, підгострим чи хронічним клінічним перебігом.
Варіанти дисемінованого туберкульозу розрізняють за патогенезом і клінічним перебігом. Залежно від шляху поширення збудника виділяють гематогенний і лімфобронхогенний дисемінований туберкульоз. Обидва варіанти можуть мати гострий, підгострий і хронічний початок хвороби.
Вогнищевий туберкульоз легень характеризується наявністю різного генезу і давності невеликих (до 10 мм у діаметрі) вогнищ переважно продуктивного характеру, що локалізуються в обмеженій ділянці однієї чи обох легень і займають 1–2 сегменти, та малосимптомним клінічним перебігом. До вогнищевих форм належать як ті, що недавно виникли, свіжі (так звані м'якоцентрові) процеси з розміром вогнищ менш 10 мм, так і давніші (фіброзно-вогнищеві утворення) з явно вираженими ознаками активності процесу. Свіжий вогнищевий туберкульоз характеризується наявністю м'яких вогнищевих тіней з дещо розмитими краями. Фіброзно-вогнищевий туберкульоз проявляється наявністю щільних вогнищ, іноді з включенням вапна, фіброзними змінами у вигляді тяжів та ділянок гіперпневматозу. У період загострення також можуть виявлятися свіжі, м'які вогнища.
Інфільтративний туберкульоз легень — специфічний ексудативно-пневмонічний процес протяжністю більше 10 мм зі схильністю до прогресуючого перебігу. Клінічні прояви залежать від поширеності та виразності інфільтративно-запальних змін у легенях. Розрізняють такі клініко-рентгенологічні варіанти цього процесу: лобулярний, круглий, хмароподібний, перисцисурит, лобіт. Для всіх клініко-рентгенологічних варіантів інфільтративного туберкульозу притаманна не тільки наявність інфільтративної тіні, часто з розпадом, але й можливість бронхогенного засіву. Інфільтративний туберкульоз легень може мати інапарантний перебіг і виявлятись виключно при рентгенологічному дослідженні. Частіше клінічний перебіг процесу нагадує різні хвороби (пневмонію, бронхіт, тощо). Це так звані «маски» туберкульозу. У більшості хворих спостерігається гострий або підгострий початок захворювання. Одним із проявів інфільтративного туберкульозу може бути кровохаркання при загальному задовільному стані пацієнта.
Казеозна пневмонія — гостра специфічна пневмонія, яка характеризується казеозно-некротичними змінами, що швидко наростають, і тяжким, нерідко швидкоплинним смертельним перебігом. Її характеризують: тяжкий стан пацієнта, фебрильна гарячка, виразні симптоми інтоксикації, рясні катаральні прояви в легенях, лейкоцитоз із різким зрушенням вліво лейкоцитарної формули, масивне бактеріовиділення. Перебігає казеозна пневмонія у вигляді лобарної і лобулярної форми. При швидкому розрідженні казеозних мас відбувається утворення або гігантської каверни, або численних невеликих каверн.
Туберкульома легень — різноманітного генезу, як правило, інкапсульоване з перевагою казеозного процесу утворення, розмірами понад 1 см у діаметрі з невиразними клінічними проявами. Виділяють туберкульоми інфільтративно-пневмонічного типу, гомогенні, шаруваті, конгломератні й так звані «псевдотуберкульоми» (заповнені каверни). На рентгенограмі туберкульоми виявляються у вигляді тіні округлої форми з чіткими контурами. У фокусі може спостерігатися серпоподібне просвітлення за рахунок розпаду, іноді — перифокальне запалення і невелика кількість бронхогенних вогнищ, а також ділянки звапнення. Туберкульоми бувають одиничні й численні. Розрізняють також дрібні туберкульоми (до 2 см у діаметрі), середні (2–4 см) і великі (більше 4 см у діаметрі). Є 3 клінічні варіанти перебігу туберкульом:
Фіброзно-кавернозний туберкульоз легень характеризується наявністю фіброзної каверни, розвитком фіброзних змін у легеневій тканині, що оточує каверну, вогнищ бронхогенного відсіву різної давнини як навкруги каверни, так і в протилежній легені, постійним або періодичним виділенням збудника, хронічним, хвилеподібним, як правило, прогресуючим перебігом. Зазвичай уражаються й бронхи, що дренують каверну. Розвиваються й інші морфологічні зміни в легенях: пневмосклероз, емфізема, бронхоектази. Формується цей варіант легеневого туберкульозу з інфільтративного або дисемінованого процесу при прогресуючому перебігу хвороби. Поширеність змін у легенях є різною і процес буває однобічним або двобічним з наявністю від однієї до багатьох каверн.
Клінічні прояви різноманітні, вони зумовлені не тільки самим туберкульозом, але й змінами легень навколо каверни, а також ускладненнями, що виникають. Розрізняють три клінічних варіанти перебігу:
Циротичний туберкульоз характеризується розростанням грубої сполучної тканини, в якій зберігаються активні туберкульозні вогнища, що зумовлюють періодичні загострення з можливим мізерним виділенням збудника. Характеризується розвитком сполучної тканини в легенях і плеврі внаслідок зворотного розвитку фіброзно-кавернозного, хронічного дисемінованого, масивного інфільтративного, уражень плеври, туберкульозу внутрішньогрудних лімфатичних вузлів, ускладненого бронхолегеневими ураженнями. До циротичного туберкульозу належать такі процеси, при яких зберігаються туберкульозні зміни в легенях із клінічними проявами активності процесу зі схильністю до періодичних загострень, з періодами мізерного виділенням збудника. Цей варіант туберкульозу буває сегментарним і лобарним, обмеженим і поширеним, однобічним і двобічним. Для нього характерний розвиток бронхоектазів, емфіземи легень, спостерігаються симптоми легеневої і серцево-судинної недостатності. Цей варіант туберкульозу буває сегментарним і лобарним, обмеженим і поширеним, одностороннім і двостороннім. Для нього притаманний розвиток бронхоектазів, емфіземи легень, виявляються прояви легеневої і серцево-судинної недостатності. У класифікації цирози легень віднесені до залишкових змін після клінічного видужання.
Туберкульозний плеврит (у тому числі емпієма) частіше супроводжує легеневий і позалегеневий туберкульоз. Зустрічається переважно при первинному туберкульозному комплексі, туберкульозі внутрішньогрудних лімфатичних вузлів, дисемінованому туберкульозі легень. За характером туберкульозні плеврити бувають:
Діагноз плевриту встановлюється за сукупністю клінічних і рентгенологічних ознак, а характер плевриту — при пункції плевральної порожнини або біопсії плеври. Пневмоплеврит (наявність у плевральній порожнині повітря і рідини) формується при спонтанному пневмотораксі або як ускладнення лікувального пневмотораксу.
Туберкульоз плеври, що супроводжується накопиченням гнійного ексудату, являє собою особливу форму ексудативного плевриту — емпієму. Розвивається при поширеному казеозному ураженні плеври, а також внаслідок перфорації каверни або субплеврально розташованих вогнищ. Може ускладнюватися утворенням бронхіальної або торакальної нориці й набувати зрештою хронічного перебігу. Хронічна емпієма характеризується хвилеподібним перебігом. Морфологічні зміни в плеврі проявляються рубцюванням, розвитком специфічної грануляційної тканини у товщі плеври, що втратила свою функцію.
Туберкульоз бронхів, трахеї, верхніх дихальних шляхів та ін. (носа, порожнини рота, глотки) — усі ці локалізації туберкульозу зустрічаються як ускладнення клінічного перебігу інших форм первинного і вторинного туберкульозу легень і внутрішньогрудних лімфатичних вузлів, лише іноді ці ураження, особливо туберкульоз бронхів, бувають ізольованими. Розрізняють три основні форми туберкульозу бронхів та трахеї:
З ускладнень можливі стенози різного ступеня, грануляції, бронхоліти (бронхіальні камені). У результаті лікування може настати клінічне видужання — без залишкових змін та із залишковими змінами у вигляді рубців, фіброзних потовщень, стенозу тощо.
Туберкульоз органів дихання, комбінований з пиловими професійними захворюваннями легень (коніотуберкульоз) — сюди належать усі форми туберкульозу легень, що перебігають у поєднанні з пиловими професійними хворобами: силікозом, асбестозом тощо. Силікотуберкульоз являє собою не просте поєднання двох хвороб, а самостійну нозологічну форму. Частота ускладнення силікозу туберкульозом різна і залежить від агресивності пилу, вираженості та форми фіброзу. У хворих на силікоз I стадії туберкульоз виявляється в 10–20 % випадків, II стадії — в 20–60 %, у III стадії — у 60–80 %. Хворіють на силікотуберкульоз переважно люди віком 30–40 років, які працюють на силікозонебезпечних підприємствах (рудники металодобування з великим вмістом кремнію, виробництва, пов'язані з використанням піскоструминників тощо).
Міліарний туберкульоз легень — гематогенна, майже завжди генералізована форма туберкульозу, що характеризується рівномірним густим засівом легень дрібними, як просяне зерно, туберкульозними горбиками. Він буває переважно генералізованим з утворенням вогнищ у легенях, печінці, селезінці, кишечнику, мозкових оболонах. Рідше зустрічається як ураження виключно легень. За клінічним перебігом виділяють:
При рентгенологічному дослідженні виявляється густа однотипна дисемінація у вигляді дрібних вогнищ, розташованих частіше симетрично і помітних краще на рентгенограмі.
У 15—20 % активних випадків інфекція розповсюджується за межі органів дихання, що викликає інші види туберкульозу.[86] Туберкульоз за межами органів дихання називають «екстрапульмонарним туберкульозом».[87] Позалегеневий туберкульоз найчастіше виникає в осіб із пригніченим імунітетом і у маленьких дітей, більш ніж у 50 % людей із ВІЛ.[87]
Туберкульозний менінгіт розвивається через гематогенне поширення або прорив казеозного вогнища мозку в субарахноїдальний простір, рідше — є наслідком переходу процесу з інших органів. Процес формується переважно на основі мозку, поширюючись за ходом судин і борозен великих півкуль. Характерні розлади мікроциркуляції крові та лімфи, підвищення внутрішньочерепного тиску, гідроцефалія, набряк, інфаркти мозку.
Клінічні прояви включають загальні явища (роздратованість, втомлюваність, пригнічення активності, головний біль та ін.) і неврологічних ознак (менінгеальні симптоми), а також локальні неврологічні симптоми, аж до церебральної ригідності. Поширення збудника на оболони спинного мозку призводить до розвитку спінального арахноїдиту з характерними неврологічними розладами.
Туберкульома мозку формується як осумковане вогнище казеозного некрозу, в субкортикальних відділах тканини головного мозку, характеризується підвищенням внутрішньочерепного тиску і локальними неврологічними порушеннями.
Туберкульозна енцефалопатія належить до групи туберкульозно-алергічних проявів. Зустрічається в дітей і підлітків. У клінічному перебігу головними симптомами виступають розлади свідомості та кома.
Туберкульоз кишечнику частіше локалізується в ілеоцекальній ділянці, йому притаманні горбкуваті висипання на слизовій оболонці кишки. Спочатку перебігає малосимптомно. Інфільтративно-виразковий процес характеризується злиттям горбиків з утворенням виразок. Клінічно тоді проявляється диспепсією з переважанням діареї. При стриктурі кишки розвивається часткова кишкова непрохідність. Процес поширюється як на нові відділи, так і в глибину з казеозно-некротичним і виразковим ураженням усіх шарів кишкової стінки. З'являється біль, що локалізується в ділянці ураження кишки, диспепсія, формування запального конгломерату (обмеженого перитоніту), кишкова кровотеча, кишкова непрохідність. Найтяжче ускладнення — перфорація виразки кишки з розвитком розлитого перитоніту.
Туберкульоз очеревини має гематогенний генез, рідше є ускладненням локальних форм лімфаденіту, туберкульозу інших органів черевної порожнини і таза. У початковому періоді утворюються горбкуваті висипання на очеревині. Клінічні ознаки не є виразними, відсутня інтоксикація. Надалі з появою ексудату прогресують явища інтоксикації, диспепсія, втрата маси тіла. При адгезивній формі — явища інтоксикації, диспепсія, розвиток часткової кишкової непрохідності. Вузлуватопухлинна форма має перебіг з вираженою інтоксикацією, формуванням конгломератів у черевній порожнині із спаяних петель кишок, сальника, осумкованого ексудату із проявами часткової кишкової непрохідності.
Туберкульоз брижових лімфатичних вузлів у інфільтративній фазі характеризується запальною інфільтрацією мезентеріальних лімфатичних вузлів без виражених перифокальних явищ і проявів інтоксикації. У казеозно-некротичній фазі відбувається збільшення лімфатичних вузлів, перифокальна реакція, залучення до процесу очеревини.
Туберкульоз кісток і суглобів хребта:
Туберкульоз кісток і суглобів кінцівок:
Туберкульоз плоских кісток, суглобів таза і грудної клітки при первинному ураженні процес виникає, як правило, в губчастій речовині кістки і розвивається за типом «первинного» туберкульозного оститу з утворенням секвестрів і нориць. Туберкульоз ребра і ключиці проявляється спочатку характерним здуттям кістки.
Туберкульоз кісток і суглобів черепа й обличчя — найчастіше уражається лобова, тім'яна, вилична кістки і верхня щелепа. При ураженні кісток черепа відбувається обмежена і розлита форми деструкції з переважним ураженням внутрішньої пластинки.
Туберкульозно-алергічні синовіїти й артрити є результатом неспецифічних алергічних уражень синовіальної оболонки суглоба; проявляються випотом у суглоби, порушенням функції, характеризуються стійким хвилеподібним клінічним перебігом з ремісіями і загостреннями, часто сезонного характеру. Ці ураження пов'язані з віддаленими, часто прихованими вогнищами туберкульозного процесу, що призводять до антигенної стимуляції й алергізації організму.
Туберкульоз нирок на початковій стадії пов'язаний з гематогенним поширенням збудника з активних вогнищ первинного чи вторинного туберкульозного характеру в інших органах. Розвиток специфічного процесу проходить усі етапи — від гематогенних вогнищ, оточених елементами туберкульозної гранульоми і казеозним некрозом у центрі, що зливаються в обмежені інфільтрати (казеоми) з переважною локалізацією в кірковій речовині нирки, до повного руйнування нирки і сечовивідних шляхів. Кавернозному ураженню нирки притаманний прорив і спорожнення через ниркову миску казеозного некрозу з формуванням порожнини, стінки якої мають усі характерні ознаки каверни. Деструктивні й фіброзно-склеротичні процеси, які йдуть разом, сприяють поширенню процесу з прогресуючим руйнуванням паренхіми і системи порожнин нирок (полікаверноз, рубцеві стенози тощо) з подальшим переходом у фіброзно-кавернозне ураження. Кінцева стадія прогресуючого туберкульозу нирки характеризується тотальним її ураженням з формуванням піонефрозу, виникненням низки місцевих і системних ускладнень.
Туберкульоз сечовивідних шляхів зазвичай проявляється як супутнє ураження або ускладнення туберкульозу нирки. Характер процесу визначається поширеністю, глибиною ураження стінок сечовивідних шляхів: від вогнищевого запалення слизової оболонки та підслизового шару на початковому етапі до глибокого виразково-некротичного деструктивного ураження з переходом у фіброз, формуванням рубцевих деформацій і стриктур.
Туберкульоз чоловічих статевих органів має подвійний патогенез: як окрема форма гематогенного туберкульозу і як вторинне ускладнення туберкульозу нирок та сечовивідних шляхів.
Туберкульоз жіночих статевих органів виявляється у вигляді ураження маткових труб (сальпінгіт), придатків матки (сальпінгоофорит), внутрішніх статевих органів з переходом процесу з придатків на тіло матки (ураження м'язової стінки матки може виникати паралельно з ураженням слизової порожнини матки), зовнішніх статевих органів.
До первинних форм належить «первинний афект», що виникає в разі інфікування через шкіру. До цієї групи відносять гострий міліарний туберкульоз шкіри і первинну гематогенну скрофулодерму, а також вторинну скрофулодерму (при туберкульозі периферичних лімфатичних вузлів). До вторинних форм туберкульозу шкіри належить хронічний прогресуючий туберкульоз (туберкульозний вовчак) у різних варіантах. Він частіше локалізується в ділянці облямівки верхньої губи, носа, далі переходить на порожнину рота (зрідка буває і зворотне поширення) в ділянці різців та іклів. При вовчаковому виразковому ураженні може відбуватися руйнування кістки альвеолярного відростка, що призводить до розхитування і зміщення зубів. При цьому альвеолярний відросток взагалі зникає, зуби випадають, а під час рубцювання може відбуватися зрощення слизової оболонки верхньої губи і піднебіння.
Туберкульоз периферичних лімфатичних вузлів
Процес може закінчуватися розвитком фіброзу або звапненням лімфатичних вузлів.
Найбільш поширеною формою цього виду ураження є гематогенно-дисемінований увеїт, при цьому виділяють:
Туберкульозні ураження придаткового апарату ока бувають значно рідше, виникають через гематогенну дисемінацію або поширення з шкіри обличчя і, як виняток, шляхом екзогенного інфікування. Туберкульозно-алергічним ураженням очей притаманний рецидивуючий клінічний перебіг з гострим початком кожного рецидиву, який перебігає бурхливо і відносно недовго. Розрізняють такі варіанти:
Всі інші туберкульозні ураження (печінки, селезінки, надниркових залоз, серцевого м'яза, перикарда тощо) зустрічаються рідкісно. Вкрай рідкісно туберкульозна бактерія може уразити легеневу артерію, що приводить до значної кровотечі, яку називають аневризмою Расмуссена.

Діагностувати активний туберкульоз лише на основі ознак і симптомів складно[88], особливо у випадках пригніченого імунітету[89]. Пацієнти з ознаками хвороби легенів або системними симптомами, що тривають довше двох тижнів, можуть мати туберкульоз[89].
Виявити туберкульозне ураження легень дає можливість рентгенологічне обстеження — рентгенографія у прямій і боковій проєкціях. З метою виявлення туберкульозу під час профілактичних оглядів використовується крупнокадрова флюорографія. Найбільш ефективною є комп'ютерна томографія, що може виявити маленькі за розміром вогнища, встановити стадію процесу і поширеність. Вона здатна виявити ураження і при інших позалегеневих локалізаціях.
У крові хворих на туберкульоз виражених змін не визначається. Гіпохромна анемія спостерігається лише у хворих з поширеним процесом і вираженою інтоксикацією або при повторних легеневих кровотечах. Зміни кількості лейкоцитів і лейкоцитарної формули крові відбуваються повною мірою при гострих процесах і розпаді легеневої тканини. Можуть спостерігатися: помірний лейкоцитоз, зрушення лейкоцитарної формули вліво, лімфопенія, моноцитоз. ШОЕ прискорюється за активного туберкульозного процесу. Біохімічні методи дозволяють оцінити стан систем гуморальної регуляції й окремих ланок обмінних процесів, функціональність ендокринних і паренхіматозних органів. Для оцінки наявності та гостроти запального процесу до комплексу досліджень включають визначення кількості гаптоглобіну, церулоплазміну, С-реактивного білка.
Традиційними методами виявлення мікобактерій у патологічному матеріалі є бактеріоскопічний, бактеріологічний і біологічний методи. Крім харкотиння, об'єктами дослідження можуть бути також сеча, кал, спинномозкова рідина, ексудат з порожнин, гній, виділення з ран, біоптати різних тканин.
Виявлення мікобактерій у різному патологічному матеріалі від хворих має вирішальне значення для встановлення діагнозу. Саме виявлення збудника — основний і безперечний критерій, що свідчить про специфічну природу захворювання.
Пряма бактеріоскопія Одним з основних методів виявлення збудників є бактеріоскопічний. Суть методу полягає у здатності мікобактерій, які забарвлені фуксином, утримувати барвник після тривалого знебарвлення в солянокислому спирті. У багатьох країнах він широко застосовується й для виявлення хворих на туберкульоз при масових обстеженнях населення.
При прямій бактеріоскопії препарат забарвлюють за методом Ціля — Нільсена. МБТ забарвлюються у червоний, а навколишній фон і некислотостійкі мікроорганізми — у синій колір. Для виявлення бактеріоскопічним методом МБТ у препараті необхідно, щоб у 1 мл харкотиння містилося не менше 100 000 мікробних тіл. При меншій кількості мікобактерій дослідження може дати неправдивий негативний результат.
Виявлення бактеріоскопічним методом МБТ збільшується на 14–20 % при застосуванні люмінесцентної мікроскопії. Для забарвлення препарату використовують флюорохроми — органічні барвники, що флюоресціюють при освітленні ультрафіолетовими, фіолетовими або синіми променями. Такими барвниками є аурамін 00, родамін С. Мазок харкотиння забарвлюють сумішшю 0,05 г аураміну і 1000 мл дистильованої води, злегка підігрівають, промивають водою, знебарвлюють 3%-м хлороводневокислим спиртом, знову промивають і наносять метиленовий синій на 1–2 хв. Препарат досліджують за допомогою люмінесцентного мікроскопа. МБТ світяться золотисто-жовтим кольором на темному фоні.
Для збільшення кількості МБТ в одиниці досліджуваного об'єму харкотиння використовують методи флотації й седиментації. Сутність методу флотації ґрунтується на тому, що при струшуванні двох рідин з різною відносною густиною легша рідина спливає наверх разом із МБТ, що перебувають у суспензії. Для цього дослідження 10–15 мл харкотиння вміщують у колбу місткістю 200—250 мл, додають 2–3 мл 0,5%-го розчину лугу і струшують протягом 10–15 хвилин, поки харкотиння не стане гомогенним. Щоб досягти повної гомогенізації, колбу з харкотинням підігрівають протягом 20–30 хвилин на водяній бані при температурі 56 °С. Далі у колбу вливають близько 100 мл дистильованої води і 0,5 мл ксилолу або бензолу і знову струшують упродовж 10 хвилин. Далі доливають дистильовану воду до шийки пляшки і залишають стояти при кімнатній температурі близько 30 хвилин. На поверхню рідини піднімається вершкоподібна піна, яку піпеткою відсмоктують і наносять на предметне скло. Шар піни на предметному склі висушують і наносять новий шар піни з колби. Так роблять 5–6 разів, після чого мазок фіксують і забарвлюють за Цилем — Нільсеном.
Бактеріологічний метод Виявлення МБТ цим методом полягає в посіві харкотиння на поживні середовища. Перед посівом харкотиння обробляють з метою пригнічення росту неспецифічної мікрофлори. Стандартним поживним середовищем для вирощування МБТ є тверде яєчне середовище Левенштейна — Єнсена. Останніми роками широке застосування одержало яєчне середовище II. Існують також напіврідкі та рідкі поживні середовища. Ріст культури відбувається протягом 14–90 днів.
Для виділення культури МБТ достатньо 20–100 мікробних тіл в 1 мл харкотиння. Обов'язково визначають чутливість МБТ до хіміопрепаратів. Для швидкого встановлення резистентності до ліків використовується поживне середовище Попеску, яке містить KNO3. Чутливість до хіміопрепаратів може визначатися як до окремих протитуберкульозних препаратів, так і до їхніх комбінацій. Нерідко виявлені при бактеріоскопії МБТ не ростуть на поживних середовищах внаслідок втрати здатності до розмноження під впливом протитуберкульозних препаратів.
Чутливість вищевказаних методів при діагностиці позалегеневих форм туберкульозу помітно знизилася. За останні десятиліття в багатьох країнах світу бактеріологічні методи суттєво удосконалено. Запропоновано автоматичні аналізатори бактеріологічних культур, в яких використовуються рідкі селективні поживні середовища. Метод базується на реєстрації CO2, який виділяють життєздатні мікобактерії. Ці аналізатори дозволяють отримати позитивний результат аналізу на патогенні мікобактерії на 12-й день, а негативний результат на 21-й день.
Харкотинням пацієнтів заражають морських свинок, що мають високу чутливість до МБТ. Наразі цей метод з успіхом застосовується для виявлення не тільки типових незмінених, але й різноманітних біологічно змінених форм мікобактерій, зокрема L-трансформованих і фільтрівних форм; для визначення видової приналежності МБТ, їхньої вірулентності, вивченні патогенності атипових культур.
Приблизно через місяць після інфікування у свинки виникає лімфоаденопатія і розвивається генералізований процес. Серед традиційних методів діагностики туберкульозу біологічний метод до останнього часу вважався найбільш чутливим, тому що туберкульоз у морських свинок може виникнути при введенні харкотиння, що містить менше, ніж 5 мікробних тіл у 1 мл. Сьогодні доведена можливість втрати МБТ вірулентності. Такі мікобактерії здатні рости на поживних середовищах, але не в змозі спричинити хворобу експериментальних тварин. Тому для виявлення МБТ слід використовувати різні методи мікробіологічного дослідження.
На облік як бактеріовиділювачів беруть хворих з легеневим туберкульозом, в харкотинні яких знайдені МБТ культуральним або молекулярно-генетичним методами (вперше в житті або після успішного лікування). Пацієнти, у яких МБТ виявлені будь-яким методом дослідження (навіть одноразово) у разі наявності клініко-рентгенологічних ознак активності туберкульозного процесу, а також хворі зі згасаючим активним туберкульозом чи з туберкульозними змінами невизначеної активності, вважаються бактеріовиділювачами. Хворі, у яких МБТ виявлені двічі будь-яким культуральним методом дослідження, хай за відсутності рентгенологічних туберкульозних змін у легенях, вважаються бактеріовиділювачами.
Використовують високочутливі методи ДНК-зондування та полімеразно-ланцюгової реакції (ПЛР). Вони дозволяють виявити мікобактерії в діагностичному матеріалі через 2–4 доби з максимально високою чутливістю (10–1000 клітин в досліджуваній пробі), а також ідентифікувати тип мікобактерій. Актуальність цих методів у діагностиці туберкульозу полягає в їх ефективності при виявленні збудників з високою антигенною мінливістю (у тому числі L-форм). Їх виявлення потребує тривалого культивування або складних поживних середовищ. Крім цього, ці методи перспективні при проведенні міжвидової та штамової ідентифікації мікобактерій для диференціації туберкульозних та нетуберкульозних мікобактерій, для експрес-виявлення лікарської стійкості мікобактерій.
Використання швидкого тесту Xpert MTB / RIF® значно розширилося з 2010 року, коли ВООЗ вперше рекомендувала його використання. Тест одночасно виявляє туберкульоз і стійкість до рифампіцину — одного з основних протитуберкульозних препаратів. Діагноз може бути встановлений протягом 2 годин, і цей тест наразі рекомендується ВООЗ як початковий діагностичний у всіх людей з ознаками можливого туберкульозу. Понад 100 країн вже використовують цей тест, а в 2016 році закуплено 6,9 мільйона картриджів. У 2016 році ВООЗ рекомендувала 4 нові діагностичні тести — швидкий молекулярний тест для виявлення препаратів першої та другої лінії лікування туберкульозу. Особливо важко діагностувати туберкульоз у дітей, і наразі широкий доступ до Xpert MTB / RIF® допомагає діагностиці дитячого туберкульозу.[33].
Серологія крові не є специфічною та достатньо чутливою при туберкульозі, тому виявлення антитіл в діагностиці туберкульозу не рекомендується.[90]

Туберкулінова проба на шкірі часто дозволяє виявити людей з високим ризиком розвитку туберкульозу.[89] У людей, яким раніше проводили імунізацію, позитивна реакція на туберкулін не завжди свідчить про інфікування.[91] Негативну пробу у хворих на туберкульоз спостерігають, якщо вони хворіють на саркоїдоз, лімфогранулематоз та недоїдання. Але найголовніше, що результати проби можуть бути негативними у людей, дійсно хворих на туберкульоз.[27] Людям з позитивною реакцією Манту необхідно зробити аналіз крові на наявність гамма-інтерферону (IGRA).[92] Вакцинація чи мікобактерії навколишнього середовища не впливають на IGRA, тому існує менша імовірність, що результати аналізу будуть позитивними у здорових людей.[93] Однак на результати IGRA впливають мікобактерії M. szulgai, M. marinum та M. Kansasii.[94] Результати IGRA є більш точними разом із пробою на реакцію шкіри. Однак при проведенні IGRA та проби на реакцію шкіри окремо результати проби на реакцію шкіри будуть більш точними.[95] Наразі вирішено, що проведення реакції Манту усім людям не є доцільним, через що рекомендується застосування цього методу окремим категоріям.
З метою виявлення прихованої реактивності туберкульозного процесу проводиться білково-туберкулінова проба. За наявності прихованої активності під впливом туберкуліну запалення у вогнищах активується, що відображується у збільшенні кількості альфа-2-глобулінової фракції. Проба є позитивною при збільшенні альфа-2-глобулінів більше ніж на 10 % від вихідного рівня.
Основні елементи характеристики туберкульозного процесу:
Локалізація і поширеність визначаються в легенях за частками або сегментами із зазначенням їх у діагнозі. В інших органах і системах вказується локалізація ураження (наприклад, туберкульоз верхнього сегмента лівої нирки, туберкульоз маткових труб, фліктенульозний кератокон'юнктивіт лівого ока тощо) відповідно до анатомічних назв.
Фази процесу:
До 1-ї категорії належать хворі на вперше діагностований туберкульоз різної локалізації з бактеріовиділенням, а також хворі з іншими (тяжкими) формами захворювання різних локалізацій без бактеріовиділення: міліарним, дисемінованим, деструктивним легеневим (при поодиноких кавернах понад 3 см або за наявності більш ніж 3-х каверн меншого розміру); менінгітом, казеозною пневмонією, перикардитом, перитонітом, туберкульозом кишківника, хребта з неврологічними ускладненнями, урогенітальним, внутрішньогрудних лімфовузлів з ураженням більше ніж 2-х груп з однієї сторони або 2-х і більше груп з обох сторін.
До 2-ї категорії відносяться будь-які випадки раніше лікованого легеневого і позалегеневого туберкульозу, які реєструють для повторного лікування: рецидив туберкульозу різної локалізації; пацієнти, що лікуються після невдалого попереднього лікування та пацієнти, що відновили лікування після того, як вони вважалися такими, що вибули з-під нагляду.
До 3-ї категорії належать хворі з новими випадками туберкульозу без бактеріовиділення, яких не віднесено до 1-ї категорії.
Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Згідно зі стратегією лікування туберкульозу в Україні відбулась зміна парадигми пріоритетності багатомісячного стаціонарного лікування на так звану «DOTS-стратегію» — контрольоване амбулаторне лікування в «DOT-кабінеті» денного стаціонару або вдома за участі патронажної медичної сестри або куратора, навіть при продовженні виділення збудника туберкульозу в харкотинні, за умови наявності окремої кімнати і відсутності в родині пацієнта дітей до 18 років.
Для лікування туберкульозу використовують антибіотики, щоб нейтралізувати бактерії. Через незвичайну структуру та хімічний склад стінки клітини мікобактерії важко підібрати ефективне лікування туберкульозу. Стінка клітини не пропускає антибіотики усередину, внаслідок чого антибіотики стають неефективними.[96] Ізоніазид та рифампіцин — це два антибіотики, які призначають хворим найчастіше; таке лікування може тривати протягом кількох місяців.[67] Пацієнтам з латентним туберкульозом прописують тільки один з антибіотиків.[97] Для лікування активної форми туберкульозу краще використовувати кілька антибіотиків, щоб зменшити ризик виникнення у бактерії резистентності до антибіотиків.[31] Люди з латентним туберкульозом також потребують лікування, щоб у подальшому запобігти розвитку активної форми хвороби.[97] ВООЗ рекомендує лікування під безпосереднім наглядом. Згідно з таким методом лікування відповідальний лікар слідкує за тим, щоб хворий приймав призначені йому ліки. Метою такого лікування є зменшення кількості людей, які не приймають антибіотики належним чином.[98] Хоча, як показала практика, ефективність лікування під безпосереднім наглядом не дуже значна.[99] Ефективними є методи, що нагадують людям про важливість лікування.[100]
Станом на 2010 рік рекомендованим лікуванням тільки-но виявленого туберкульозу легень є призначення декількох антибіотиків протягом шести місяців. Рифампіцин, ізоніазид, піразинамід та етамбутол призначають на перші два місяці. В останні чотири місяці слід приймати лише рифампіцин та ізоніазид.[31] Якщо стійкість до ізоніазиду висока, то замість нього в останні чотири місяці можна приймати етамбутол.[31]
Якщо туберкульоз з'явився знову, то перед призначенням лікування необхідно зробити аналізи для виявлення антибіотиків, які на нього діють.[31] Якщо аналізи встановили наявність мультирезистентного туберкульозу (MDR-TB), то необхідно призначити не менше чотирьох ефективних антибіотиків, які треба приймати протягом 18-24 місяців.[31]
Первинна резистентність до ліків виникає, коли людина заражається стійким до ліків штамом туберкульозу. У людини, у якої немає резистентності до ліків, протягом лікування може розвинутися вторинна (набута) резистентність. Остання може розвинутися через невідповідне та неадекватне лікування, недотримання належним чином призначеного режиму, передчасне припинення вживання препаратів або вживання неякісних лікарських засобів.[101] Резистентний туберкульоз є серйозною проблемою охорони здоров'я населення у багатьох країнах, що розвиваються. Лікування такого туберкульозу займає більше часу та потребує більш дорогих ліків.
Випадки резистентності класифікуються за категоріями відповідно до тестів медикаментозної чутливості штамів виявлених M. tuberculosis.
Більше 35 країн Африки та Азії почали використовувати більш короткі режими лікування мультирезистентного туберкульозу. До червня 2017 року 89 країн запровадили бетаквілін, а 54 країни — деламанід, щоб поліпшити ефективність режиму лікування цього різновиду туберкульозу[33].
Повністю нечутливий до ліків туберкульоз є стійким до всіх наявних протитуберкульозних препаратів. Вперше випадок захворювання на туберкульоз штаму TDR-TB (невиліковний туберкульоз) було зафіксовано в Італії у 2003 році, але до 2012 року широкому загалу про цей випадок нічого не було відомо.[102]
Згідно з новими визначеннями результатів лікування пацієнти поділяються на два типи:
Туберкульозна інфекція розвивається у відкриту форму туберкульозу, коли бацили долають захист імунної системи та починають розмножуватись. У початковій формі туберкульозу (у 1-5 % випадків) вона розвивається невдовзі після первинного інфікування.[27] Однак у більшості випадків латентна інфекція не має очевидних проявів.[27] Бацили, які перебувають у «сплячому» стані, викликають активний туберкульоз у 5—10 % випадках латентного туберкульозу, часто це відбувається через декілька років після зараження.[103]
Ризик рецидиву хвороби зростає унаслідок імунодепресії, наприклад, викликаної ВІЛ-інфекцією. У людей, інфікованих одразу туберкульозною паличкою та ВІЛ, ризик рецидиву збільшується до 10 % на рік.[27] Дослідження, які використовують «відбитки штамів» туберкульозної палички, показали, що повторне зараження викликає рецидиви туберкульозу частіше, ніж вважалося раніше.[104] У країнах, де туберкульоз є поширеним, повторене зараження є причиною рецидиву хвороби у понад 50 % випадків.[105] Ймовірність смерті від туберкульозу у 2008 році складала близько 4 %, порівняно з 8 % 1995 року.[31]
Для запобігання та контролю туберкульозу у дітей необхідно робити щеплення, вчасно виявляти випадки захворювання та надавати необхідне лікування.[31] Всесвітня організація охорони здоров'я (ВООЗ) досягла певних успіхів у поліпшенні методів лікування. Було зафіксоване невелике зменшення випадків на захворювання туберкульозом.[31]
Станом на 2011 рік єдиною наявною вакциною була БЦЖ. БЦЖ є ефективною для запобігання дисемінованого ураження у дітей, але вона не є надійним захисником від туберкульозу.[106] Тим не менш БЦЖ використовують в усьому світі частіше, ніж інші вакцини; більш ніж 90 % дітей проходять щеплення саме цією вакциною.[31] Однак імунітет до захворювання, який створює вакцина, через 10 років починає слабшати.[31] Туберкульоз не є поширеним на більшості територій Канади, Великої Британії та Сполучених Штатів, тому щеплення роблять тільки людям з високим ризиком захворювання.[107][108][109] Через цю вакцину результати туберкулінової проби можуть бути позитивними у здорової людини, що робить цю пробу непридатною для виявлення хвороби, і це є головною причиною, з якої щеплення нею не роблять.[109] Нові вакцини знаходяться у стадії розробки.[31]

Туберкульоз супроводжував людство ще з античних часів.[31] Вперше про беззаперечне виявлення M. tuberculosis було повідомлено ще приблизно 17 000 років тому, коли у залишках бізона було знайдено ознаки хвороби.[110] Однак до кінця незрозуміло, чи туберкульоз вперше з'явився у тварин, а потім перейшов до людей, чи він поширювався єдиним збудником.[111] Науковці навіть висловлювали думку, що люди отримали сукупність мікобактерій туберкульозу від тварин під час їх одомашнювання. Однак гени сукупності мікобактерій туберкульозу людини були порівняні з генами збудників у тварин, і ця теорія виявилася помилковою. Обидва види мають єдиного предка, який міг інфікувати людей ще за часів неолітичної революції.[112] Залишки кісток вказують на те, що доісторичні люди (4 000 рік до н. е.) хворіли на туберкульоз. Дослідники знайшли туберкульозну інфекцію у залишках єгипетської мумії, датованої 3000—2400 роками до н. е.[113] У перекладі з грецької слово «фтізіс» означає «чахотка», у давні часи цей термін використовували для визначення туберкульозу легень.[114] Приблизно у 460 році до н. е. Гіппократ визначив туберкульоз легень як найбільш поширену хворобу того часу. У людей, хворих на туберкульоз легенів, був жар та вони кашляли кров'ю. Люди з таким захворюванням майже завжди помирали.[115] Генетичні дослідження показали, що на американському континенті на туберкульоз люди хворіли приблизно з 100 року н. е.[116]
До промислової революції у фольклорі туберкульоз часто пов'язували з вампірами. Якщо один із членів сімейства помирав від цієї хвороби, інші інфіковані члени родини мали б повільно втрачати здоров'я. Люди вважали, що людина, яка перша захворіла на туберкульоз, забирала життя в інших членів сім'ї.[117]
У 1689 році д-р Річард Мортон встановив, що коли в легенях виявляються бугорки (туберкули), то це результат захворюванням.[118][119] Однак туберкульоз мав багато симптомів, тому до 1820-х рр. його не визнавали як єдину хворобу. У 1839 році Й. Л. Шенлейн вперше назвав цю хворобу туберкульозом.[120] Упродовж 1838—1845 рр. д-р Джон Кроган, власник Мамонтової печери, поселяв людей, хворих на туберкульоз, у печеру з надією вилікувати хворобу за допомогою постійної температури та чистого печерного повітря: але протягом року усі вони помирали.[121] У 1859 році Герман Бремер відкрив перший туберкульозний санаторій у Соколовсько в Польщі.[122]

24 березня 1882 року Роберт Кох виявив та описав бактерії Mycobacterium tuberculosis, які спричинюють туберкульоз. За це відкриття у 1905 році він отримав Нобелівську премію з фізіології та медицини.[123] Кох не вважав, що тварини (велика рогата худоба) та люди хворіли на один і той самий туберкульоз. Така думка призвела до запізненого визнання того, що інфіковане молоко було джерелом інфекції. Пізніше, коли був винайдений процес пастеризації, ризик передачі інфекції з такого джерела значно зменшився. У 1890 році Кох повідомив, що екстракт гліцерину туберкулінової бактерії є ліками проти туберкульозу. Він назвав їх «туберкуліном». Хоча лікування туберкуліном не мало жодного ефекту, натомість його почали використовувати як тест для виявлення туберкульозу легень.[124]
У 1906 році Альбер Кальметт та Каміль Герен досягли перших успіхів в імунізації проти туберкульозу. Вони використовували ослаблений штам збудника туберкульозу великої рогатої худоби, ця вакцина була названа вакциною БЦЖ. У 1921 році у Франції вперше випробували її на людях,[125] однак лише після Другої світової війни вакцина БЦЖ почала широко поширюватися тільки у США, Великій Британії та Німеччині.[126]
У XIX та на початку XX століття туберкульоз став найбільш поширеною соціальною проблемою, яку назвали епідемією бідних верств населення. У 1815 році у Великій Британії кожна четверта особа помирала через туберкульоз легень. До 1918 року у Франції кожна шоста особа помирала через туберкульоз. Після того як у 1880-х рр. науковці встановили, що туберкульоз є заразною хворобою, у Великій Британії його внесли до хвороб, які підлягають реєстрації. Було розпочато кампанії, які не дозволяли людям плювати у громадських місцях, бідних інфікованих людей «заохочували» їхати до санаторіїв, які нагадували в'язниці. (У санаторіях для середнього та вищого класів проте пропонувався чудовий догляд та постійна медична допомога.)[122] У таких санаторіях нібито пропонували переваги «свіжого повітря» та можливості працевлаштування. Але навіть за найсприятливіших умов 50 % людей у санаторіях помирали впродовж п'яти років (приблизно у 1916 році).[122]
В Європі рівень захворюваності на туберкульоз почав зростати на початку 1600-х рр. Найвищого рівня там туберкульоз досягнув у 1800-х рр., коли серед усіх випадків смерті від туберкульозу помирало 25 % людей.[127] Після того до 1950-х рр. рівень смертності знизився до 90 %.[128] Удосконалення в галузі охорони здоров'я значно зменшили рівень захворюваності на туберкульоз, навіть до того, як почали використовувати стрептоміцин та інші антибіотики. Однак туберкульоз залишався значною загрозою для здоров'я суспільства. Коли у 1913 році у Великій Британії було створено Раду з медичних досліджень, дослідження туберкульозу було її головною метою.[129]
1946 року, завдяки винаходу антибіотика стрептоміцин, ефективне лікування та ліки проти туберкульозу стали дійсністю. До винаходу цих ліків, єдиним методом лікування хвороби (окрім санаторіїв) було застосування методу штучного пневмотораксу, що дозволяло «відпочити» ураженій легені, а туберкульозному ураженню загоїтися.[130] Через появу штаму MDR-TB хірургічне втручання знову стало прийнятим методом лікування туберкульозу. Наразі під час хірургічних втручань видаляють патологічні порожнини («пухирі») у легенях, щоби зменшити кількість бактерій[131] Хоча експерти сподівалися повністю подолати туберкульоз (як здолано натуральну віспу), через появу резистентних до лікарських засобів штамів у 1980-х рр. таке подолання туберкульозу стало малоймовірним. Через подальше зростання туберкульозу у 1993 році ВООЗ довелось оголосити туберкульоз глобальною загрозою для здоров'я.[132]
Всесвітня організація охорони здоров'я та Фонд Білла і Мелінди Гейтс фінансують новий швидкодіючий діагностичний аналіз для використання в країнах з низьким і середнім рівнем доходу.[133][134] Станом на 2011 рік у багатьох бідних країнах досі використовують тільки мікроскопічне дослідження мокротиння.[135]
У 2010 році в Індії було зафіксовано найбільшу кількість захворювань на туберкульоз у світі. Однією з причин було неналежне лікування хвороби з боку приватного сектора охорони здоров'я. Такі програми, як «Переглянута програма боротьби з туберкульозом», допомагають зменшити рівень захворюваності на туберкульоз серед людей, які отримують допомогу у громадських установах охорони здоров'я.[136][137]
У вакцини БЦЖ є багато обмежень, тому дослідження з винаходу нової вакцини від туберкульозу продовжуються.[138] Кілька потенційних вакцин на цей момент знаходяться на стадії першої та другої фази клінічних випробувань.[138] Існує два основні способи поліпшення ефективності наявних вакцин. Перший полягає у додаванні субодиниці вакцини до БЦЖ. Іншим способом є винахід нової та кращої живої вакцини.[138] MVA85A є прикладом субодиниці вакцини, яка зараз проходить випробування у Південній Африці. Вакцина MVA85A створена на основі генетично модифікованого вірусу вакцини проти натуральної віспи.[139] Є надія на те, що вакцини будуть відігравати важливу роль у лікуванні латентної та активної хвороби.[140]
Щоб стимулювати подальші відкриття, дослідники та політики підтримують нові економічні моделі для розроблення вакцин, які полягають в отриманні нагород, податкових пільг та зобов'язань майбутніх закупівель.[141][142] Декілька груп займаються розробками, в тому числі Товариство подолання туберкульозу,[143] Південно-Африканська програма з розробки вакцини від туберкульозу та Всесвітній фонд «Аерас» з розробки вакцини від туберкульозу.[144] Всесвітній фонд «Аерас» з розробки вакцини від туберкульозу отримав пожертвування від Фонду Білла і Мелінди Гейтс у розмірі 280 мільйонів доларів США для розробки та реєстрації поліпшеної вакцини від туберкульозу для застосування у країнах з високим рівнем захворюваності.[145][146] World Community Grid проєкт розподілених обчислень, зокрема, пошуку ліків від туберкульозу.
Мікобактерії заражають різноманітних тварин, у тому числі птахів,[147] гризунів[148] та рептилій.[149] Підвид мікобактерій туберкульозу рідко вражає диких тварин.[150] Заходи, направлені на знищення туберкульозу великої рогатої худоби, спричиненого «Mycobacterium bovis» у великої рогатої худоби та стад оленів із Нової Зеландії, мали достатній успіх.[151] Заходи, проведені у Великій Британії, були не такими успішними.[152][153]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.