En İyi Sorular
Zaman Çizelgesi
Sohbet
Bakış Açıları
Enantiyoselektif sentez
Vikipedi'den, özgür ansiklopediden
Remove ads
Enantiyoselektif sentez ya da asimetrik sentez, [1] bir kimyasal sentez şeklidir. IUPAC, bir veya daha fazla yeni kiralite elementinin bir substrat molekülünde oluşturulduğu ve stereoizomerik (enantiyomerik veya diastereoizomerik) ürünleri eşit olmayan miktarlarda üreten kimyasal reaksiyon (veya reaksiyon sekansı) olarak tanımlanır.[2]

Daha açık bir ifadeyle: bir bileşiğin, belirli bir enantiyomer veya diastereomer oluşumunu destekleyen bir yöntemle sentezidir.
Enantiyoselektif sentez, modern kimyada kilit bir işlemdir ve bir molekülün farklı enantiyomerlerinin veya diastereomerlerinin çoğu zaman farklı biyolojik aktiviteye sahip olması nedeniyle farmasötikler alanında özellikle önemlidir.
Remove ads
Genel bakış
Özetle
Bakış açısı

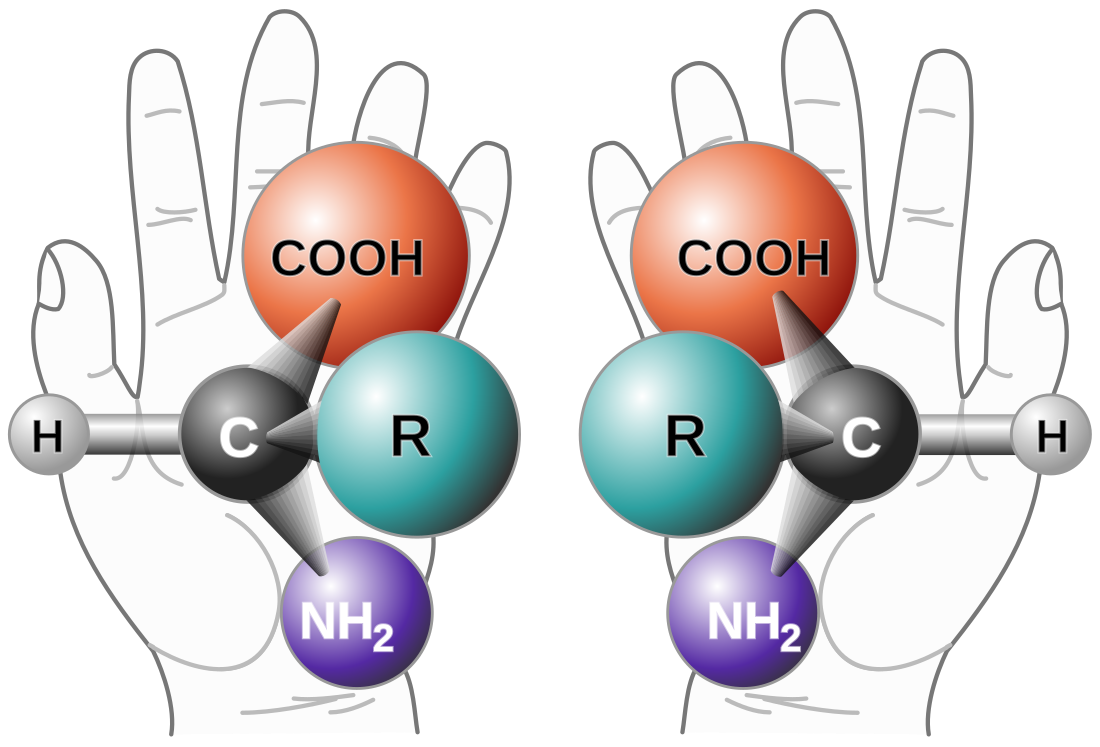
Şeker ve amino asitler gibi biyolojik sistemlerin yapı taşlarının birçoğu yalnızca bir enantiyomer olarak üretilir. Sonuç olarak, canlı sistemler yüksek derecede kimyasal kiralılığa sahiptir ve genellikle belirli bir bileşiğin çeşitli enantiyomerleriyle farklı şekilde reaksiyona girer. Bu seçiciliğe örnekler:
- Lezzet: yapay tatlandırıcı aspartamın iki enantiyomeri vardır. L- aspartam tatlıdır, D- aspartam tatsızdır.[3]
- Koku: R - (-) - carvon nane gibi kokarken, S - (+) - carvone kimyon gibi kokar.[4]
- İlaç etkinliği: antidepresan ilaç olan Citalopram rasemik bir karışım halinde satılmaktadır. Bununla birlikte, çalışmalar ilacın faydalı etkilerinden sadece (S) - (+) enantiyomerinin sorumlu olduğunu göstermiştir.[5][6]
- İlaç güvenliği: D-penisilamin şelasyon tedavisinde ve romatoid artrit tedavisinde kullanılırken, L‑penisilamin, temel bir B vitamini olan piridoksinin etkisini engellediği için toksiktir.[7]
Bu enantiyoselektif sentezin büyük önemi olduğundan, elde edilmesi de zor olabilir. Enantiyomerler, aynı entalpi ve entropilere sahiptir ve bu nedenle, rasemik bir karışıma yol açan, yönlendirilmemiş bir işlemle eşit miktarlarda üretilmelidir. Enantiyoselektif sentez, geçiş durumundaki etkileşimler yoluyla bir enantiyomerin bir diğerinin üzerinde oluşumunu destekleyen kiral bir özellik kullanılarak elde edilebilir. Bu önyargı asimetrik indüksiyon olarak bilinir ve substrat, reaktif, katalizör veya ortamdaki kiral özellikleri içerebilir [8] ve bir enantiyomeri oluşturmak için gereken aktivasyon enerjisini karşıt enantiyomerinkinden daha düşük hale getirerek çalışır.[9]
Enantioselektivite genellikle, bir enantiyomer farklılaştırıcı basamağın nispi oranları ile belirlenir - bir reaktifin iki enantiyomerik üründen biri olabileceği nokta. Bir reaksiyon için hız sabiti, k, reaksiyonun aktivasyon enerjisinin bir fonksiyonudur, bazen enerji engeli olarak adlandırılır ve sıcaklığa bağlıdır. Enerji bariyerinin Gibbs serbest enerjisini kullanarak, ΔG *, belirli bir sıcaklıkta, T, karşılıklı stereokimyasal sonuçların oranları:
Sıcaklık farklılığı oran farklılığı anlamına gelir, böylece enantiyoselektivite düşük sıcaklarda daha da büyük olarak gözlemlenir. Sonuç olarak, küçük enerji-bariyer farklılıkları bile gözle görülür bir etkiye neden olabilir.
Remove ads
Yaklaşımlar
Özetle
Bakış açısı
Enantiyoselektif kataliz
Genel olarak, enantiyoselektif kataliz (geleneksel olarak asimetrik kataliz olarak bilinir), kiral koordinasyon kompleksleridir. Kataliz, diğer enantioselektif sentez yöntemlerinden daha geniş bir dönüşüm aralığı için etkilidir. Katalizörler, kiral ligandlar kullanılarak neredeyse hiç değişmez şekilde kiral hale getirilirler (ayrıca, daha basit akiral ligandlar kullanılarak metal-kiral-metal kompleksleri üretmek de mümkündür, ancak bu tür türlerin nadiren sentetik olarak faydalı olduğu kanıtlanmıştır).[10] Çoğu enantiyoselektif katalizör, düşük substrat/katalizör oranlarında etkilidir.[11][12] Yüksek verimleri göz önüne alındığında, pahalı katalizörlerde bile endüstriyel skala sentezi için genellikle uygundurlar.[13] Çok yönlü bir enantioselektif sentez örneği, çok çeşitli fonksiyonel grupları azaltmak için kullanılan asimetrik hidrojenasyondur.
Yeni katalizörlerin tasarımına, yeni ligand sınıflarının gelişmesi büyük ölçüde egemendir. Genellikle 'imtiyazlı ligandlar' olarak adlandırılan bazı ligandların geniş bir reaksiyon aralığında etkili olduğu bulunmuştur; örnekler arasında BINOL, Salen ve BOX bulunur. Bununla birlikte, genel olarak, birkaç katalizör, birden fazla asimetrik reaksiyon tipinde etkilidir. Örneğin, BINAP/Ru ile Noyori asimetrik hidrojenasyonu, bir β-keton gerektirir, bununla birlikte başka bir katalizör olan BINAP/diamine-Ru, kapsamı a, alkenler ve aromatik kimyasallara genişletir.

Kiral yardımcılar
Bir kiral yardımcı, daha sonra intramoleküler asimetrik indüksiyon yoluyla enantioselektif reaksiyonlara girebilen yeni bir bileşik oluşturmak için başlangıç malzemesine bağlanan organik bir bileşiktir.[14][15] Reaksiyonun sonunda yardımcı ürünün rasemizasyonuna neden olmayacak koşullar altında uzaklaştırılır.[16] Genellikle daha sonra kullanmak üzere kurtarılır.

Kiral yardımcı maddeler, etkili olmak için stokiyometrik miktarlarda kullanılmalı ve yardımcı maddenin eklenmesi ve çıkarılması için ilave sentetik adımlar gerektirmelidir. Bununla birlikte, bazı durumlarda, mevcut tek stereoselektif metodoloji, kiral yardımcılara dayanır ve bu reaksiyonlar, enantiyomerik açıdan saf ürünlere en zaman verimli erişim sağlayan, çok yönlü ve çok iyi çalışılmış olma eğilimindedir.[15] Ek olarak, yardımcı yönelimli reaksiyonların ürünleri, kolon kromatografisi veya kristalizasyon gibi yöntemlerle kolay ayrılmalarını sağlayan diastereomerlerdir.
Biyokataliz
Biyokataliz, izole edilmiş enzimlerden canlı hücrelere kadar değişen biyolojik bileşikleri kimyasal dönüşümler yapmak için kullanır.[17][18] Bu reaktiflerin avantajları, çok yüksek e.e.s ve reaktif spesifikliğinin yanı sıra, hafif çalışma koşulları ve düşük çevresel etki içerir. Biyokatalizörler, endüstride akademik araştırmalardan daha yaygın olarak kullanılmaktadır;[19] örneğin statinlerin üretiminde.[20] Bununla birlikte, yüksek reaktif spesifikliği, etkili bir reaktif bulunmadan önce çok çeşitli biyokatalizörlerin taranmasını gerektirdiği için bir problem olabilir.
Enantiyoselektif organokataliz
Organokataliz, kimyasal reaksiyon hızının karbon, hidrojen, kükürt ve diğer metal olmayan elementlerden oluşan organik bir bileşik ile arttırıldığı bir kataliz formunu belirtir.[21][22] Organocatalyst, kiral olduğunda enantioselektif sentez elde edilebilir;[23][24] örneğin bir dizi karbon-karbon bağı oluşturucu reaksiyon, prolin varlığında enantiyoselektif hale gelmiştir, en iyi örnek aldol reaksiyonudur.[25] Organokataliz genellikle kiral katalizörler olarak doğal bileşikler ve ikincil aminler kullanır;[26] bunlar metal içermemesi nedeniyle ucuz ve çevre dostudur.
Kiral havuz sentezi
Kiral havuzu sentezi, enantioselektif sentez için en basit ve en eski yaklaşımlardan biridir. Kolayca temin edilebilen bir kiral başlangıç materyali, istenen hedef molekülü elde etmek için, çoğunlukla akiral reaktifler kullanılarak, ardışık reaksiyonlar vasıtasıyla manipüle edilir. SN2 reaksiyonunda olduğu gibi yeni kiral türler oluşturulduğunda, enantiyoselektif sentez için kriterleri karşılayabilmektedir.

Kiral havuzu sentezi, şeker veya amino asit gibi nispeten ucuz doğal olarak oluşan bir yapı bloğuna benzer kiraliteye sahip hedef moleküller için özellikle çekicidir. Bununla birlikte, molekülün maruz kalabileceği olası reaksiyonların sayısı sınırlıdır ve kıvrımlı sentetik yollar gerekli olabilir (örn. Oseltamivir toplam sentezi). Bu yaklaşım aynı zamanda, eğer doğal olarak oluşmazsa pahalı olabilecek enantiyopur başlangıç malzemesinin stokiyometrik miktarını gerektirir.
Remove ads
Alternatif yaklaşımlar
Enantiyoselektif senteze alternatifler, genellikle bir enantiyomerin rasemik bir karışımdan, birkaç yöntemden herhangi biri ile izole edilmesini içerir. Bu tür rasemik karışımları yapmak için gereken zaman ve maliyet düşükse (veya her iki enantiyomerin de kullanım alanı bulunabilirse), bu yaklaşım düşük maliyetli kalabilir. Yaygın ayırma yöntemleri, kiral çözünürlük veya kinetik çözünürlüğe dayanır.
Enantiyomerlerin ayrılması ve analizi
Özetle
Bakış açısı
Bir molekülün iki enantiyomeri, aynı fiziksel özelliklere (erime noktası, kaynama noktası, polarite, vb.) sahiptir ve bu nedenle birbirleriyle aynı şekilde davranırlar. Sonuç olarak, ince tabaka kromatografisinde aynı Rf ile göç edecekler ve HPLC ve GC'de aynı alıkonma sürelerine sahip olacaklardır. NMR ve IR spektrumları aynıdır.
Bu, bir işlemin tek bir enantiyomer üretip üretmediğini (ve en önemlisi hangi enantiyomer olduğunu) belirlemeyi zorlaştırabilir ve ayrıca enantiyomerleri %100 enantiyoselektif olmayan bir reaksiyondan ayırmayı zorlaştırır. Neyse ki, enantiyomerler diğer kiral materyallerin varlığında farklı davranırlar ve bunların ayrılma ve analizine izin vermek için kullanılabilir.
Enantiyomerler, kuvars veya kiral olarak değiştirilmiş standart ortamlar gibi kiral kromatografik ortamlar üzerinde aynı şekilde göç etmezler. Bu, GC ve HPLC yoluyla analize izin vermek için küçük bir ölçekte veya kiral olarak saf olmayan maddeleri ayırmak için büyük bir ölçekte kullanılabilen kiral kolon kromatografisinin temelini oluşturur. Bununla birlikte, bu işlem pahalı olabilecek büyük miktarda kiral paketleme malzemesi gerektirebilir. Yaygın bir alternatif, enantiyomerleri, kiral yardımcı maddelerle aynı şekilde bir diyastereomerlere dönüştürmek için bir kiral türevlendirme maddesinin kullanılmasıdır. Bunlar farklı fiziksel özelliklere sahiptir ve bu nedenle geleneksel yöntemler kullanılarak ayrılabilir ve analiz edilebilir. 'Kiral çözünürlük ajanları' olarak bilinen özel kiral türevlendirme ajanları, stereoizomerlerin NMR spektroskopisinde kullanılır, bunlar tipik olarak Eu(fod)3 ve Eu(hfc)3 gibi kiral europium komplekslerinin koordinasyonunu içerir.
Bir maddenin enantiyomerik fazlalığı ayrıca bazı optik yöntemler kullanılarak belirlenebilir. Bunu yapmak için en eski yöntem, üründeki optik dönme seviyesini bilinen bir bileşimin standartına göre karşılaştırmak için bir polarimetre kullanmaktır. Pamuk etkisinden yararlanarak stereoizomerlerin ultraviyole görünür spektroskopisini yapmak da mümkündür.
Bileşiğin kiralitesini belirlemenin en doğru yollarından biri, X-ışını kristalografisi ile mutlak konfigürasyonunu belirlemektir. Ancak bu, uygun bir tek kristalin yetiştirilmesini gerektiren emek yoğun bir işlemdir.
Remove ads
Tarihçe
Özetle
Bakış açısı
Başlangıç (1815-1905)
1815'te Fransız fizikçi Jean-Baptiste Biot, bazı kimyasalların optik aktivite denilen bir özellik olan polarize ışık demetinin düzlemini döndürebileceğini gösterdi.[27] Bu özellik doğası 1848'de Louis Pasteur, bu "simetrik olmayan" biçimin moleküler dayanağa sahip olması gerektiğini önerene kadar bir sır olarak kalmıştır.[28][29] Bir yıl sonra Lord Kelvin tarafından icat edilen kiralite tabiri ile birlikte anılmaya başlanmıştır.[30] Kirallik orijini, nihayet 1874'te, Jacobus Henricus van't Hoff ve Joseph Le Bel'in bağımsız olarak karbonun tetrahedral geometrisini önermesiyle tanımlandı.[31][32] Bu çalışma öncesi yapısal modeller iki boyutlu olmuştu ve van't Hoff ve Le Bel, bu tetrahedronun etrafındaki grupların düzenlenişinin bileşiğin optik aktivitesini belirleyebileceğini teorik olarak ortaya koydu. Bugün bu kuralı Le Bel-van 't Hoff kuralı olarak biliyoruz .

1894'te Hermann Emil Fischer asimetrik indüksiyon kavramını ana hatlarıyla açıkladı;[34] seçici olarak, klorofil içindeki optik olarak aktif maddelerin etkisinden dolayı, bitkiler tarafından D- glikoz oluşumunu doğru şekilde seçtiğini belirtti. Fischer aynı zamanda, enantiyoselektif sentezin ilk örneği olacak bir işlemle şekerleri enantiyoselektif olarak uzatarak, bugün Kiliani-Fischer sentezi olarak kabul edilen sentezi başarıyla gerçekleştirmiştir.[35]

İlk enantioselektif kimyasal sentez, 2-etil-2-metil malonik asidin bir brusin-katalize edilmiş enantioselektif dekarboksilasyonu için, Willy Marckwald, Universität zu Berlin'e atfedilir.[33][36] 2-metilbütirik asit reaksiyon ürününün levorotar formunun biraz fazlası üretildi; bu ürün aynı zamanda doğal bir üründür - örneğin, biyosentezi sırasında diketit sentazının (LovF) oluşturduğu bir lovastatinin bir yan zinciri olarak oluşur [37] - bu sonuç, enantiyoselektivite ile kaydedilen ilk toplam sentezi oluşturur. İmza attığı diğer ilkler, Koskinen'in belirttiği üzere "asimetrik kataliz, enantiotopik seleksiyon ve organokatalizin ilk örneği"dir.[33] Enantiyoselektif sentez, sadece yaşamsallık anlamında anlaşılabildiği için, bu gözlem tarihi öneme sahiptir. Jöns Jacob Berzelius gibi birçok önde gelen kimyager o zamanlar doğal ve yapay bileşiklerin temelde farklı olduğunu ve kiralilitenin sadece doğal bileşiklerde var olabilecek “hayati kuvvetin” bir tezahürü olduğunu savundu.[38] Fischer'den farklı olarak, Marckwald, bir kiral organokatalyör ile de olsa (şimdi bu kimyayı anladığımız gibi), bir aviral, doğal olmayan başlangıç materyali üzerine enantioselektif bir reaksiyon gerçekleştirmiştir.[33][39][40]
Erken çalışmalar (1905–1965)
Enantiyoselektif sentezin gelişimi, büyük ölçüde, ayırma ve analiz için mevcut olan sınırlı teknik yelpazesi nedeniyle, yavaştı. Diastereomerler, geleneksel yollarla ayrılmaya izin veren farklı fiziksel özelliklere sahiptir, ancak o sırada enantiyomerler sadece kendiliğinden çözünürlükle (kristalleşme üzerine ayrılan enantiyomerlerin) veya kinetik çözünürlükle (bir enantiyomerin seçici olarak yok edildiği) ayrılabilir. Enantiyomerlerin analizi için tek araç, yapısal veri sağlamayan bir yöntem olan polarimetre kullanan optik aktivite idi.
1950'lere kadar büyük ilerleme gerçekten başlamamıştı. Kısmen RB Woodward ve Vladimir Prelog gibi kimyagerler tarafından ve aynı zamanda yeni tekniklerin geliştirilmesiyle yönlendirildi. Bunlardan ilki, 1951'de Johannes Bijvoet tarafından bir organik bileşiğin mutlak konfigürasyonunu belirlemek için kullanılan X-ışını kristalografisi idi.[41] Kiral kromatografi, bir yıl sonra kiral amino asitleri ayırmak için kağıt kromatografisini kullanan Dalgliesh tarafından tanıtıldı.[42] Her ne kadar bu tür ayrılmaları ilk gözlemleyen Dalgliesh olmasa da, enantiomerlerin ayrılmasını kiral selülozun diferansiyel tutulmasına doğru bir şekilde bağladı. Bu, Klem ve Reed'in ilk önce kiral HPLC ayrılması için kiral olarak modifiye edilmiş silika jel kullanıldığını bildirdiği 1960'ta genişletildi.[43]

Solda: (S) - talidomit
Sağ: (R) - talidomit
Talidomit
Farklı enantiyomerlere sahip bir ilacın farklı etkilere sebep olabileceği o dönemde Arthur Robertson Cushny'nin çalışmaları sayesinde bilinse de,[44][45] bu erken ilaç tasarımında ve testinde sorumluğu getirmiyordu. Bununla birlikte, talidomidin felaketinin ardından ilaçların gelişimi ve ruhsatlandırması çarpıcı biçimde değişti.
İlk olarak 1953'te sentezlenen talidomit, 1957'den 1962'ye kadar sabah bulantısı için yaygın olarak reçete edildi, ancak kısa sürede ciddi şekilde teratojenik olduğu bulundu,[46] sonuçta 10.000'den fazla bebekte doğum kusurlarına yol açtı. Afet birçok ülkeyi Kefauver-Harris Değişikliği (ABD) ve 65/65 / EEC1 (AB) Direktifi gibi ilaçların test edilmesi ve ruhsatlandırılması için daha sert kurallar koymaya teşvik etti.
Fareler kullanılarak teratojenik mekanizma üzerine yapılan erken araştırmalar, bir talidomit enantiyomerinin teratojenik olduğunu, diğerinin ise tüm terapötik aktiviteye sahip olduğunu gösterdi. Bu teori daha sonra yanlış olarak gösterildi ve yenilendi. Bununla birlikte, ilaç tasarımında kiralitenin önemi artmış ve enantiyoselektif sentez araştırmalarının artması sağlanmıştır.
Modern çağ (1965'ten beri)
Cahn-Ingold – Prelog öncelik kuralları (genellikle CIP sistemi olarak kısaltılır) ilk kez 1966'da yayınlandı ve enantiyomerlerin daha kolay ve doğru bir şekilde tarif edilmesini sağlamadı.[47][48] Aynı yıl, gaz kromatografisi [49] ilk başarılı enantiyomerik ayrılmayı sağladı, bu teknolojinin o dönemde yaygın olarak kullanılması sebebiyle önemli bir gelişmeydi.
Metal katalizli enantioselektif sentezin, William S. Knowles, Ryōji Noyori ve K. Barry Sharpless tarafından önü açıldı; bunun için 2001'de Nobel Kimya Ödülü'nü alacaklardı. Knowles ve Noyori, 1968'de bağımsız olarak geliştirdikleri asimetrik hidrojenasyonun gelişmesiyle başladı. Knowles, Wilkinson'ın katalizöründeki akiral trifenilfosfin ligandlarını kiral fosfin ligandlarla değiştirdi. Bu deneysel katalizör, en az% 15 enantiyomerik fazlalığı olan asimetrik bir hidrojenasyonda kullanıldı. Endüstriyel ölçekli senteze enantiyoselektif metal katalizi uygulayan ilk kişi Knowles idi; Monsanto Şirketi için çalışırken, DIPAMP ligandını kullanarak L-DOPA üretimi için enantiyoselektif bir hidrojenasyon adımı geliştirdi.[50][51][52]
Noyori, stiren metal-karbenoid siklopropanasyonu için kullandığı kiral bir Schiff baz ligandı kullanarak bir bakır kompleksi geliştirdi.[53] Knowles'in bulgularıyla ortak olarak, Noyori'nin bu birinci nesil ligand için enantiyomerik fazlalığa ilişkin sonuçları hayal kırıklığı yarattı: %6. Ancak devam eden araştırmalar sonunda Noyori asimetrik hidrojenasyon reaksiyonunun gelişmesine yol açtı.

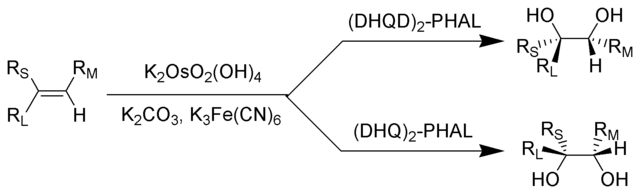
Sharpless, 1970'lerde ve 1980'lerde asimetrik oksidasyonlar (Sharpless epoksidasyon,[54] Sharpless asimetrik dihidroksilasyon,[55] Sharpless oksiaminasyon [56] ) geliştirerek bu indirgeme reaksiyonlarını tamamlamıştır. Asimetrik oksiaminasyon reaksiyonu ile, osmium tetroksit kullanarak, en erken yapandır.
Aynı dönemde, kiral bileşiklerin NMR ile analizine izin verecek yöntemler geliştirilmiştir; Mosher asidi [57] gibi kiral türevlendirme ajanları veya ilk olarak Eu(DPM)3 gibi europium bazlı kaydırma reaktifleri kullanılarak.[58]
Kiral yardımcılar, EJ Corey tarafından 1978'de [59] tanıtıldı ve Dieter Enders'in çalışmalarında belirgin bir şekilde öne çıktılar. Aynı zamanda, Hajos – Parrish – Eder – Sauer – Wiechert reaksiyonunu içeren öncü çalışmalarla enantiyoselektif organokataliz geliştirildi. Enzim-katalizli enantiyoselektif reaksiyonlar 1980'lerde,[60] domuz karaciğeri esterazla asimetrik ester hidrolizi gibi uygulamalarıyla özellikle sanayide [61] de dahil olmak üzere daha yaygın olmuştur. Gelişen genetik mühendisliği teknolojisi, artan seçici selektif dönüşümlere izin vererek, enzimlerin spesifik işlemlere uyarlanmasına izin vermiştir. Örneğin, statin öncüllerinin asimetrik hidrojenasyonu.[15]
Remove ads
Ayrıca bakınız
- Aza-Baylis-Hillman reaksiyonu, enantiyoselektif sentezde kiral bir iyonik sıvı kullanımı için.
- Spontan mutlak asimetrik sentez, optik olarak aktif katalizörler veya yardımcı maddeler kullanılmadan kiral ürünlerin akiral öncüllerinden sentezi. Tabiattaki homokiralite tartışılması ile ilgilidir .
- Ataktik, enantiyoselektif sentezden kaynaklanan bir polimer özelliği.
Kaynakça
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads