Јединица атомске масе
мерна јединица From Wikipedia, the free encyclopedia
Унификована јединица атомске масе (), или далтон () јединица је за масу која се користи да изрази атомске и молекулске масе. Дефинише се као 1/12 масе атома угљеника-12.[1][2] Константа атомске масе, означена као mu, дефинисана је идентично, дајући mu = m(12C)/12 = 1 Da.[3] Сходно томе, 1 u = 1/NA грама = 1/(1000 NA) kg (где је NA Авогадров број), и 1 u ≈ 1.66053886 x 10-27 . Симбол за јединицу атомске масе (енгл. ) може још увек негде да се пронађе, нарочито у старим делима. Атомске масе се често пишу без икакве јединице, па се тада јединица атомске масе подразумева.
| Далтон (Унификована јединица атомске масе) | |
|---|---|
| Систем | Физичка константа (Прихваћено за употребу са СИ) |
| Јединица | маса |
| Симбол | или |
| Именован по | Џон Далтон |
| Јединична претварања | |
| 1 или у ... | ... је једнак са ... |
| 1,66053906660(50) × 10−27 | |
| 1 | |
| 1822,888486209(53) | |
| 931,49410242(28) | |
Унификована јединица атомске масе није СИ јединица за масу, иако је (само под тим називом и симболом u) прихваћена за коришћење у оквиру СИ. Погледајте везу за СИ сајт доле. Јединица је подесна, јер један атом водоника има масу од отприлике 1 u, и генералније, атом или молекул који садржи n протона и неутрона има масу отприлике једнаку . Маса је 'отприлике' јер је због дефекта масе маса сложених честица различита од збира маса њихових састојака. Други разлог зашто се ова јединица користи је да се експериментално много лакше и прецизније могу упоређивати масе атома и молекула (утврдити релативне масе) него мерити њихове апсолутне масе. Масе се пореде уз помоћ масеног спектрометра (погледајте испод). Авогадров број () и мол се дефинишу тако да један мол супстанце са атомском или молекулском масом од 1 u има масу од тачно 1 грама. На пример, молекулска маса воде је 18,01508 u и ово значи да један мол воде има масу од 18,01508 грама и да 1 грам воде садржи NA/18.01508 ≈ 3.3428 × 1022 молекула.
Ова јединица се обично користи у физици и хемији за изражавање масе објеката атомске скале, као што су атоми, молекули и елементарне честице, како за дискретне случајеве, тако и за више типова просечних вредности ансамбла. На пример, атом хелијума-4 има масу од 4,0026 . Ово је суштинско својство изотопа и сви атоми хелијума-4 имају исту масу. Ацетилсалицилна киселина (аспирин), C
9H
8O
4, има просечну масу од приближно 180,157 . Међутим, нема молекула ацетилсалицилне киселине са овом масом. Две најчешће масе појединачних молекула ацетилсалицилне киселине су 180,0423 , који имају најчешће изотопе, и 181,0456 , у којима је присутан један угљеник-13.
У литератури из биохемије и молекулске биологије (нарочито у вези са протеинима), користи се термин далтон, са симболом „“. С обзиром да су протеини велики молекули, о њима се обично говори у килодалтонима, или „“, где је један килодалтон једнак 1000 далтона.[4] Титин, један од највећих познатих протеина, има молекулску масу између 3 и 3,7 мегадалтона.[5] ДНК хромозома 1 у људском геному има око 249 милиона парова база, сваки са просечном масом од око 650 Da, или укупно 156 GDa.[6]
Мол је јединица за количину супстанце, која се широко користи у хемији и физици, а која је првобитно дефинисана тако да маса једног мола супстанце, мерена у грамима, буде бројчано једнака просечној маси једне од њених саставних честица, мерено у далтонима. То јест, моларна маса хемијског једињења је била нумерички једнака његовој просечној молекулској маси. На пример, просечна маса једног молекула воде је око 18,0153 далтона, а један мол воде је око 18,0153 грама. Протеин чији молекул има просечну масу од 64 kDa имао би моларну масу од 64 M. Међутим, иако се ова једнакост може претпоставити за скоро све практичне сврхе, сада је само приближна, због начина на који је мол редефинисан 20. маја. 2019.[4][1]
Генерално, маса атома у далтонима је бројчано блиска, али није баш једнака броју нуклеона садржаних у његовом језгру. Из тога следи да је моларна маса једињења (грама по молу) нумерички близу просечном броју нуклеона садржаних у сваком молекулу. По дефиницији, маса атома угљеника-12 је 12 далтона, што одговара броју нуклеона које има (6 протона и 6 неутрона). Међутим, на масу објекта атомске размере утиче енергија везивања нуклеона у његовим атомским језгрима, као и маса и енергија везивања његових електрона. Дакле, ова једнакост важи само за атом угљеника-12 у наведеним условима, а варираће и за друге супстанце. На пример, маса једног невезаног атома уобичајеног изотопа водоника (водоник-1, протијум) је 1,007825032241(94) , маса једног слободног неутрона је 1,00866491595(49) ,[7] маса атома водоника-2 (деутеријума) је 2,014101778114(122) .[8] Генерално, разлика (дефект масе) је мања од 0,1%; изузеци су водоник-1 (око 0,8%), хелијум-3 (0,5%), литијум (0,25%) и берилијум (0,15%).
Унификовану јединицу атомске масе и далтон не треба мешати са јединицом масе у атомским системима јединица, што је уместо тога маса мировања електрона ().
Енергетски еквиваленти
Константа атомске масе се такође може изразити као њен енергетски еквивалент, muc2. Препоручене вредности према CODATA за 2018. су:
Еквивалент масе мегаелектронволта (MeV/c2) се обично користи као јединица масе у физици честица, а ове вредности су такође важне за практично одређивање релативних атомских маса.
Историја
Порекло концепта
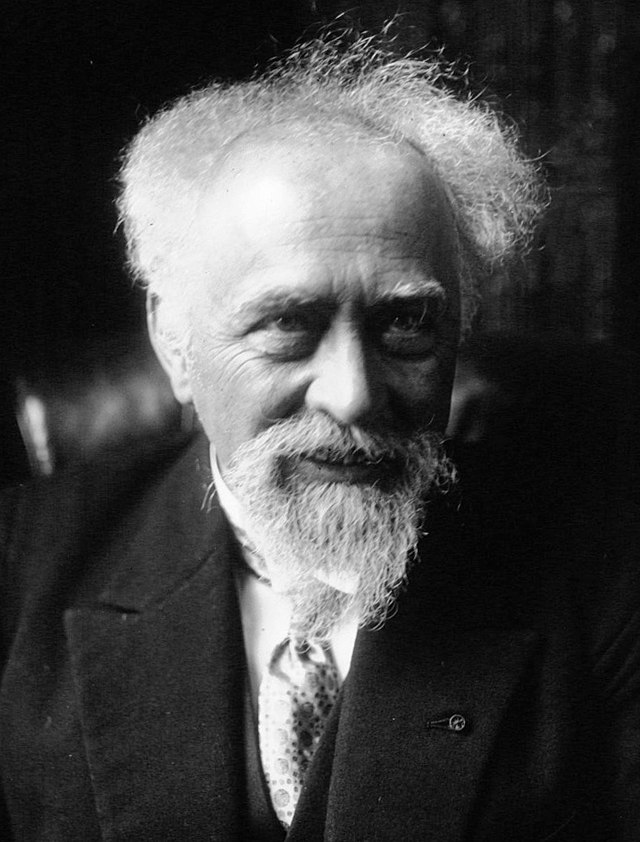
Тумачење закона сталним пропорција у смислу атомске теорије материје подразумевало је да масе атома различитих елемената имају одређене односе који зависе од елемената. Док су стварне масе биле непознате, релативне масе су се могле закључити из тог закона. Године 1803, Џон Далтон је предложио да се (још увек непозната) атомска маса најлакшег атома, водоника, користи као природна јединица атомске масе. Ово је била основа скале атомске тежине.[10]
Из техничких разлога, 1898. хемичар Вилхелм Оствалд и други су предложили да се редефинише јединица атомске масе као 1/16 масе атома кисеоника.[11] Тај предлог је званично усвојио Међународни комитет за атомске тежине (ICAW) 1903. То је била отприлике маса једног атома водоника, али кисеоник је био подложнији експерименталном одређивању. Овај предлог је изнет пре открића изотопа 1912. године.[10] Физичар Жан Перин је усвојио исту дефиницију 1909. током својих експеримената за одређивање атомских маса и Авогадрове константе.[12] Ова дефиниција је остала непромењена до 1961. године.[13][14] Перин је такође дефинисао „мол” као количину једињења која садржи онолико молекула колико и 32 грама кисеоника (O
2). Тај број је назвао Авогадровим бројем у част физичара Амедеа Авогадра.
Изотопска варијација
Откриће изотопа кисеоника 1929. године захтевало је прецизнију дефиницију јединице. Две различите дефиниције су ушле у употребу. Хемичари су изабрали да дефинишу AMU као 1/16 просечне масе атома кисеоника који се налази у природи; односно просек маса познатих изотопа, пондерисан њиховим природним обиљем. Физичари су је, пак, дефинисали као 1/16 масе атома изотопа кисеоника-16 (16O).[11]
Дефиниција по IUPAC-у
Постојање две различите јединице са истим именом било је збуњујуће, а разлика (око 1,000282 у релативном смислу) била је довољно велика да утиче на високо прецизна мерења. Штавише, откривено је да изотопи кисеоника имају различите природне количине у води и ваздуху. Из ових и других разлога, 1961. године Међународна унија за чисту и примењену хемију (IUPAC), која је апсорбовала ICAW, усвојила је нову дефиницију јединице атомске масе за употребу у физици и у хемији; Наиме, 1/12 масе атома угљеника-12. Ова нова вредност је била средња између две раније дефиниције, али ближа оној коју користе хемичари (на које би промена највише утицала).[10][11]
Нова јединица је названа „јединствена јединица атомске масе“ и добила је нови симбол „u“, да замени стари „amu“ који је коришћен за јединице засноване на кисеонику.[15] Међутим, стари симбол „amu“ се понекад користио, и после 1961. године, за означавање нове јединице, посебно у лаичком и припремном контексту.
Са овом новом дефиницијом, стандардна атомска тежина угљеника је око 12,011 Da, а кисеоника око 15,999 Da. Ове вредности, које се углавном користе у хемији, засноване су на просецима многих узорака из Земљине коре, њене атмосфере и органских материјала.
Мерење релативних атомских маса
Релативна атомска маса се мери масеним спектрометром. У масеном спектрометру узорак се јонизује (бомбардовањем електронима, јонима или озрачивањем ласером) и пропушта кроз комбинацију електричног и магнетног поља где јони попримају различите путање зависно од специфичног наелектрисања. Тако се добија масени спектар који представља јонску струју у функцији специфичне масе.
Овај спектар пружа:
- Релативне масе изотопа
- Заступљеност изотопа
Мерење масе електрона
У пракси, константа атомске масе се одређује из масе мировања електрона и релативне атомске масе електрона (тј. масе електрона подељене са константом атомске масе).[16] Релативна атомска маса електрона може се мерити у циклотронским експериментима, док се маса мировања електрона може извести из других физичких константи.
где је брзина светлости, је Планкова константа, α је константа фине структуре, а ∞ је Ридбергова константа.
Као што се може приметити из старих вредности (2014 CODATA) у табели испод, главни ограничавајући фактор у прецизности Авогадрове константе била је несигурност у вредности Планкове константе, јер су све остале константе које доприносе прорачуну биле прецизније познате.
| Константа | Симбол | 2014 вредности | Релативна стандардна несигурност | Коефицијент корелације са |
|---|---|---|---|---|
| Однос масе протон-електрон | 1836,15267389(17) | 9,5×10–11 | −0,0003 | |
| Константа моларне масе | 0,001 | 0 (дефинисана) | — | |
| Ридбергова константа | ∞ | 10 973 731,568508(65) −1 | 5,9×10−12 | −0,0002 |
| Планкова константа | 6,626070040(81) × 10−34 | 1,2×10–8 | −0,9993 | |
| Брзина светлости | 299 792 458 | 0 (дефинисана) | — | |
| Константа фине структуре | α | 7,2973525664(17) × 10−3 | 2,3×10−10 | 0,0193 |
| Авогадров број | 6,022140857(74) × 1023 −1 | 1,2×10−8 | 1 |
Моћ тренутно дефинисаних вредности универзалних константи може се разумети из табеле испод (2018 CODATA).
| Константа | Симбол | 2018 CODATA вредности[17] | Релативна стандардна несигурност | Коефицијент корелације са |
|---|---|---|---|---|
| Однос масе протон-електрон | 1836,15267343(11) | 6,0×10−11 | — | |
| Константа моларне масе | 0,99999999965(30) × 10−3 | 3,0×10−10 | — | |
| Ридбергова константа | ∞ | 10973731,568160(21) −1 | 1,9×10−12 | — |
| Планкова константа | 6.62607015 × 10−34 | 0 (дефинисана) | — | |
| Брзина светлости | 299 792 458 | 0 (дефинисана) | — | |
| Константа фине структуре | α | 7,2973525693(11) × 10−3 | 1,5×10−10 | — |
| Авогадров број | 6,02214076 × 1023 −1 | 0 (дефинисана) | — | |
Методе кристалне густине рендгенских зрака

Силицијумски монокристали се данас могу производити у комерцијалним објектима са изузетно високом чистоћом и са мало грешака у решетки. Ова метода је дефинисала Авогадрову константу као однос моларне запремине, , и атомске запремине :
,
где је
- , и
- је број атома по јединичној ћелији запремине .
Јединична ћелија силицијума има кубни распоред паковања од 8 атома, а запремина јединичне ћелије се може мерити одређивањем параметра јединичне ћелије, дужине једне од страница коцке.[18] Вредност према 2018. за силицијум је 5,431020511(89) × 10−10 .[19]
У пракси, мерења се врше на растојању познатом као , што је растојање између равни означено Милеровим индексима {220}, и једнако је /√8.
Изотопски пропорционални састав коришћеног узорка мора бити измерен и узет у обзир. Силицијум се јавља у три стабилна изотопа (), а природна варијација у њиховим пропорцијама је већа од других несигурности у мерењима. Атомска тежина за узорак кристала може се израчунати, пошто су стандардне атомске тежине три нуклида познате са великом тачношћу. Ово, заједно са измереном густином ρ узорка, омогућава да се одреди моларна запремина :
где је константа моларне масе. Вредност по подацима за 2018. за моларну запремину силицијума је 1.205883199(60)×10−5 , са релативном стандардном несигурношћу од 4,9×10−8.[20]
Историја
Хемичар Џон Далтон је први предложио да маса једног атома водоника буде јединица атомске масе. Франсис Астон, проналазач масеног спектрометра је касније користио 1/16 масе атома кисеоника-16 као своју јединицу.
Пре 1961, физичка јединица атомске масе је дефинисана као 1/16 масе једног атома кисеоника-16, док је хемијска јединица атомске масе дефинисана као 1/16 просечне масе кисеониковог атома (рачунајући природно изобиље различитих кисеоникових изотопа). Обе јединице су незнатно мање од унификоване јединице, која је усвојена од стране Међународне уније за чисту и примењену физику () 1960. године и од стране Међународне уније за чисту и примењену хемију () 1961. године.
Види још
- Однос масе и набоја
Референце
Спољашње везе
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





