органска једињења са кисеоником која садрже карболнилну, кето-групу From Wikipedia, the free encyclopedia
Кетони су органска једињења са кисеоником која садрже карболнилну, кето-групу.[1] За угљеников атом карбонилне групе везане су две акил-групе. Кетони настају оксидацијом секударних алкохола. Општа кетона формула је: [2] Најједноставнији кетон је ацетон (R = R' = метил), са формулом . Многи кетони су од велике важности у индустрији и биологији. Примери укључују многе шећере (кетозе), многе стероиде (нпр. тестостерон) и растварач ацетон.[3]
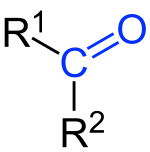
Реч кетон је изведена из , старе немачке речи за ацетон.[4][5][6]
По номенклатури, кетони се имењују променом суфикса -ан на почетном алкану у -анон. Положај карбонилне групе обично се означава бројем. За важније кетоне се користе традиционална несистематска имена, на пример ацетон и бензофенон. Та несистематска имена се сматрају задржаним именима,[7] мада поједини уџбеници користе имена попут 2-пропанон или пропан-2-он уместо ацетона, најједноставнијег кетона (-C H3-CO-CH3}-). Позиција карбонилне групе се обично означава бројем.
Изведена имена кетона добијају се одвојеним писањем имена две алкилне групе повезане са карбонилном групом, а затим као посебна реч следи „кетон“. Имена алкилних група се пишу по редоследу све веће сложености: на пример, метил етил кетон. Према правилима номенклатуре, алкилне групе се пишу по абецеди, тј. етил метил кетон. Када су две алкилне групе исте, префикс „ди-“ се додаје испред имена алкилне групе. Положаји осталих група означени су грчким словима, α-угљеник је атом уз карбонилну групу.
Иако се ретко користи, оксо је део IUPAC номенклатура за оксо групу (=О) и користи се као префикс када кетон нема највећи приоритет. Међутим, користе се и други префикси. За неке уобичајене хемикалије (углавном у биохемији), кето се односи на кетонску функционалну групу.

Кетонски угљеник се често описује као „2 хибридизован“, што је опис који укључује и њихову електронску и молекуларну структуру. Кетони су тригонално планарни око кетонског угљеника, са угловима везе и од приближно 120°. Кетони се разликују од алдехида по томе што је карбонилна група () везана за два угљеника унутар угљеничног скелета. У алдехидима, карбонил је везан за један угљеник и један водоник, и налази се на крајевима угљеничних ланаца. Кетони се такође разликују од осталих функционалних група које садрже карбонил, попут карбоксилних киселина, естара и амида.[8]
Карбонилна група је поларна, јер је електронегативност кисеоника већа од оне за угљеник. Дакле, кетони су нуклеофилни на кисеоник и електрофилни на угљенику. Будући да карбонилна група формира интеракције са водом путем водоничног везивања, кетони су типично растворљивији у води од сродних метиленских једињења. Кетони су акцептори водоничне везе. Кетони обично нису донатори водоничне везе и не могу се водоничном везом везати за себе. Због немогућности да служе као донатори и акцептори водоничних веза, кетони немају тенденцију „самоповезивања“ и испарљивији су од алкохола и карбоксилних киселина сличне молекулске тежине. Ови фактори доприносе свеприсутности кетона у парфимерији и као растварача.
Кетони се класификују на основу њихових супституената. Једна широка класификација дели кетоне на симетричне и несиметричне деривате, у зависности од еквиваленције два органска супституента везана за карбонилни центар. Ацетон и бензофенон () су симетрични кетони. Ацетофенон () је асиметрични кетон.
Познате су многе врсте дикетона, неке од којих имају необична својства. Најједноставнији је диацетил (), некада кориштен као арома путера у кокицама. Ацетилацетон (пентан-2,4-дион) је практично погрешан назив (неодговарајући назив), јер ова материја постоји углавном као моноенол . Његов енолат је уобичајени лиганд у координационој хемији.
Кетони који садрже алкенске и алкинске јединице често се називају незасићени кетони. Најчешћи члан ове класе једињења је метил винил кетон, , који је користан у Робинсоновој анулационој реакцији. Да не би дошло до забуне, сам кетон је место незасићења; односно може се хидрогенизовати.
Многи кетони су циклични. Најједноставнија класа има формулу , где варира од 2 за циклопропанон до виших аналога. Постоји мноштво већих деривата. Циклохексанон, симетрични циклични кетон, важан је међупродукт у производњи најлона. Изофорон, изведен из ацетона, је незасићени, асиметрични кетон који је прекурзор другим полимерима. Мускон, 3-метилпентадеканоне, је животињски феромон. Још један циклични кетон је циклобутанон, који има формулу .

Кетони који имају најмање један алфа-водоник, подвргавају се кето-енолној таутомеризацији; таутомер је енол. Таутомеризацију катализују киселине и базе. Обично је кето облик стабилнији од енола. Ова равнотежа омогућава припрему кетона хидрацијом алкина.
везе суседне карбонилу у кетонима су киселије ( ≈ 20) од веза у алкану ( ≈ 50). Ова разлика одражава резонантну стабилизацију енолатног јона који настаје депротоновањем. Релативна киселост α-водоника је важна у реакцијама енолизације кетона и других карбонилних једињења. Киселост α-водоника такође омогућава кетонима и другим карбонилним једињењима да реагују као нуклеофили на том положају, са било стехиометријском или каталитичком базом. Користећи врло јаке базе попут литијум-диизопропиламида (ЛДА, конјуговане киселине ~36) у неуравнотеженим условима (–788 °C, 1,1 еквивалента ЛДА у ТХФ, кетон додат у базу), мање супституисани кинетички енолат се генерише селективно, док услови који омогућавају равнотежу (виша температура, база додата кетону, употребом слабих или нерастворљивих база, нпр. у , или ) дају супституисанији термодинамички енолат.
Кетони су такође слаба база, која подлеже протонацији на карбонилном кисеонику у присуству Бренстедових киселина. Кетонијумови јони (тј. протоновани кетони) јаке су киселине, чија се вредност процењује на између –5 и –7.[9][10] Иако су киселине које се срећу у органској хемији ретко довољно јаке да у потпуности протонирају кетоне, формирање равнотежних концентрација протонованих кетона је ипак важан корак у механизмима многих уобичајених органских реакција, попут стварања ацетала, на пример. Веома слабе киселине, као што је пиридинијум катијон (какав се налази у пиридинијум тосилату) са 5,2 могу да послуже као катализатори у овом контексту, упркос врло неповољној константи равнотеже за протонацију ().
Алдехид се разликује од кетона по томе што има атом водоника везан за своју карбонилну групу, чинећи алдехиде лакшим за оксидацију. Кетони немају атом водоника везан за карбонилну групу и зато су отпорнији на оксидацију. Они се оксидују само снажним оксидационим средствима која имају способност цепања веза угљеник-угљеник.
Кетони и алдехиди снажно апсорбују у инфрацрвеном спектру близу 1700 −1. Тачан положај пика зависи од супституената.
Док 1 спектроскопија генерално није корисна за утврђивање присуства кетона, спектри показују сигнале нешто ниже од 200 , у зависности од структуре. Такви сигнали су обично слаби због одсуства нуклеарних Оверхаузерових ефеката. Пошто алдехиди резонирају при сличним хемијским помацима, примењују се експерименти вишеструке резонанце да би се дефинитивно разликовали алдехиди и кетони.
Кетони дају позитивне резултате у Брејдијевом тесту, реакцијом са 2,4-динитрофенилхидразином дајући одговарајући хидразон. Кетони се могу разликовати од алдехида давањем негативног резултата са Толенсовим реагенсом или са Фелинговим раствором. Метил кетони дају позитивне резултате на јодоформном тесту.[11] Кетони такође дају позитивне резултате када се третирају са -динитробензеном у присуству разблаженог натријум хидроксида дајући љубичасту боју.
Постоје многи методи за припрему кетона у индустријским размерама и академским лабораторијама. Кетоне такође на разне начине производе организми; погледајте одељак о биохемији у наставку.
У индустрији најважнија метода вероватно укључује оксидацију угљоводоника, често ваздухом. На пример, милијарда килограма циклохексанона произведе се годишње аеробном оксидацијом циклохексана. Ацетон се припрема ваздушном оксидацијом кумена.
За специјализоване или мале органске синтетске примене, кетони се често припремају оксидацијом секундарних алкохола:
Типични јаки оксиданси (извор „О“ у горњој реакцији) укључују калијум перманганат или једињење. У блажим условима користе се Дес–Мартинов перјодинан или Мофат–Сверн методе.
Развијене су многе друге методе, примери укључују:[12]

Кетони који имају најмање један алфа-водоник, пролазе кроз кето-енол таутомеризацију; таутомер је енол. Таутомеризацију катализују и киселине и базе. Обично је кето облик стабилнији од енола. Ова равнотежа омогућава да се кетони припреме хидратацијом алкина.
C−H везе суседне карбонилу у кетонима су киселије pKa ≈ 20) него C−H везе у алкану (pKa ≈ 50). Ова разлика одражава резонантну стабилизацију енолатног јона који се формира депротонацијом. Релативна киселост α-водоника је важна у реакцијама енолизације кетона и других карбонилних једињења. Киселост α-водоника такође омогућава кетонима и другим карбонилним једињењима да реагују као нуклеофили на тој позицији, било са стехиометријском или каталитичком базом. Коришћењем веома јаких база као што је литијум диизопропиламид (LDA, pKa коњуговане киселине ~36) у неравнотежним условима (–78 °C, 1,1 еквив LDA у THF, кетон додат бази), мање супституисани кинетички енолат се генерише селективно, док услови који омогућавају еквилибрацију (виша температура, база додата кетону, коришћење слабих или нерастворљивих база, нпр. CH
3CH
2ONa у CH
3CH
2OH, или NaH) обезбеђује више супституисан термодинамички енолат.
Кетони су такође слабе базе, пролазећи кроз протонацију на карбонилном кисеонику у присуству Бренстедових киселина. Кетонијум јони (тј. протонирани кетони) су јаке киселине, са pKa вредностима процењеним на негде између –5 и –7.[23][24] Иако су киселине које се сусрећу у органској хемији ретко довољно јаке да у потпуности протонирају кетоне, формирање равнотежних концентрација протонираних кетона је ипак важан корак у механизмима многих уобичајених органских реакција, као што је формирање ацетала, на пример. Киселине које су слабе попут пиридинијум катјона (као што је пронађено у пиридинијум тозилату) са pKa од 5,2 могу да служе као катализатори у овом контексту, упркос веома неповољној константи равнотеже за протонацију (Keq < 10−10).
Важан скуп реакција следи из осетљивости карбонилног угљеника на нуклеофилну адицију и тенденције да се енолати додају електрофилима. Нуклеофилни додаци укључују приближан редослед њихове уопштености:[12]

Кетони се цепају јаким оксидационим агенсима и на повишеним температурама. Њихова оксидација укључује цепање везе угљеник-угљеник да би се добила смеша карбоксилних киселина које имају мањи број атома угљеника од матичног кетона.
Кетони се не појављују у стандардним аминокиселинама, нуклеинским киселинама или липидима. Формирање органских једињења у фотосинтези одвија се преко кетона рибулоза-1,5-бисфосфата. Многи шећери су кетони, познати под заједничким именом кетозе. Најпознатија кетоза је фруктоза; углавном постоји као циклични хемикетал, који маскира функционалну групу кетона. Синтеза масних киселина се одвија преко кетона. Ацетоацетат је интермедијер у Кребсовом циклусу који ослобађа енергију из шећера и угљених хидрата.[26]
У медицини, ацетон, ацетоацетат и бета-хидроксибутират се заједнички називају кетонска тела, настала од угљених хидрата, масних киселина и аминокиселина код већине кичмењака, укључујући људе. Кетонска тела су повишена у крви (кетоза) након поста, укључујући ноћ сна; у крви и урину у гладовању; код хипогликемије, због других узрока осим хиперинсулинизма; код разних |урођених поремећаја метаболизма, и намерно изазваних кетогеном исхраном, и код кетоацидозе (обично због дијабетес мелитуса). Иако је кетоацидоза карактеристична за декомпензовани или нелечени дијабетес типа 1, кетоза или чак кетоацидоза може се јавити и код дијабетеса типа 2 у неким околностима.
Кетони се производе у великим количинама у индустрији као растварачи, полимерни прекурсори и фармацеутски производи. Што се тиче размера, најважнији кетони су ацетон, метилетил кетон и циклохексанон.[27] Они су такође уобичајени у биохемији, али мање него у органској хемији уопште. Сагоревање угљоводоника је неконтролисани процес оксидације који даје кетоне као и многе друге врсте једињења.
Иако је тешко генерализовати токсичност тако широке класе једињења, једноставни кетони, генерално, нису високо токсични. Ова карактеристика је један од разлога њихове популарности као растварача. Изузеци од овог правила су незасићени кетони као што је метил винил кетон са LD50 од 7 mg/kg (орално).[27]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.