Dioxigenil
composto químico Da Wikipédia, a enciclopédia livre
O ião dioxigenil, O2+, é uma oxidação raramente encontrada em que cada átomo de oxigénio está no estado de oxidação de +1⁄2. Este deriva formalmente do oxigénio molecular do qual foi removido um electrão:
- O2 → O+
2 + e−

À alteração de energia para este processo é designada de energia de ionização da molécula de oxigénio. Em relação à maioria das moléculas, esta energia de ionização é particularmente elevada, perto dos 1175 kJ/mol.[1] Como resultado, o escopo de aplicação da química de
O+
2 é bastante limitado, actuando principalmente como uma 1-electrão oxidante.[2]
Estrutura e propriedades moleculares
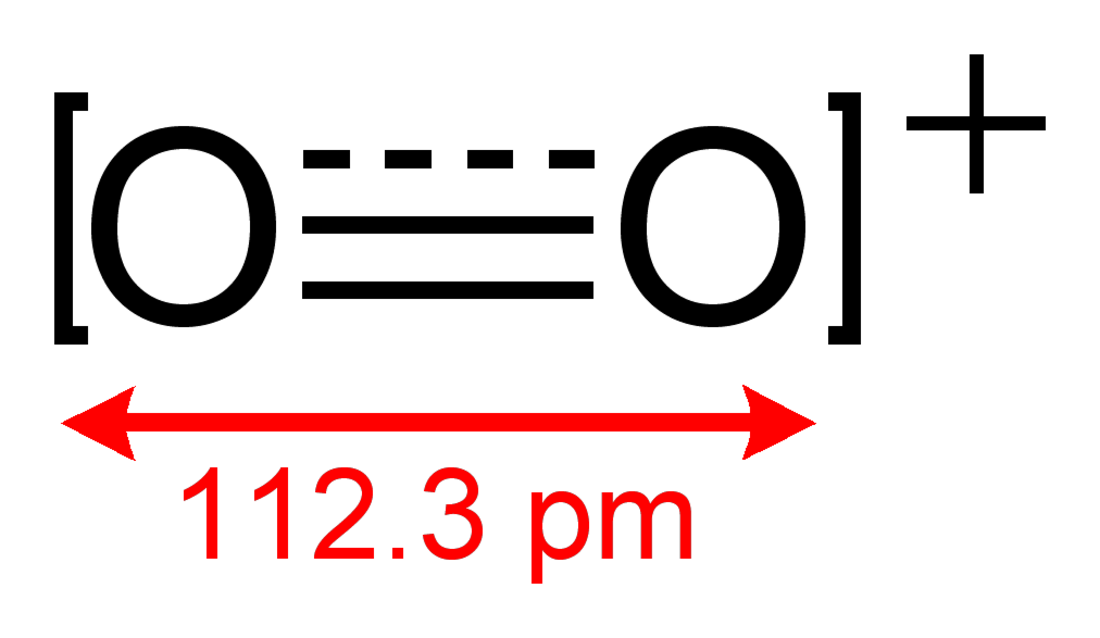
O
O+
2 apresenta uma ordem de ligação de 2.5, e um comprimento de ligação de 112.3 pm no estado sólido O2[AsF6].[3] Possui o mesmo número de electrões de valência que o óxido nítrico e é paramagnético.[4] A energia de ligação é 625.1 kJ mol-1 e a frequência de estiramento é de 1858 cm-1,[5] sendo que ambos são particularmente altos em relação à maioria das moléculas.
Síntese
A reacção do oxigénio, O2, com hexafluoreto de platina, PtF6, produz hexafluoroplatinato de dioxigenil, O2[PtF6]:
- O2 + PtF6 → O+
2[PtF
6]−
O PtF6 é um dos poucos agentes oxidantes capazes de oxidar o oxigénio.
O hexafluoroplatinato de dioxigenil desempenhou um papel fulcral na descoberta de compostos de gases nobres. Depois de Neil Bartlett descobrir que o PtF6 poderia oxidar O2 para O2+, ele investigou a sua reacção com gases nobres e descobriu hexafluoroplatinato de xénon.
O2+ também é encontrado em compostos similares da forma O2MF6, onde M é arsénio (As), antimónio (Sb),[6] ouro (Au),[7] nióbio (Nb), ruténio (Ru), rénio (Re), ródio (Rh),[8] vanádio (V)[9] ou fósforo (P).[10] Outras formas são também aceites, inclusive O2GeF5 e (O2)2SnF6.[9]
Os sais de tetrafluoroborato e hexafluorofosfato podem ser preparados pela reação de difluoreto de dioxigénio com trifluoreto de boro ou pentafluoreto de fósforo a −126 °C:[10]
- 2 O2F2 + 2 BF3 → 2 O2BF4 + F2
- 2 O2F2 + 2 PF5 → 2 O2PF6 + F2
Estes compostos decompõem-se rapidamente à temperatura ambiente:
- 2 O2BF4 → 2 O2 + F2 + 2 BF3
- 2 O2PF6 → 2 O2 + F2 + 2 PF5
Reacções
A reacção de O2BF4 com xénona 173 K produz um sólido branco que se acredita ser F–Xe–BF2, contendo uma incomum ligação xénon-boro:[11]
- 2 O2BF4 + 2 Xe → 2 O2 + F2 + 2 FXeBF2
Os sais de dioxigenil O2BF4 e O2AsF6 reagem com monóxido de carbono para dar origem a flureto de oxalilo, C2O2F2, em alto rendimento.[12]
Referências
Wikiwand - on
Seamless Wikipedia browsing. On steroids.