Siarczek molibdenu(IV)
związek chemiczny Z Wikipedii, wolnej encyklopedii
Disiarczek molibdenu – nieorganiczny związek chemiczny z grupy siarczków, sól kwasu siarkowodorowego i molibdenu na IV stopniu utlenienia. Występuje w dwóch odmianach – heksagonalnej, w postaci minerału molibdenitu, najważniejszej rudy, z której otrzymuje się molibden[3], i trygonalnej. Jest diamagnetykiem i półprzewodnikiem[7]. Pod potoczną nazwą molikot[8] stosowany jest także jako smar stały, dodatek do smarów i katalizator[3]. Znalazł również zastosowanie jako pokrycie pocisków, jako środek zmniejszający tarcie o lufę. Podobne zastosowanie ma disiarczek wolframu i heksagonalny azotek boru[9].
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
MoS2 | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
160,07 g/mol | ||||||||||||||||||||||||||||||||||||||
| Wygląd |
czarny bezwonny proszek[1] | ||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||
Otrzymywanie
Głównym sposobem otrzymywania disiarczku molibdenu jest jego wydobywanie z naturalnych złóż molibdenitu. Może zostać także otrzymany bezpośrednio z molibdenu i siarki w wysokiej temperaturze i przy zmniejszonym ciśnieniu. W takich warunkach, mogą powstawać inne siarczki molibdenu, które jednak przekształcają się w bardziej stabilny disiarczek[3].
Disiarczek molibdenu można także otrzymać poprzez ogrzewanie tritlenku molibdenu z siarkowodorem lub siarką. Innym sposobem jest reakcja pentachlorku molibdenu z roztworem siarczku sodu[3]:
- 2MoCl5 + 5Na2S → 2MoS2 + 10NaCl + S
Powstaje także w reakcji molibdenu z tetratiomolibdenianem amonu [(NH4)2MoS4] lub trisiarczkiem molibdenu w temperaturze 1100 °C[7].
Związek o strukturze trygonalnej otrzymuje się poprzez ogrzewanie w temperaturze 1200 °C heksagonalnego disiarczku molibdenu pod ciśnieniem 7,5 GPa lub w reakcji tritlenku molibdenu z siarką i węglanem potasu[7].
Właściwości
Podsumowanie
Perspektywa
Disiarczek molibdenu występuje w postaci czarnego proszku lub kryształów. Twardość w skali Mohsa wynosi 1,3. Jest nierozpuszczalny w wodzie i rozcieńczonych kwasach. Rozpuszcza się natomiast w stężonych kwasach utleniających, m.in. wodzie królewskiej i gorącym kwasie siarkowym[3], dając odpowiednie związki molibdenu(IV). W temperaturze 250–400 °C ma postać amorficzną. Krystalizacja wymaga dłuższego ogrzewania w 1100 °C[7].
Związek ten jest stabilny i nie reaguje z tlenem z powietrza w normalnych temperaturach. W 500 °C, tworzy tritlenek molibdenu[3][7]:
- 2MoS2 + 9O2 → 2MoO3 + 4SO3
Podobnie zachowuje się w stosunku do chloru[3]:
- 2MoS2 + 7Cl2 → 2MoCl5 + 2S2Cl2
Ogrzewanie w 1200 °C i pod zmniejszonym ciśnieniem powoduje rozkład do molibdenu i trisiarczku molibdenu. W wyniku redukcji disiarczku molibdenu wodorem w temperaturach 1100 °C lub powyżej 1500 °C powstaje odpowiednio trisiarczek molibdenu lub molibden[7]
Disiarczek molibdenu reaguje w odpowiednich warunkach z alkilolitami tworząc związki interkalacyjne o wzorze ogólnym LixMoS2[3].
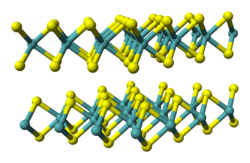
Właściwości smarne disiarczku molibdenu wynikają z jego warstwowej budowy krystalicznej (zobacz też: grafit). Słabe siły van der Waalsa pomiędzy warstwami atomów siarki umożliwiają łatwe przemieszczanie się tych warstw względem siebie, zmniejszając tarcie przesuwanych elementów. Natomiast silne spolaryzowane wiązania kowalencyjne pomiędzy atomami molibdenu i siarki zwiększają wytrzymałość na czynniki mechaniczne[7][10].
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.