Etyn
związek chemiczny Z Wikipedii, wolnej encyklopedii
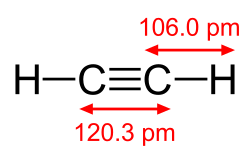
Etyn, acetylen, C
2H
2 – organiczny związek chemiczny, najprostszy węglowodór nienasycony z szeregu homologicznego alkinów.
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C2H2 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
HCCH, HC≡CH, H−C≡C−H | ||||||||||||||||||||||||||||||||
| Masa molowa |
26,04 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwny i bezwonny gaz, produkt techniczny ma nieprzyjemny zapach podobny do czosnku[2] | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Podobne związki |
etan, eten, cyjanowodór, azot | ||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
Historia
Etyn odkryty został przez angielskiego chemika Edmunda Davy’ego (1785–1857) w roku 1836[7]. Davy odkrycia dokonał przypadkowo, mieszając węglik potasu (K
2C
2) z wodą. Zauważył, że powstały gaz pali się jasnym płomieniem i stwierdził, że może on być wykorzystywany jako źródło światła. Z uwagi jednak na wysoką cenę węgliku potasu było to nieopłacalne do momentu, gdy niemiecki chemik Friedrich Wöhler odkrył węglik wapnia, co spowodowało wzrost popytu na etyn do lamp i innych zastosowań[8].
Właściwości
- kąty pomiędzy wiązaniami: 180°
- gęstość względem powietrza: 0,906
- szerokie granice wybuchowości w powietrzu: 2,4–83% obj.
- czysty acetylen nie ma zapachu, jednak zwykle zawiera zanieczyszczenia związkami siarki i fosforu (głównie PH
3 i H
2S[9]), które nadają mu nieprzyjemny zapach[10] - bardzo słabo rozpuszczalny w wodzie i innych rozpuszczalnikach polarnych – jednak bardzo dobrze w acetonie
- po osiągnięciu pewnego ciśnienia ulega wybuchowemu rozkładowi według reakcji:
- C
2H
2 → 2C + H
2
- wobec węgla aktywnego (jako katalizatora) ulega reakcji polimeryzacji najpierw do winyloacetylenu a później benzenu
- na powietrzu (zawierającym 21% tlenu) spala się niecałkowicie, z powodu bardzo dużej procentowej zawartości węgla w cząsteczce (92,3%):
- 2C
2H
2 + O
2 → 4C + 2H
2O - Ze względu na to w spawalnictwie (w palnikach acetylenowo-tlenowych) stosuje się czysty tlen, aby reakcja spalania była całkowita.
- ulega reakcji addycji (przyłączenia)
- ulega reakcjom spalania
Otrzymywanie
- CaC
2 + 2H
2O → C
2H
2 + Ca(OH)
2
Niewielkie ilości tego gazu powstają również w łuku elektrycznym wytworzonym w atmosferze wodoru pomiędzy elektrodami grafitowymi:
- 2C + H
2 → C
2H
2
- piroliza metanu CH
4 (w temperaturze 2000 °C)
- 2CH
4 → C
2H
2 + 3H
2
- eliminacja fluorowca
- C
2H
2Cl
2 + Zn → C
2H
2 + ZnCl
2
Zastosowanie
- w palnikach acetylenowo-tlenowych do spawania i cięcia metali (acetylen w dużej ilości tlenu spala się w temperaturze 3100 °C)
- w lampie acetylenowej do oświetlania
- w przemyśle chemicznym, między innymi, do produkcji tworzyw sztucznych
- acetylen o wysokiej czystości stosowany może być do narkozy, jako tzw. narcylen[9][11]
Przechowywanie
Acetylen przechowuje się w butlach stalowych, pod ciśnieniem 1,2 MPa, w postaci roztworu w acetonie. Butle są wypełnione porowatą masą, która absorbuje aceton i acetylen.
Toksykologia
Acetylen zaliczany jest do gazów „duszących fizycznie”. Wykazuje działanie narkotyczne. Nie jest bezpośrednio toksyczny dla błon śluzowych układu oddechowego, jednakże poprzez zmniejszenie ilości tlenu w powietrzu powoduje hipoksję, której objawami mogą być zaburzenia ruchowe, przyśpieszenie akcji serca, przyśpieszenie oddechu i trudności w koncentracji. W przypadku stężeń powyżej 50% mogą pojawiać się nudności, wymioty, skrajne wyczerpanie, zaburzenia świadomości oraz zapaść prowadząca do zgonu w wyniku asfiksji. Najczęściej jednak acetylen powoduje wybuch, zanim osiągnie stężenie działające dusząco[12][13].
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.