Top Qs
Tijdlijn
Chat
Perspectief
Chlooramine
chemische stof Van Wikipedia, de vrije encyclopedie
Remove ads
Chlooramine kan betrekking hebben op zowel die hieronder besproken verbinding, , of op en lid van de groep chlooramines, verbindingen waarin een chloor-atoom direct aan een stikstof-atoom gekoppeld is dat verder nog andere, eventueel organische substituenten draagt.
Remove ads
(Mono)chlooramine
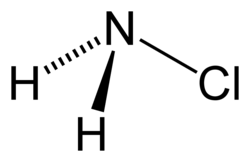
Chlooramine, ook monochlooramine genoemd als duidelijk onderscheid gemaakt moet worden met dichlooramine, is een chemische verbnding met de formule .[3] Samen met dichlooramine en stikstoftrichloride is het een van de drie gechlorieerde derivaten van ammoniak.[4] Bij het smeltpunt van -66 °C is het een kleurloze vloeistof. Het wordt doorgaans in de handel gebracht als een verdunde oplossing in water, die soms ook als ontsmettingsmiddel gebruikt wordt. De stof is te instabiel om het kookpunt te bepalen.[5]
Remove ads
Behandeling van water
Samenvatten
Perspectief
Chlooramine wordt toegepast als ontsmettingsmiddel voor water. Het is minder agressief dan chloor en stabieler ten opzichte van licht dan hypochloriet.[6]
Drinkwater
De tekst in deze paragraaf is vooral gebaseerd op de situatie in de Verenigde Staten.
Chlooramine wordt in lage concentraties toegepast als tweedelijns ontsmettingsmiddel door drinkwaterbedrijven. Dit gebeurt in toenemende mate vooral ter vervanging van het eerder gebruikelijke chloor. Ten opzichte van chloor heeft chlooramine het voordeel dat het minder reactief is en minder snel uiteen valt. Chloramine is ook minder, maar wel een beetje, in staat om organische verbindingen te chloreren waarbij onder andere chloroform en tetra kunnen ontstaan. Van dergelijke verbindingen is aangetoond dat ze carcinogeen zijn. In de VS is vanaf 1979 regelgeving van kracht met betrekking tot de toegestane concentraties ervan in drinkwater.[7] Naast de aan regelgeving onderhevige reactieproducten zijn er echter ook een aantal die niet onder enige regelgeving vallen, maar waarvan vermoed wordt dat ze een groter risico voor de volksgezondheid vormen dan de wek-gereguleerde stoffen.[8]
In water geeft chloramine een (zeer) zwak zure oplossing, wat de kans op blootstelling aan lood, en daarmee loodvergiftiging, vergroot. Vooral in oudere gebouwen komen nog veel loden waterleidingen voor. Bij het gebruik van chloor als ontsmettingsmiddel treedt dit probleem veel minder op, omdat het uit chloor ontstane chloride-ion met lood-ionen het in koud water slecht oplosbare lood(II)chloride vormt. Het toevoegen van basisch reagerende stoffen aan het drinkwater omzeilt het optreden van te hoge loodconcentraties daarin.[9]
Zwembadwater
Wat in onderstaande alinea vermeld staat voor chlooramine geldt ook voor dichlooramine en stikstoftrichloride (trichlooramine).
In zwembaden ontstaat chlooramine vooral via de reactie van chloor met aminogroepen afkomstig uit organische verbindingen. In zwembadwater zijn deze verbinduingen vooral van biologische oorsprong, met name ureum dat afkomstig is uit zweet en urine. In vergelijking met chloor is chlooramine zowel een slechtere ontsmetter en, als bij slecht beheer, irritanter voor de ogen van zwemmers. De typische "chloorlucht" van zwembaden kan grotendeels geweten worden aan chlooramine.[10][11] Sommige commercieel verkrijgbare testsets voor thuisgebruik maken geen onderscheid tussen chloor en chlooramines wat aanleiding kan zijn tot niet-optimale chlooramine-concentraties.[12]
Chlooramines kunnen bij zwemmers ademhalingsperoblemen verergeren, tot astma toe.[13] Aan chlooramines gerelateerde ademhalingsproblemen komen bij wedstrijdzwemmers veel voor.[14]
Hoewel de karakteristieke geur van chlooramines door sommige mensen als prettig of zelfs nostalgisch wordt omschreven,[15] is de vorming ervan in zwembadwater het resultaat van het blootstellen van lichaamsvloeistoffen aan chloor. Maatregelen ter verhoging van de hygiëne, zoals douchen voor het zwemmen,[16] en niet gaan zwemmen als je last hebt van darmproblemen zullen daar een positief (chlooramine verlagend) effect op hebben. Daarnaast is uiteraard toiletbezoek (om meerdere, maar ook deze reden te preferen boven "gewoon maar laten lopen".[17][18]
Remove ads
Veiligheid
Samenvatten
Perspectief
In de VS geldt voor waterleidingbedrijven een maximale concentratie van 4 ppm gebaseerd op alle monsters die bij een bepaald bedrijf genomen zijn. Om in het algemeen aan de voorwaarden van het EPA (het federale milieuburau) ten aanzien van gehalogeneerde bijproducten te voldoen schakelen veelwaterbedrijven over van chloreren op chlooramineren. Dit levert minder van de wettelijk gereguleerde producten op, maar kan leiden tot hogere concentraties van niet gereguleerde verbindingen, zoals gejodeerde stoffen en dimethylnitrosamine.[19] [20] Van zowel de gejodeerde verbindingen als van dimethylnitrosamine is aangetoond dat ze genotoxisch zijn. Zij kunnen dan aanleiding tot mutaties geven die uiteindelijk tot kanker leiden.[20]
Een in 2024 geïdentificeerd bijproduct van chlooraminering is chloornitramide, waarvan de giftigheid op grond van moleculaire gelijkenis wel vermoed wordt, maar (nog - 2024) niet is aangetoond.[21]
Veiligheid in het milieu
Chlooramin is giftig voor bepaalde soorten vissen.[22]
Gevallen van loodvergiftiging
In het jaar 2000 schakelde het waterbedrijf van Washington D.C. van ontsmetting met chloor over op chlooramine, wat aanleiding gaf tot een hogere loodconcentratie in aan consumenten geleverd water. Deze verhoging was geheel toe te schrijven aan verouderde, niet vervangen leidingen bij eindgebruikers. Het aantal baby's met een verhoogd lood-gehalte steeg met een factor 10, bij een, fataal, geval zelfs tot 63% beven de waarden voor de eeuwwisseling.[23]
In Trenton, Missouri had dezelfde wijziging in desinfectie tot gevolg dat bij een kwart van de huishoudens in de periode van 2017 tot 2019 hogere loodconcentraties werden gemeten dan de EPA-norm. Alleen al in 2016 werd bij 20 kindeen loodvergiftiging vastgesteld.[23]
In 2023 werd het verschijnsel nog eens onderstreept waarbij een gebrekkige training van personeel en het verwijderen van de oude loden waterleidingen als oorzaken werden benoemd.[23] Een ander probleem wordt gevormd door het feit dat veel mensen zich nauwelijks bewust zijn van de hoe de technische installatie van hun huis is opgebouwd. Vanuit de EPA worden waterbedrijven nu verplicht een onderzoek te doen naar het (nog steeds gebruiken van) loden waterleidingen in hun gebied. Dit onderzoek moest 16 oktoiber 2024 afgeronf zijn.[24]
Remove ads
Synthese
Samenvatten
Perspectief
Chlooramine wordt in verdunbde waterige oplossing bereid in de reactier tussen ammoniak en natriumhypochloriet:
Hoewel tijdens de reactie natriumhydroxide ontstaat verloopt de reactie alleen in een licht basisch milieu (pH = 8,5 - 11,0). Dit heeft te maken met het feit dat het eigenlijk chlorerende reagens onderchlorigzuur is. Na protoneren van het hypochloriet-ion wordt de OH-groep in dat molecuul in een nucleofiele substitutie-reactie vervangen door de amino-groep. De reactie verloopt het snelst bij pH = 8. Is de pH hoger dan wordt de concentratie HClO snel lager, bij lagere pH wordt ammoniak geprotoneerd en kan niet meer als nucleofiel werken.
De ontstane oplossing van chlooramine kan geconcentreerd worden met behulp van vacuümdestillatie. De damp wordt hierbij door kaliumcarbonaat geleid, dat water absorbeert. Chlooramine kan ook geëxtraheerd worden met behulp van ether.
Technische productie
In een gasreactie kan gasvormig chlooramine verkregen worden uit ammoniak- en chloorgas (verdund met stikstofgas):
Zuiver chlooramine kan verkregen worden door fluoramine over calciumchloride te leiden:
Remove ads
Chemische reacties
Samenvatten
Perspectief
Chlooramine is in geconcentreerde vorm een zeer instabiele verbinding. Puur chlooramine ontleed boven -40 °C.[26] Gasvormig chlooramine (lage druk!) en waterige oplossingen met een lage concentratie zijn stabieler. Chlooramine is goed en makkelijk oplosbaar in de polaire oplosmiddelen water en ether, maar slechter in de minder of niet polaire vloeistoffen als chloroform en tetra.[6]
Ontleding met water
De covalente binding tussen chloor en stikstof wordt makkelijk gehydrolyseerd, waarbij weer onderchlorigzuur ontstaat:[27]
Dit is precies de terugreactie van de synthese, wat aangeeft dat de vorming van chlooramine uit ammoniak en onderchlorigzuur eigenlijk een evenwichtsreactie is. De twee reacties kunnen ook gecombineerd worden tot:[28]
- met
Naast de evenwichtsreactie waarin chlooramine in evenwicht is met ammoniak en onderchlorigzuur vindt in een neutraal of zwak basisch milieu (pH ≤ 11) ook ontleding plaats naar stikstof en ammoniumchloride. Dit is echter een trage reactie: het kost meerdere weken om slechts enkele procenten van een 0,1 mol·L-1-oplossing via deze route om te zetten:
Wordr de pH groter dan 11 dan gaat de volgende reactie met hydroxide langzaam verlopen:
Disproportionering
In een zuur milieu, pH ≈ 4, disproportioneert chlooramine naar dichlooramine en ammonium. Bij pH-waarden lager dan 3 leidt een volgende stap in deze reactieserie naar trichlooramide, meestal stikstoftrichloride genoemd:
Hoewel beide reacties evenwichten zijn, wordt door het protoneren van de gevormde ammoniak de terugreactie geblokeerd bij de lage pH-waarden. In het pH-gebied tussen 3 en 5 domineert dichlooramine, eronder trichlooramine, erboven het (mono)chlooramine.
De evenwichten worden bovendien verstoord door de irreversibele ontleding van de twee hogere chlooramines:
In water reageert chlooramine pH-neutraal, wat ook uit de pKz- en pKb-waarde blijkt. Het is wel een oxiderend reagens: E° = 1,48 V (zure oplossing) en 0,81 V (basisch):[6]
De reacties van chlooramine omvatten zowel radicaal-, nucleofiele- als elektrofiele substitutiereacties van chloor naast elektrofiele substitutie van waterstof en oxidatieve addities.
Cl als elektrofiel
Uit chlooramine kan, net als vanuit onderchlorigzuur, positief geladen chloor overgedragen worden op een nucleofiel (Nu-:
Voorbeelden van deze soort reactie is de ontleding van chlooramine naar dichlooramine en stikstoftrichloride, zoals bij de disproportioneringsreactie besproken is.
NH2 als elektrofiel
Met chlooramine kunnen nucleofielen reageren, waarbij het chloor-atoom als chloride vertrekt:
Het amineren van ammoniak met chlooramine waarbij hydrazine ontstaat (het Olin Raschig process) is een voorbeeld van deze reactie:
Chlooramine voert een elektrofiele amineringert zichzelf uit in de eerste stap van zijn ontleding:
Het gevormde chloorhydrazine is instabiel en ontleed met behulp van een extra molecuul chlooramine tot d euiteindelijke reactieproducten:
Chlooramine is in staat thiolen en disulfides te oxideren, vergelijkbaar met onderchlorigzuur,[29] maar slechts met 0,4% van het ontsmettingsvermogen van .[30]
Remove ads
Zie ook
- Ontsmettingsmiddel
- Ontsmettingsbijproducten
- Waterzuivering
- Pathogeen
- Chlooramines
Externe links
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/cf3307b4a8187021c7db579f3add7de0cd0cb4b8)

![{\displaystyle {\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {NCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fb52b868eeb5eeacc52f5a102bc1ffe800a7b5bb)



![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {NaClO} ~\ \longrightarrow \ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ \mathrm {NaOH} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/868cf311e83d7a65911b2ef859cead248874ce6f)

![{\displaystyle {2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}~\ \longrightarrow \ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\downarrow }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/63e6aa2ed0000ea12e87503ef48d68b545aaa911)
![{\displaystyle {2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {F} ~\ {}+{}\ \mathrm {CaCl} {\vphantom {A}}_{\smash[{t}]{2}}~\ \longrightarrow \ 2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ \mathrm {CaF} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/a117d80239c8d5a623413bd1fd71dc4be04a41b1)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ \mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} ~\ \longrightarrow \ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {HClO} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/e87e444e9f227066686138f20132caa5d36ec72c)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {HClO} ~\ {\vphantom {A}}_{\smash[{t}]{\longleftarrow }}{\vphantom {A}}^{\longrightarrow }\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ \mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/11840bb58f3df02917e704956a04843af96adbc2)
![{\displaystyle {\mathrm {K} ~\ {}={}\ {\frac {[\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}]\,{\cdot }\,[\mathrm {HClO} ]}{[\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ]}}~\ 1\,{\text{,}}{\vphantom {A}}_{\smash[{t}]{8}}\,{\cdot }\,10{\vphantom {A}}^{-10}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/e02a3ff6f8b7178d4ef2667537891f9f40136b72)
![{\displaystyle {3\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ \longrightarrow \ \mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {Cl} ~\ {}+{}\ 2\,\mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/725e0f4d70c3695768d4f3faf50b6a8da21d66b2)
![{\displaystyle {3\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ 3\,\mathrm {OH} {\vphantom {A}}^{-}~\ \longrightarrow \ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ 3\,\mathrm {Cl} {\vphantom {A}}^{-}~\ {}+{}\ 3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/e6d6d5279b689474ae55cc81b15c806cab1b9ca2)
![{\displaystyle {2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {\vphantom {A}}_{\smash[{t}]{\longleftarrow }}{\vphantom {A}}^{\longrightarrow }\ \mathrm {NHCl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/9bd213ddeee8092b5c93a83e8ddd6bb7a80604af)
![{\displaystyle {3\,\mathrm {NHCl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {\vphantom {A}}_{\smash[{t}]{\longleftarrow }}{\vphantom {A}}^{\longrightarrow }\ 2\,\mathrm {NCl} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/069bb3613c57c21cbf3fa7bc3555ce1ef51cc196)
![{\displaystyle {\mathrm {NHCl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {NCl} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} ~\ \longrightarrow \ \mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ 3\,\mathrm {HCl} ~\ {}+{}\ 2\,\mathrm {HClO} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/84f40a31bf99bed28409ed417780155e72e3b9dc)
 ,
,  ...
...![{\displaystyle {\mathrm {Nu} {\vphantom {A}}^{-}~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {Cl} {\vphantom {A}}^{+}~\ \longrightarrow \ \mathrm {NuCl} ~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/d8880f42a7dab8a7cbedffff7d89ac54619f831a)
![{\displaystyle {\mathrm {Nu} {\vphantom {A}}^{-}~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ \longrightarrow \ \mathrm {NuNH} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {Cl} {\vphantom {A}}^{-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8f4c4a00f95cd5f38b4adc9dffdeaffe778138bd)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {NaOH} ~\ \longrightarrow \ \mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{4}}~\ {}+{}\ \mathrm {NaCl} ~\ {}+{}\ \mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b6cf42708eb0c5d50f29b48ea363e23c2718ea6b)
![{\displaystyle {2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ \longrightarrow \ \mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {Cl} ~\ {}+{}\ \mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b947577682124e80c22d993774ac6b5417adb26f)
![{\displaystyle {\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {Cl} ~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {CL} ~\ \longrightarrow \ \mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {Cl} ~\ {}+{}\ \mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/883eead30fb4fa0f9c8e8cc59cac9209745248fe)
