From Wikipedia, the free encyclopedia
Актин — семејство на глобуларни мултифункционални белковини кои образуваат микрофиламенти. Се среќава во скоро сите еукариотски клетки (единствениот исклучок се сперматозоидите на цевчестите црви), каде може да биде присутен во концентрации над 100 μM.
| Актин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Лента дијаграм на G-актинот. Прикажани се и аденозин дифосфатот (ADP), врзан за актинскиот активен центар, и комплексираниот калциумов јон. | |||||||||
| Назнаки | |||||||||
| Симбол | Актин | ||||||||
| Pfam | PF00022 | ||||||||
| InterPro | IPR004000 | ||||||||
| PROSITE | PDOC00340 | ||||||||
| SCOP | 2btf | ||||||||
| SUPERFAMILY | 2btf | ||||||||
| |||||||||
Актинот претставува мономерна подединица на два вида на филаменти во клетките: микрофиламенти, кои се една од трите главни компоненти на цитоскелетот, и тенки филаменти, кои се дел од контрактилниот систем на мускулните клетки. Во клетките може да биде присутен или како слободен мономер, наречен G-актин (односно глобуларен актин), или како дел од линеарен, полимерен микрофиламент наречен F-актин (односно филаментозен актин). И двата типа на актин се неопходни за одвивањето на основните клеточни процеси, како што се клеточниот мотилитет и контракцијата на клетката при клеточната делба.
Актинот учествува во мноштво на значајни клеточни процеси, како што се: клеточниот мотилитет, клеточната делба и цитокинезата, движењето на клеточните органели и везикули, клеточната сигнализација, мускулната контракција, воспоставувањето и одржувањето на меѓуклеточните врски (мостови) и клеточната форма. Многу од овие процеси се посредувани од екстензивни интеракции помеѓу актинот и клеточните мембрани.[1] Кај `рбетниците идентификувани се три главни групи на изоформи на актинот: алфа, бета и гама актин. Алфа актините, кои се наоѓаат во мускулните ткива, се важна компонента на контрактилниот систем. Бета и гама актините се наоѓаат во повеќето типови на клетки, како компоненти на цитоскелетот и како медијатори на внатрешноклеточниот мотилитет. Се верува дека ваквата разновидност на структури кои може да ги формира актинот, што му овозможува да извршува разновидни функции, е регулирана од врзувањето на тропомиозинот долж актинските филаменти.[2]
Способноста на клетката динамички да создава микрофиламенти ѝ овозможува брзо да се реорганизира како одговор на надворешни или внатрешни сигнали; на пример, да ја зголеми апсорпцијата на клеточната мембрана или да ја зголеми клеточната атхезија за да формира ткиво. Други ензими или органели, како што се на пример трепките (цилиите), можат да се закотват за „скелето“ од микрофиламенти за да ја контролираат деформацијата на надворешната клеточна мембрана, што овозможува ендоцитоза и цитокинеза. Скелето од микрофиламенти може да продуцира движење во клетката, или само по себе или со помош на молекуларни мотори. Затоа актинот придонесува за процеси како што се внатрешноклеточниот транспорт на везикули и органели, клеточната миграција и контракцијата на мускулите. Оттука може да се заклучи дека тој игра улога во процесите како што се ембриогенезата, заздравувањето на раните и инвазивноста на канцерските клетки. Иако актинот не е присутен во прокариотските клетки, тие имаат белковини кои вршат слична функција.[3] Актинските хомолози кај бактериите и археите можат да полимеризираат во различни хеликални или линеарни филаменти кои се изградени од една или повеќе нишки. И покрај разликите помеѓу еукариотските актини и нивните прокариотски хомолози, тие имаат две заеднички одлики: местото за врзување на нуклеотидот и контактите кои се формираат внатре во нишката.[4]

Актинот за првпат бил експериментално опсервиран во 1887 година од страна на британскиот физиолог Вилијам Добинсон Халибуртон, кој го екстрахирал од мускулно ткиво.[5] Бидејќи Халибуртон не бил во можност понатаму да ги развие своите наоди, откритието на актинот најчесто се припишува на унгарскиот биохемичар Бруно Ференц Штрауб, кој работел во лабораторијата на Алберт Сент-Ѓерѓи при Институтот за медицинска хемија на Сегедскиот универзитет во Унгарија.
Во 1942 година, Штрауб развил нова техника за екстракција на мускулни белковини, која му овозможила да изолира големи количества на релативно чист актин. Неговиот метод и до ден денес е во употреба во лабораториите. Алберт Сент-Ѓерѓи претходно веќе ја имал опишано повискозната форма на миозинот, добиена со бавна екстракција од мускулно ткиво, како „активиран“ миозин, а бидејќи белковината на Штрауб ја имала способноста да го создава активирачкиот ефект, таа била наречена актин. Додавањето на ATP во смесата од двете белковини (наречена актомиозин) предизвикало намалување на вискозноста на растворот. Непријателствата во текот на Втората светска војна им оневозможиле на Штрауб и Сент-Ѓерѓи да го објават своето откритие во западните научни списанија. Затоа знаењето за актинот се проширило на западот дури по 1945 година, кога научниот труд на Штрауб и Сент-Ѓерѓи бил објавен како додаток во списанието Acta Physiologica Scandinavica.[6] Штрауб продолжил да работи на изучување на актинот, па во 1950 година објавил дека актинот има способност да врзе ATP[7] и дека ATP се хидролизира на ADP и неоргански фосфат во текот на полимеризацијата на актинот во микрофиламенти, кои остануваат врзани за микрофиламентот. Штрауб предложил дека трансформацијата на актин-ATP комплексот во актин-ADP комплекс игра улога во контракцијата на мускулите. Меѓутоа ова тврдење е точно само за мазното мускулно ткиво, а експериментално било потврдено дури во 2001 година.[7][8]
Секвенционирањето на актинот било комплетирано во 1973 година, од страна на М. Елзинга и соработниците.[9] Кристалната структура на G-актинот била објавена во 1990 година, од страна на Кабш и соработниците.[10] Истата година бил предложен модел за структурата на F-актинот, од страна на Холмс и соработниците.[11] Во текот на следните години, процедурата на кокристализација со различни белковини била постојано користена, сè додека во 2001 година не бил добиен чист кристал на актин со врзан ADP. Сепак, сè уште не е добиена структура на F-актинот со висока резолуција по пат на рендгенска дифракција. Кристализацијата на F-актинот била можна поради употребата на родамински конјугат, кој ја спречува полимеризацијата со блокирање на аминокиселинскиот остаток cys-374.[12]
Иако сè уште не постои високорезолуционен модел за структурата на F-актинот, во 2008 година тимот на Саваја бил во можност да добие поточен модел за неговата структура, врз основа на повеќе кристали на актински димери кои се меѓусебно поврзани на различни места.[13] Овој модел бил понатаму уште повеќе усовршен од страна на Саваја и Лоренц. Други пристапи, како што се употребата на криоелектронска микроскопија и синхронтронско зрачење, во поново време имаат овозможено добивање на повисока резолуција и подобро разбирање на природата на интеракциите и конформационите промени кои се одговорни за формирањето на актинските филаменти.[14][15][16]
Аминокиселинската низа на актинот е една од најсочуваните во споредба со сите други белковини, бидејќи не претрпела многу промени во текот на еволуцијата. Идентичноста во аминокиселинската низа помеѓу човечкиот и квасниот актин е 85 %, додека помеѓу човечкиот и актинот на амебата Dictyostelium таа е 98 %.[17] Затоа се смета дека актинот има оптимизирана структура.[3] Актинот може да се смета и за ензим чија реакција е бавна хидролиза на ATP, а улогата на оваа реакција е да го одржи структурниот интегритет на актинската молекула. Актинската структура се формира по пат на уникатен процес на склопување. Тој стапува во многу повеќе интеракции од која било друга белковина, што му овозможува да извршува многу повеќе функции во однос на другите белковини, на секое ниво од клеточниот живот.[3] Миозинот е пример за белковина која се врзува за актинот. Друг пример е вилинот, кој може да го „ткае“ актинот во снопови или да ги сече актинските филаменти, во зависност од концентрацијата на Ca++ катјоните во околината.[18]
Актинот е еден од најзастапените белковини во еукариотските клетки, и е распространет низ целата цитоплазма.[18] Во миоцитите, актинот сочинува околу 20 % од вкупната белковинска маса, а во другите типови на клетки оваа вредност изнесува помеѓу 1 % и 5 %. Постојат повеќе типови на актин, бидејќи гените кои кодираат за актин претставуваат цело генско семејство (кај растенијата оваа фамилија содржи повеќе од 60 елементи, вклучувајќи гени и псевдогени, додека кај човекот таа содржи повеќе од 30 елементи).[3][19] Ова значи дека генетската информација на секоја единка содржи инструкции кои создаваат повеќе варијанти на актинот (наречени изоформи), кои имаат нешто поразлични функции. Еукариотските организми вршат експресија на различни гени чии производи се: α-актин, кој е дел од контрактилните структури; β-актин, кој се наоѓа во експанзиониот раб на клетките кои ја користат проекцијата на своите клеточни структури како начин за подвижност; и γ-актин, кој се наоѓа во филаментите на стрес влакната.[20] Актинот има свои хомолози и во другите домени на животот; кај бактериите тоа е белковината MreB (скратеница од англ., Murein region ‘e’ B), кој е способен да полимеризира во микрофиламенти;[3][15] додека кај археите тоа е белковината ТаО583, кој е посличен со еукариотскиот актин.[21]
Клеточниот актин има две форми: мономерни глобули, наречени G-актин, и полимерни филаменти, наречени F-актин (т.е. филаменти составени од повеќе G-актински мономери). F-актинот, исто така, може да се опише како микрофиламент. Две паралелни нишки од F-актин мора да свртат за 166 степени за да можат да лежат точно една врз друга. На овој начин се создава структурата на двојна завојница на микрофиламентите од цитоскелетот. Микрофиламентите имаат пречник од приближно 7 nm, а завојницата се повторува на секои 37 nm. Секоја актинска молекула врзува молекула на ADP или ATP, која пак е врзана за Mg++ катјон. Споредено со сите можни комбинации, најчестите форми на актин се ATP-G-актин и ADP-F-актин.[22][23]
Сликите добиени од скенирачки електронски микроскоп покажуваат дека G-актинот има глобуларна структура; сепак, рендгенската кристалографија покажува дека секоја од овие глобули се состои од два лобуса разделени со расцеп (пукнатина). Оваа структура го претставува „ATP-азниот склоп“, кој е центарот на ензимската катализа која врзува ATP и Mg++. Овој склоп е сочуван структурен мотив, а се среќава и кај другите белковини кои стапуваат во интеракција со трифосфатни нуклеотиди.[24] G-актинот е функционален само ако содржи ATP или ADP во својата пукнатина, а формата која преовладува во клетките е онаа која врзува ATP.[22]

Кристалографскиот модел на актин добиен од Кабш е најчесто употребуваниот во структурните студии, бидејќи бил првиот кој бил прочистен. G-актинот кристализиран од Кабш има големина од околу 67 x 40 x 37 Å, молекуларна маса од 41,785 Da и изоелектрична точка од 4,8. Неговиот нето полнеж, при pH = 7, изнесува -7.[9][25]
Комплетната пептидна низа на G-актинот првпат била утврдена во 1973 година, од страна на Елзинга и соработниците. Таа се состои од 374 аминокиселински остатоци. N-терминалот има изразено кисел карактер и започнува со ацетилиран аспартатен остаток, каде е ацетилирана аминогрупата. C-терминалот има алкален карактер и се состои од фенилаланин кој му претходи во низата на цистеински остаток, кој има одреден степен на функционална значајност. Двата краја се наоѓаат во непосредна близина во рамките на поддоменот I. На позиција 73 се наоѓа невообичаениот NT-метилхистидински остаток.[25]
Третичната структура се состои од два домена, познати како голем домен и мал домен, кои се одделени со расцеп (пукнатина) кој е блиску до локацијата за врзување на ATP/ADP+Pi. Подолу од расцепот се наоѓа подлабоко место кое е наречено „жлеб“. Во нативната состојба, и покрај нивните имиња, и двете места имаат споредлива длабочина.[9]
Според вообичаената конвенција во тополошките студии, белковината е прикажана така што најголемиот домен се наоѓа на левата страна, а најмалиот домен се наоѓа на десната страна. Кај актинот, во ваква позиција, помалиот домен е поделен на два поддомени: поддомен I (долна положба, аминокиселински остатоци 1-32, 70-144 и 338-374) и поддомен II (горна положба, остатоци 33-69). Поголемиот домен е, исто така, поделен на два поддомена: поддомен III (долна положба, остатоци 145-180 и 270-337) и поддомен IV (горна положба, остатоци 181-269). Изложените делови на поддомените I и III се нарекуваат „бодликави“ краеви, додека изложените делови на поддомените II и IV се нарекуваат „шилести“ краеви. Оваа номенклатура алудира на фактот дека, поради малата маса на поддоменот II, актинот е поларен, за што во поголеми детали ќе биде дискутирано подолу во текстот. Некои автори поддомените ги именуваат Ia, Ib, IIa и IIb, соодветно.
Најзабележителната супервторична структура кај актинот е бета-плоча составена од пет бета нишки, кои се организирани во β-меандра и β-α-β единица со насока на часовникот. Оваа супервторична структура ја има во двата актински домени, што сугерира дека белковината настанала како резултат на генска дупликација.[10]
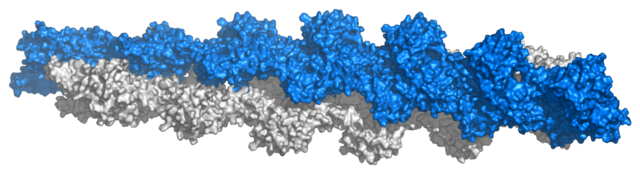
Класичниот опис на F-актинот гласи дека тој претставува филаментозна структура која може да се смета како едноверижен левовртечла завојница, со свртување од 166° околу завојната оска и осна транслација од 27,5 Å, или како едноверижна десновртеча завојница, со накрсно растојание од 350-380 Å, каде секој актин е опкружен со четири други актини. Симетријата на актинскиот полимер кај 2,17 подединици при едно свртување на завојницата е некомпатибилна со формирањето на кристали, што е единствено можно со симетрија од точно 2, 3, 4 или 6 подединици при едно свртување. Затоа треба да се конструираат модели кои ги објаснуваат овие аномалии со употреба на податоци од електронска микроскопија, криоелектронска микроскопија, кристализација на димери во различни положби и дифракција на рендгенски зраци.[15][16] Треба да се нагласи дека не е точно да се зборува за „структура“ кај една толку динамична молекула како што е актинскиот филамент. Во реалноста станува збор за различни структурни состојби, кај кои вредноста на осната транслација останува константна на 27,5 Å, додека податоците за ротацијата на подединицата покажуваат значителна варијабилност, со поместувања до 10% од нејзината оптимална положба, која најчесто се набљудува. Некои белковини, како што е кофилинот, се чини дека го зголемуваат аголот на свртување, но ова може да се толкува како воспоставување на различни структурни состојби. Овие може да бидат значајни во процесот на полимеризација.[26]
Што се однесува на вредностите на полупречникот на свртување и дебелината на филаментите, постои помала согласност: додека првите модели измериле должина од 25 Å, поновите кристалографски податоци, поддржани од криоелектронска микроскопија, наведуваат должина од 23,7 Å. Овие истражувања ги имаат идентификувано контактните точки помеѓу мономерите. Некои се формираат со единици на истиот синџир, помеѓу „бодликавиот“ крај на еден мономер и „шилестиот“ крај на следниот мономер. Мономерите од соседните синџири прават латерални (странични) контакти преку проекции од поддоменот IV, каде најважните проекции се оние формирани од C-терминалот и хидрофобната врска формирана од три тела кои ги вклучуваат аминокиселинските остатоци 39-42, 201-203 и 286. Овој модел сугерира дека филаментот е изграден од мономери во формација на „плоча“, во која поддомените се свртуваат околу себе. Оваа форма, исто така, се среќава и кај бактерискиот актински хомолог MreB.[15]
F-актинскиот полимер се смета дека има структурен поларитет поради фактот што сите подединици на микрофиламентот се насочени кон истиот крај. Одовде конвенцијата за именување: крајот што поседува актинска подединица чие место за врзување на ATP е изложено се нарекува „(-) крај“, додека спротивниот крај, каде местото за врзување на ATP е насочено кон соседниот мономер, се нарекува „(+) крај“.[20] Термините „шилест“ и „бодликав“, кои се однесуваат на двата краја на микрофиламентите, произлегуваат од нивниот изглед под преносна електронска микроскопија, кога примероците се испитуваат после техника на подготовка наречена „декорација“. Овој метод се состои од додавање на миозински S1 фрагменти на ткиво кое е фиксирано со танинска киселина. Овој миозин формира поларни врски со актинските мономери, што доведува до конфигурација која изгледа како стрела со перјаница долж нејзината оска, каде оската е актинот, а перјаницата е миозинот. Според оваа логика, крајот на микрофиламентот кој нема протрудирачки миозин е наречен врвот на стрелата (- крај), а другиот крај е бодликавиот крај (+ крај).[27] S1 фрагментот е составен од домените на главата и вратот на миозинот II. Во физиолошки услови, G-актинот (мономерна форма) се трансформира во F-актин (полимерна форма) со помош на ATP, каде улогата на ATP е од суштинско значење.
Хеликалниот F-актински филамент кој се наоѓа во мускулите содржи и молекула на тропомиозин, кој претставува белковина долга 40 нм, обвиткан околу F-актинската завојница.[16] За време на фазата на релаксација, тропомиозинот ги покрива активните места на актинот, така што интеракцијата помеѓу актинот и миозинот не може да се одвива за да се создаде мускулна контракција. Постојат и други белковински молекули врзани за тропомиозинската нишка, а тоа се тропонините, кои имаат три полимери: тропонин I, тропонин T и тропонин C.[28]

Актинот спонтано го стекнува поголемиот дел од својата третична структура.[29] Меѓутоа начинот на кој се здобива со својата потполно функционална форма од својата новосинтетизирана нативна форма е посебен и скоро уникатен во белковинската хемија. Причината за овој посебен пат можеби е потребата да се избегне присуство на неправилно склопени актински мономери, кои можат да бидат токсични, бидејќи можат да дејствуваат како неефикасни терминатори на полимеризацијата. Сепак, тој е клучен за стабилноста на цитоскелетот, а дополнително, тој е суштински процес за координација на клеточниот циклус.[30][31]
За правилно склопување на актинот потребен е CCT (скратеница од англ. Chaperonin containing Tcp-1), кој е група II цитозолен шаперонин. CCT е изграден од двоен прстен кој се состои од осум различни подединици (хетерооктамер) и се разликува од другите шаперонини, особено од неговиот архејски хомолог GroEL, по тоа што не бара присуство на кошаперон за „капак“ над централната каталитичка празнина. Супстратите се врзуваат за CCT преку специфични домени. Порано се сметало дека CCT стапува во интеракција само со актинот и тубулинот, но најновите студии покажале дека тој стапува во интеракција со голем број на полипептиди. Тој дејствува по пат на ATP-зависни конформациски промени, за кои повремено се потребни неколку круга на ослободување и катализа со цел да се заврши реакцијата.[32]
За да можат успешно да се склопат, и актинот и тубулинот треба да стапат во интеракција со друга белковина, наречена префолдин, кој претставува хетерохексамерен комплекс (изграден од шест различни подединици), во интеракција која е толку специфична што овие молекули имаат коеволуирано. Актинот се комплексира со префолдинот уште додека е во фаза на биосинтеза, кога е долг околу 145 аминокиселински остатоци, особено оние на N-терминалот.[33]
За препознавање на актинот и тубулинот се користат различни подединици, иако постои мало преклопување. Кај актинот, подединиците кои се врзуваат со префолдинот се веројатно PFD3 и PFD4, кои се врзуваат на две места: едното е помеѓу остатоците 60-79, а другото е помеѓу остатоците 170-198. Актинот бива препознаен, „натоварен“ и „испорачан“ до цитозолниот шаперонин (CCT) во отворена конформација.[29] Кога актинот е испорачан, контактот е толку краткотраен што не се формира третичен комплекс, а префолдинот веднаш се ослободува.[34]
CCT потоа покренува низно склопување на актинот преку формирање на врски со неговите подединици, наместо едноставно да го затвори во својата празнина.[35] За оваа цел поседува специфични области за препознавање во својот апикален β-домен. Првата фаза на склопувањето се состои од препознавањето на остатоците 245-249. Потоа други детерминанти воспоставуваат контакти.[36] И актинот и тубулинот се врзуваат за CCT во отворени конформации, во отсуство на ATP. Во случајот на актинот, две подединици се врзани за време на секоја конформациска промена, додека кај тубулинот врзувањето е за четири подединици. Актинот има специфични врзувачки подединици кои стапуваат во интеракција со δ и β-CCT подединиците или со δ-CCT и ε-CCT. По врзувањето на AMP-PNP за CCT, супстратите влегуваат во празнината на шаперонинот. Исто така, во случајот на актинот, се чини дека CAP-белковината е потребен како кофактор во последните фази на неговото склопување.[31]
Актинот е ATPаза, односно ензим кој хидролизира ATP. Оваа група на ензими се одликуваат со мала брзина на каталитичката реакција. Познато е дека оваа ATPаза е „активна“, т.е. нејзината брзина се зголемува за околу 40.000 пати кога актинот е дел од филамент.[26] Референтната вредност за оваа брзина на хидролиза во идеални услови е околу 0,3 s−1. Неорганскиот фосфат останува врзан за актинот, веднаш до ADP молекулата, релативно долго време, сè додека не се ослободи кооперативно од внатрешноста на филаментот.[37][38]
Точните молекуларни детали на каталитичкиот механизам сè уште не се потполно разјаснети. Иако има многу дебати на ова прашање, се чини сигурно дека „затворената“ конформација е потребна за хидролиза на ATP, а се смета дека аминокиселинските остатоци кои се вклучени во овој процес се придвижуваат на соодветното растојание.[26] Глутаминската киселина Glu137 е еден од клучните остатоци и се наоѓа во поддоменот I. Нејзината функција е да ја врзе молекулата на вода која нуклеофилно ја напаѓа γ-фосфатната врска на ATP, додека нуклеотидот е силно врзан за поддомените III и IV. Бавноста на каталитичкиот процес се должи на големото растојание и искривената положба на молекулата на вода во однос на реактантот. Многу е веројатно дека конформационата промена меѓу G и F формите на актинот, како резултат на ротација на домените, го поместува остатокот Glu137 поблиску, овозможувајќи ја хидролизата на ATP. Овој модел сугерира дека полимеризацијата и функцијата на ATPазата веднаш стануваат независни една од друга.[15][16] Трансформацијата од „отворена“ во „затворена“ состојба помеѓу G и F формите на актинот и нејзините импликации на релативното придвижување на неколку клучни остатоци се одликувани во молекуларната динамика и QM/MM симулациите.[39][40]
Актинот е еден од најсочуваните белковини во текот на еволуцијата бидејќи стапува во интеракција со многу други белковини.[3]
Квасните габи имаат само еден ген кој кодира за актин, но посложените еукариоти обично вршат експресија на неколку изоформи на актинот, кои ги кодира фамилија на сродни гени. Цицачите имаат најмалку шест актински изоформи кодирани од одделни гени,[41] кои се поделени во три класи врз основа на нивните изоелектрични точки: алфа, бета и гама. Алфа актините, најчесто, се среќаваат во мускулното ткиво, додека бета и гама изоформите се наоѓаат во немускулните клетки. Иако аминокиселинските низи и in vitro својствата на овие изоформи се многу слични, тие не можат да бидат заменети една за друга во in vivo услови.[42]
Типичниот ген за актин има околу 100-нуклеотиден 5’ UTR (англ. 5′ untranslated region: 5’-нетранслатирана област), 1200-нуклеотиден транслатиран регион и 200-нуклеотиден 3’ UTR (англ. 3′ untranslated region: 3’-нетранслатирана област). Повеќето актински гени поседуваат интрони.
Сите несферични прокариоти поседуваат гени кои кодираат хомолози на актинот (како што е MreB). Овие гени изгледа дека се важни за одржување на формата на прокариотската клетка. Генот ParM, кој се наоѓа во плазмидите, кодира за белковина слична на актинот чија полимерна форма е динамички нестабилна, а има особина да изврши раздвојување на плазмидската ДНК во клетките-ќерки за време на клеточната делба. Овој механизам на раздвојување на плазмидската ДНК е аналоген на улогата на микротубулите во процесот на митоза кај еукариотите.[43]

Факторите за нуклеација се неопходни за да се стимулира полимеризацијата на актинот. Еден таков фактор за нуклеација е Arp2/3 комплексот, кој имитира димер на G-актинот, со цел да ја стимулира нуклеацијата (или формирањето на првиот тример) на мономерниот G-актин. Комплексот Arp2/3 се врзува и за актински филаменти под агол од 70°, за да поттикне формирање на нови актински гранки од веќе постоечките актински филаменти. Arp2/3-посредуваната нуклеација е неопходна за одвивањето на насочената клеточна миграција.[44]
Растот на актинските филаменти го регулираат тимозинот и профилинот. Тимозинот се врзува за G-актинот за да го ублажи процесот на полимеризација, додека профилинот се врзува за G-актинот за да изврши размена на ADP за ATP, поттикнувајќи го на тој начин додавањето на мономери кон бодликавиот, односно (+), крај на F-актинските филаменти.
F-актинот е истовремено јак и динамичен. За разлика од другите видови на полимери, како што е ДНК, чии составни делови се врзани меѓу себе со јаки ковалентни врски, мономерите на актинските филаменти се врзани со послаби, нековалентни врски. Проблемот на малата јачина на овие врски е решен со формирање на латерални врски со соседните мономери. Од друга страна, предноста на слабите врски е што краевите на филаментите се динамични, па можат лесно да ослободат или да инкорпорираат мономер. Ова значи дека филаментите можат брзо да се реорганизираат и, на тој начин, да ја променат клеточната структура како одговор на одредени надворешни сигнали. Овој процес, заедно со биохемискиот механизам кој го покренува, е познат како „динамика на агрегација“.[45]
Проучувањата кои се фокусираат на акумулацијата и губењето на подединиците на микрофиламентите се изведуваат in vitro (т.е. во лабораторија, а не на клеточни системи), бидејќи полимеризацијата на така добиениот актин доведува до создавање на истиот F-актин како оној што се создава in vivo. Процесот in vivo е контролиран од мноштво на различни белковини, со цел да ги задоволи клеточните потреби, па затоа е тешко да се изучува во овие услови.[46]
Создавањето на филаментите in vitro се одвива на низијален начин: прво се одвива „фазата на активација“, кога се случува врзување и размена на двовалентни катјони на одредени места од G-актинот, кој е врзан за ATP. Ова создава конформациона промена, понекогаш наречена G*-актин или F-актински мономер, бидејќи е многу слична на подединиците од кои е изграден филаментот. По ова следи „фазата на нуклеација“, во која G-актинот создава мали, нестабилни фрагменти од F-актин кои се способни да полимеризираат. Во почетокот се формираат нестабилни димери и тримери. „Фазата на издолжување (елонгација)“ започнува кога постои доволно голем број на вакви кратки полимери. Во оваа фаза филаментот брзо расте преку додавање на нови мономери на двата краја.[47] Конечно, се постигнува стационарна рамнотежа (еквилибриум), каде мономерите на G-актинот се разменуваат на двата краја на микрофиламентот без каква било промена на неговата вкупна должина.[18] Во оваа последна фаза, „критичната концентрација Cc“ е дефинирана како однос помеѓу константата на агрегација и константата на дисоцијација на G-актинот, каде динамиката на адиција и елиминација на димери и тримери не предизвикува промени во должината на микрофиламентот. Во in vitro услови, Cc изнесува 0,1 μM,[48] што значи дека при повисоки вредности се одвива полимеризација на актинот, а при пониски вредности деполимеризација.[49]
Како што е наведено погоре, иако актинот хидролизира ATP, сите истражувања укажуваат на фактот дека ATP не е потребен за агрегација на актинот, имајќи предвид дека, од една страна, хидролизата на ATP главно се одвива во внатрешноста на филаментот, а од друга страна, фактот што ADP, исто така, може да поттикне полимеризација на актинот. Поради ова се поставува прашањето: кој термодинамички неповолен процес бара олку голема потрошувачка на енергија? Циклусот на актинот, кој ја спрегнува хидролизата на ATP со полимеризацијата на актинот, се состои од преференцијално додавање на G-актин-ATP мономери кон бодликавиот крај на филаментот и истовремено одделување (ослободување) на F-актин-ADP мономери од шилестиот крај на филаментот. Ослободените мономери, потоа, го заменуваат ADP со ATP, со што циклусот се затвора.
ATP се хидролизира релативно брзо по додавањето на G-актинскиот мономер на филаментот. Постојат две хипотези за тоа како се одвива овој процес; стохастична хипотеза, според која хидролизата на ATP се одвива по случаен пат, со можно влијание од соседните молекули; и векторијална хипотеза, според која хидролизата на ATP се одвива само во близина на други молекули чиј ATP е веќе хидролизиран. Производот на реакцијата Pi (неоргански фосфат) не се ослободува веднаш, туку некое време останува нековалентно врзан за ADP молекулата на актинот. Според тоа, постојат три вида на актин во составот на филаментите: ATP-актин, ADP+Pi-актин и ADP-актин.[37][50] Количината на секој од овие три вида на актин во филаментот зависи од неговата должина и состојба: како што започнува издолжувањето, филаментите имаат приближно еднаква количина на актински мономери врзани за ATP и врзани за ADP+Pi, и мала количина на ADP-актин на (-) крајот. Како што се постигнува стационарната состојба, ситуацијата станува обратна: ADP-актинот го сочинува поголемиот дел од филаментот, а само областа која е близу до (+) крајот содржи ADP+Pi-актин, со ATP-актин на самиот врв од филаментот.[51]
Ако се споредат филаментите кои содржат само ADP-актин со оние кои, покрај ADP-актин, содржат и ATP-актин, тогаш се забележува дека првите имаат критични константи кои се приближно еднакви за двата краја, додека вторите имаат критични константи кои се различни за двата краја: за (+) крајот Cc+ = 0,1 μM, додека за (-) крајот Cc- = 0,8 μM, што доведува до следните можности:[20]
Оттука може да се заклучи дека енергијата ослободена од хидролизата на ATP се користи за да се создаде вистинска „стационарна состојба“, која е флукс, а не едноставна рамнотежа.[37] Конфигурацијата на различните видови на актински мономери бива препознаена од актин-врзувачките белковини, кои, исто така, учествуваат во контролата на оваа динамика.


Актинскиот цитоскелет не е изграден исклучиво од актин, туку и од други белковини кои се неопходни за негово формирање и функционирање. Овие белковини се нарекуваат актин-врзувачки белковини и тие се вклучени во процесите на полимеризација, деполимеризација, стабилизација, организација и фрагментација на актинот.[18] Разновидноста на актин-врзувачките белковини е толку голема што се претпоставува дека актинот е белковина која учествува во најголем број на заемодејства белковина-белковина.[52] Подолу се наведени некои од најчестите актин-врзувачки белковини:

Постојат голем број на токсини кои интерферираат со актинската динамика; или со спречување на неговата полимеризација (латрункулин и цитохаласин D) или со спречување на неговата деполимеризација (фалоидин):
Актинот формира филаменти (F-актин или микрофиламенти) кои се основни елементи на еукариотскиот цитоскелет, а се способни да подлежат на многу брза динамика на полимеризација и деполимеризација. Во повеќето клетки, актинските филаменти градат големи мрежи кои се неопходни за одвивање на клучни клеточни функции:[66]
Актинот се среќава и во цитоплазмата и во јадрото на клетката.[67] Неговата локација во клетката е регулирана од патиштата за пренос на сигнали на клеточната мембрана, кои ги интегрираат сите стимули кои клетката ги прима, и како одговор на нив влијаат на реконструкцијата на актинската мрежа.


Микрофиламентите се вклучени во движењето на сите подвижни клетки, вклучувајќи ги и немускулните типови на клетки,[68][69] а супстанците кои ја нарушуваат организацијата на F-актинот (како што се цитохаласините) влијаат на активноста на овие клетки. Актинот сочинува 2% од вкупната белковинска содржина на хепатоцитите, 10% на фибробластите, 15% на амебите, и дури 50 - 80% во активираните тромбоцити.[70] Постојат неколку различни типови на актин, со мали разлики во структурата и функцијата. На пример, α-актинот се наоѓа исклучиво во мускулните влакна, додека β- и γ-актинот се наоѓаат во сите други типови на клетки. Карактеристично за β- и γ-актинот е што не градат постојани структури како α-актинот. Поради тоа, микрофиламентите кои се наоѓаат во немускулните клетки можат да се сретнат во три форми:[71]
Актинскиот цитоскелет е клучен за процесите на ендоцитоза, цитокинеза, одредување на поларитетот на клетката и морфогенезата кај квасците. Покрај актинот, во овие процеси се вклучени 20-30 други видови на белковини, кои имаат висок степен на еволутивна сочуваност, заедно со мноштво на сигнални молекули. Сите овие елементи заедно овозможуваат просторно и временски модулирана агрегација, која го одредува одговорот на клетката на надворешните и внатрешните стимули.[73]
Квасците содржат три главни елементи кои се поврзани со актинот: прамени, кабли и прстени, кои, и покрај тоа што траат долго време, се предмет на динамичка рамнотежа поради постојаната полимеризација и деполимеризација. Тие поседуваат голем број на помошни белковини, вклучувајќи ги: ADF/кофилин, белковина која има молекулска маса од 16 kDa и е кодиран од еден ген, наречен COF1; кофилински кофактор, кој го промовира расклопувањето на микрофиламентите; Srv2/CAP, регулатор на процесот кој е сроден со оној на аденилат циклазите; профилин со молекулска маса од 14 kDa, кој е поврзан со актинските мономери; и твинфилин, белковина со молекулска маса од 40 kDa, кој е вклучен во организацијата на актинските прамени.[73]

Истражувањата на растителниот геном имаат откриено присуство на актински изоформи од актинската фамилија на гени. Кај дикотиледоното растение Arabidopsis thaliana, кое се користи како моделен организам, откриени се десет типови на актин, девет типови на α-тубулин, шест типови на β-тубулин, шест профилини и десетици миозини. Овој диверзитет се објаснува со еволутивната потреба од поседување на варијанти кои имаат мали разлики во нивната временска и просторна експресија.[3] Во анализираното ткиво постоела истовремена експресија на повеќето од овие белковини. Актинските мрежи се дистрибуирани низ целата цитоплазма на клетките кои се култивираат in vitro. Околу клеточното јадро се јавува згуснување на актинската мрежа, која преку краци е поврзана со клеточниот кортекс. Оваа мрежа е многу динамична, така што процесите на полимеризација и деполимеризација се одвиваат континуирано.[74]
Иако мнозинството на растителни клетки поседуваат клеточен ѕид кој ја одредува нивната морфологија и го оневозможува нивното слободно движење во просторот, растителните микрофиламенти можат да генерираат доволно сила за да постигнат одвивање на бројни клеточни активности, како што се цитоплазматските струења генерирани од микрофиламентите и миозинот. Актинот, исто така, е вклучен во процесите на движење на растителните органели и во клеточната морфогенеза, што ја вклучува делбата, елонгацијата и диференцијацијата на клетките.[75]
Кај растенијата најзначајни белковини поврзани со актинскиот цитоскелет се: вилинот, кој припаѓа на истата фамилија како и гелсолинот/северинот, и е способен да ги сече микрофиламентите и да врзува актински мономери во присуство на калциум; фимбринот, кој е способен да ги препознава и обединува актинските мономери, а е вклучен во формирањето на мрежите (со различен регулационен процес од оној кај квасците и животните);[76] формини, кои се способни да делуваат како нуклеациони агенси за полимеризација на F-актинот; миозин, типичен молекуларен мотор кој е специфичен за еукариотите и е кодиран од 17 гени во две различни класи кај растението Arabidopsis thaliana; CHUP1, кој е способен да се врзе за актинот и се смета дека учествува во просторната организација на хлоропластите во клетката; KAM1/MUR3, кои ја одредуваат морфологијата на Голџиевиот систем и составот на ксилоглуканите во клеточниот ѕид; NtWLIM1, кој го олеснува формирањето на актинските клеточни структури; и ERD10, кој е вклучен во процесот на асоцијација на мембранските органели со микрофиламентите и кој се чини дека игра улога поврзана со реакцијата на организмот на стрес.
Јадрениот (јадрениот) актин првпат бил набљудуван и опишан во 1977 година од страна на Кларк и Меријам.[77] Актинот бил добиен од јадрената фракција на ооцити од жабата Xenopus laevis, а тој имал исти особини како актинот од скелетните мускули. Од тоа време појавени се многу научни трудови за структурата и функциите на јадрениот актин (за преглед види: Hofmann, 2009[78]). Контролираното ниво на актин во клеточното јадро, неговата интеракција со актин-врзувачките белковини и присуството на повеќе изоформи му овозможуваат на актинот да игра важна улога во бројни процеси во јадрото.
Аминокиселинската низа на актинот не содржи сигнал за јадрена локализација. Релативно малата величина на актинската молекула (околу 43 kDa) ѝ овозможува да навлезе во јадрото по пат на пасивна дифузија.[79] Сепак, постоењето на активен транспорт на актинот може да се заклучи од неговото брзо движење внатре и надвор од јадрото. Внесот на актинот внатре во јадрото (веројатно во комплекс со кофилин) е олеснето со помош на белковината импортин 9.[80]
Се чини дека ниските нивоа на актин во јадрото се многу важни, бидејќи актинот има во низата два сигнала за експорт од јадрото. Микроинјектираниот актин бргу се отстранува од јадрото. Експортот на актинот од јадрото се врши на два начина: преку експортин 1 (EXP1) и преку експортин 6 (Exp6).[81][82]
Специфични модификации, како што е SUMOлацијата (посттранслациона модификација во која SUMO белковина (од англ. Small Ubiquitin-like Modifier) ковалентно се врзува за белковината која се модифицира), овозможуваат задржување на актинот во јадрото. Било демонстрирано дека мутација која ја спречува SUMOлацијата предизвикува брз експорт на β-актинот од клеточното јадро.[83]
Врз основа на експерименталните резултати може да се предложи генерален механизам за транспорт на јадрениот актин:[83][84]
Јадрениот актин постои главно како мономер, но може да формира и динамични олигомери и кратки полимери.[85][86][87] Организацијата на јадрениот актин варира во различни типови на клетки. На пример, во ооцитите на Xenopus laevis (кои имаат повисоко ниво на јадрен актин во споредба со соматските клетки) актинот формира филаменти, кои ја стабилизираат архитектурата на јадрото. Овие филаменти може да се набљудуваат под микроскоп, благодарение на флуорофор-конјугираното боење со фалоидин.[77][79]
Во јадрото на соматските клетки не можат да се набљудуваат актински филаменти со помош на оваа техника.[88] Тестот за инхибиција на ДНКаза I, кој е досега единствениот тест што овозможува квантификација на полимеризираниот актин директно во биолошки примероци, има покажано дека ендогениот јадрен актин се јавува главно во мономерна форма.[87]
Точно контролираното ниво на актинот во јадрото на клетките, кое е пониско отколку во цитоплазмата, го спречува формирањето на актински филаменти. Полимеризацијата е, исто така, намалена преку ограничениот пристап до актинските мономери, кои се врзани во комплекси со актин-врзувачки белковини, главно кофилин.[84]
Покажано е дека во клеточното јадро се присутни различни изоформи на актинот. И покрај големата сличност во низата, изоформите на актинот имаат различни биохемиски својства, како што се разликите во кинетиката на полимеризација и деполимеризација.[89] Тие, исто така, имаат различни функции и локализации.
Нивото на актински изоформи, како во цитоплазмата така и во јадрото, може да се промени; на пример, како одговор на стимулација од клеточниот раст.[90]
Истражувањата на јадрениот актин главно се фокусирани на бета изоформата.[91][92][93][94] Меѓутоа, употребата на антитела за различни актински изоформи овозможува идентификација не само на бета изоформата во јадрото, туку и на:
Присуството на различни изоформи на актин може да има значаен ефект врз неговата функција во процесите на јадрото, особено поради тоа што нивото на поединечните изоформи може да биде независно контролирано.[87]
Функциите на актинот во клеточното јадро се поврзани со неговата способност за полимеризација, интеракцијата со мноштво на актин-врзувачки белковини и со структурните елементи на јадрото. Јадрениот актин е вклучен во:
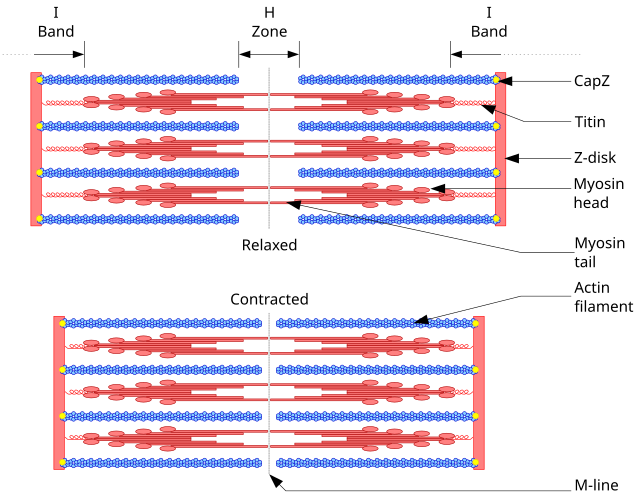
Во мускулните клетки, актомиозинските миофибрили го сочинуваат најголемиот дел од цитоплазматскиот материјал. Миофибрилите се изградени од тенки актински филаменти (обично околу 7 nm во пречник) и дебели миозински филаменти (обично околу 15 nm во пречник).[119] Тие ја користат енергијата добиена од хидролиза на ATP за да ја покренат мускулната контракција. Со користење на енергијата од ATP, миозинските глави подлегнуваат на циклус, во текот на кој тие се врзуваат за тенките актински филаменти, создаваат тензија, а потоа ги туркаат тенките филаменти да се лизгаат покрај (паралелно со) нив, што како резултат дава скратување на мускулната клетка.
Кај контрактилните снопови (стрес влакна), актин-врзувачката белковина алфа-актинин го одделува секој тенок филамент на растојание од околу 35 nm. Зголеменото растојание им овозможува на дебелите филаменти да навлезат во просторот помеѓу тенките филаменти и да стапуваат во интеракција со нив, што може да доведе до деформација или контракција. Кај деформацијата, едниот крај на миозинот е врзан за цитоплазматската мембрана, додека другиот крај „чекори“ кон (+) крајот на актинскиот филамент. Силата генерирана од овој процес делува да ја повлече мембраната и да ѝ ја промени формата во однос на клеточниот кортекс. Кај контракцијата, миозинската молекула обично е врзана за два различни филамента. Во овој случај, и двата миозински краја истовремено „чекорат“ кон (+) краевите на нивните соодветни актински филаменти, лизгајќи ги на тој начин поблиску еден до друг. Ова резултира со скратување (контракција) на актинскиот сноп (но не и на самиот актински филамент).
Завојниот F-актински филамент кој влегува во составот на мускулите содржи молекула на тропомиозин, која е обвиткана околу него. За време на фазата на релаксација, тропомиозинот ги покрива активните места на актинот, така што не може да се одвива интеракцијата помеѓу актинот и миозинот за создавање на мускулна контракција. За тропомиозинската нишка се врзуваат тропонините, кои имаат три полимери: тропонин I, тропонин T и тропонин C.[28] Регулаторната функција на тропомиозинот зависи од неговата интеракција со тропонинот, во присуство на Ca++ јони.[120]
И актинот и миозинот се вклучени во мускулната контракција, а тие сочинуваат 90% од вкупната белковинска содржина на мускулите.[121] Целокупниот процес е инициран од надворешен сигнал, главно преку дејствен потенцијал кој го стимулира мускулот. Циклусот на контракција и релаксација ги содржи следните чекори:[122]

Покрај горенаведените функции, актинот зема активна улога и во голем број на други биолошки процеси:

Цитоскелетот на сите еукариотски организми ги содржи актинот и тубулинот како основни градбени единици. На пример, белковината која е кодирана од ACTG2 генот кај луѓето е еквивалентна на хомолозите присутни кај стаорците и глувците, со сличност во нуклеотидната низа од дури 92%.[141] Сепак, постојат големи разлики со еквивалентите во прокариотите (FtsZ и MreB), каде сличноста помеѓу нуклеотидните низи е помеѓу 40-50% кај различните видови на бактерии и археи. Според некои автори прародителската форма на денешниот еукариотски актин повеќе наликувала на бактерискиот актински хомолог MreB.[142]
Некои автори истакнуваат дека однесувањето на актинот, тубулинот и хистонот (белковина вклучена во стабилизацијата и регулацијата на ДНК) се слични во нивната способност да врзуваат нуклеотиди и во нивната способност да го користат Брауновото движење. Се претпоставува дека сите овие типови на белковини споделуваат заеднички предок.[143]
Бактерискиот цитоскелет не е толку комплексен како еукариотскиот, но, сепак, тој содржи белковини кои се многу слични на актинските мономери и полимери. Бактериската белковина MreB полимеризира во тенки неспирални филаменти, а повремено во спирални структури слични на F-актинот.[144] Неговата кристална структура е многу слична на онаа на G-актинот (во однос на тридимензионалната конформација), а постојат и сличности помеѓу протофиламентите на MreB и F-актинот. Бактерискиот цитоскелет, исто така, содржи белковина наречена FtsZ, кој е сличен на тубулинот.[145]
Бактериите поседуваат цитоскелет со хомологни елементи на актинот (на пример, MreB, ParM и MamK), иако аминокиселинската низа на овие белковини се разликува од онаа кај еукариотските организми. Сепак, MreB и ParM имаат висок степен на структурна сличност со еукариотскиот актин. Високодинамичните микрофиламенти формирани од агрегацијата на MreB и ParM се од суштинско значење за одржливоста на клетките и тие се вклучени во клеточната морфогенеза, сегрегацијата на хромозомите и поларитетот на клетките. ParM е актински хомолог кој е кодиран од плазмидската ДНК и е вклучен во нејзината регулација.[146] ParM молекулите од различни бактериски плазмиди може да формираат зачудувачки разновидни спирални структури кои содржат две[147][148] или четири[149] нишки, кои служат за ефикасно изведување на сегрегацијата и наследувањето на плазмидите при делбата на бактериската клетка.
Човечки гени кои кодираат актински белковини се:
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.