Loading AI tools
ウィキペディアから
ニコチン性アセチルコリン受容体(ニコチンせいアセチルコリンじゅようたい、英: nicotinic acetylcholine receptor、略称: nAChR)またはニコチン受容体は、神経伝達物質の1つであるアセチルコリンに対して応答する受容体であり、またアゴニストであるニコチンなどの薬物にも応答する。多くの生物において、これらの受容体は中枢神経系、末梢神経系、筋肉やその他多くの組織に存在する。神経筋接合部での運動神経-筋肉間のコミュニケーションにおける筋肉側の主要な受容体であり、筋収縮を制御している。末梢神経系では、交感神経系と副交感神経系内でシナプス間のシグナル伝達を担っている。免疫系においては炎症過程を調節しており、異なる細胞内経路を介してシグナルを伝達する[1]。昆虫では、コリン作動性の系は中枢神経系に限定されている[2]。


ニコチン受容体はアセチルコリンに応答するコリン作動性受容体である。ニコチン受容体という名称がつけられたのは、ニコチンがムスカリン性アセチルコリン受容体は刺激しないものの、この受容体に対して選択的に結合して刺激するためである[3][4][5]。同様に、ムスカリン性アセチルコリン受容体の名称もムスカリンが選択的に結合することに由来している[6]。アセチルコリン自体は、ムスカリン受容体とニコチン受容体の双方に結合する[7]。
ニコチン受容体は最もよく研究されたイオノトロピック受容体の1つであるが[3]、近年得られたエビデンスでは、一部のケースでは(メタボトロピック受容体のように)セカンドメッセンジャーを利用する場合もあることが示唆されている[8]。
ニコチン受容体は交感神経系や副交感神経系へのシグナル伝達を助けているため、ヘキサメトニウムなどのニコチン受容体アンタゴニストはこうしたシグナル伝達に干渉することとなる。一例として、ニコチン受容体アンタゴニストは交感神経系や副交感神経系を介した心刺激によって血圧の変化を修正する、圧受容器反射に干渉することが明らかにされている[9]。
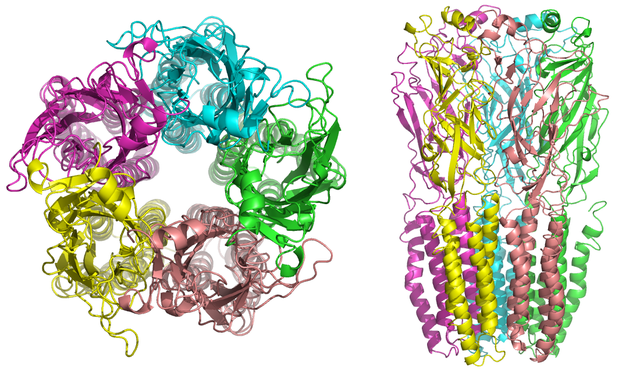
ニコチン受容体の分子量は約290kであり[10]、中心部のポアの周囲に対称的に配置された5つのサブユニットから構成される[3]。各サブユニットには4つの膜貫通ヘリックスが存在し、N末端とC末端は細胞外に位置している。構造的には、GABAA受容体、グリシン受容体、5-HT3受容体、システインループ型受容体との類似性がみられる[11]。
脊椎動物では、ニコチン受容体はその主要な発現部位に基づいて、筋肉型(NM)と神経型(NN)に分類される。NM受容体は神経筋接合部に存在し、受容体はα1、β1、γ、δサブユニットが2:1:1:1の比((α1)2β1γδ)で存在する胚型(embryonic form)、もしくはα1、β1、δ、εサブユニットが2:1:1:1の比((α1)2β1δε)で存在する成体型(adult form)のいずれかである[3][4][5][12] 。NN受容体は12種類のサブユニット(α2−α10、β2−β4)のさまざまな組み合わせからなる。Homomeric型(全て同じ種類のサブユニットからなる)の場合もheteromeric型(α、βサブユニットが少なくとも1つずつは含まれている)の場合もあり、 (α4)3(β2)2、(α4)2(β2)3、(α3)2(β4)3、α4α6β3(β2)2、(α7)5など、多くの組み合わせが考えられる。NM受容体もNN受容体も、各サブユニットは特に疎水的領域に関しては互いに非常によく類似している[13]。
電子顕微鏡解析やX線結晶構造解析により、筋肉型、神経型のニコチン受容体やその結合ドメインに関する高分解能構造情報が得られている[10][14][15][16]。
全てのリガンド依存性イオンチャネルと同様、ニコチン受容体チャネルの開口は化学的メッセンジャーの結合を必要とする。受容体に結合する分子を指して、リガンド、アゴニスト、伝達物質といったいくつかの異なる語が用いられている。内因性アゴニストであるアセチルコリン以外にも、ニコチン、エピバチジン、コリンなどがアゴニストとして作用する。受容体を遮断するアンタゴニストには、メカミラミン、ジヒドロ-β-エリスロイジン(dihydro-β-erythroidine)、ヘキサメトニウムなどがある[13]。
筋肉型のニコチン受容体では、アセチルコリン結合部位はαサブユニットとεまたはδサブユニットとの相互作用面に位置している。神経型のニコチン受容体では、結合部位はαサブユニットとβサブユニットの間、またはα7型受容体の場合には2つのαサブユニットの間に位置している。この結合部位は、N末端近傍の細胞外ドメインに存在している[4][17]。この部位にアゴニストが結合すると、全てのサブユニットにコンフォメーション変化が生じ、チャネルが開口する[18]。チャネルが開いた際のポアの直径は約0.65 nmである[4]。
ニコチン受容体は、相互変換可能な異なるコンフォメーション状態で存在している可能性がある。アゴニストの結合は、開状態と脱感作状態を安定化する。正常な生理的条件下では、開口には2分子のアセチルコリンを必要とする[19]。チャネルの開口によって正に帯電したイオンの通過が可能となり、特にナトリウムは細胞内へ流入し、カリウムは流出する。正に帯電したイオン全体としての流れは内向きである。
ニコチン受容体は非選択的カチオンチャネルであり、すなわちいくつかの異なる種類のカチオンがポアを通過することができる[3]。Na+とK+の透過性を有し、サブユニットの組み合わせによってはCa2+も透過性を有する[4][20][21]。ナトリウムとカリウムの透過性(コンダクタンス)は50–110 pSの範囲であるが、サブユニットの構成や透過するイオンによっても異なる[22]。
多くの神経型ニコチン受容体は、他の神経伝達物質の放出に影響を及ぼす[5]。通常、チャネルは迅速に開き、アゴニストが拡散するまで(約1ミリ秒程度であることが多い)開いたままである傾向がある[4]。リガンドが結合していなくても自発的に開く場合や、リガンドが結合していても自発的に閉じる場合もあり、またチャネルの変異によって開閉の尤度は変化する[18][23]。アセチルコリンの結合はポアの開口可能性を変化させ、より多くのアセチルコリンが結合するほど開口可能性は高まる。
ヘビの毒液に含まれるα-ニューロトキシンが結合した場合、ニコチン受容体はアセチルコリンを結合することができなくなる。こうしたα-ニューロトキシンは、骨格筋や神経のニコチン受容体に対してアンタゴニストとして非共有結合的に強力に結合することで、シナプス後膜におけるアセチルコリンの作用を遮断してイオンの流れを阻害し、麻痺や死をもたらす。ニコチン受容体にはこうしたヘビ神経毒の結合部位が2か所存在する。こうした部位への結合のダイナミクスの解析は困難であるものの、近年の基準振動解析[24]を用いた研究がヘビ毒やアセチルコリンの受容体への結合機構の性質の予測に役立てられている。こうした研究では、アセチルコリンの結合によって引き起こされる、ねじれるような動きがポアの開口を担っている可能性が高いと考えられており、また、この動きを止めるためには1分子または2分子のα-ブンガロトキシン(または他の長鎖α-ニューロトキシン)の結合で十分であることが示されている。毒素は隣接するサブユニット間を固定してねじれを阻害し、それによって開口を阻害していると考えられている[25]。
リガンドが結合した受容体の脱感作は、KatzとThesleffによってニコチン性アセチルコリン受容体で最初に特性解析がなされた[26]。刺激に対する長期的または反復的な曝露は、刺激に対する受容体の応答性の低下を引き起こすことが多く、この現象は脱感作と呼ばれている。ニコチン受容体の機能は、セカンドメッセンジャー依存的なプロテインキナーゼによるリン酸化によって修飾される[27]。PKA[26]、PKC[28]やチロシンキナーゼ[29]が、ニコチン受容体をリン酸化して脱感作を引き起こすことが示されている。アゴニストに対する長期的曝露後には、アゴニスト自体も受容体のコンフォメーション変化を誘導し、脱感作を引き起こすことが報告されている[30]。
アゴニストがポジティブアロステリックモジュレーター(PNU-120596など)の存在下で結合している場合には、脱感作状態の受容体は長期的な開状態へ戻ることができる[31]。また、特定のシャペロン分子がこれらの受容体に対する調節作用を有することを示す証拠も得られている[32]。
ニコチン受容体のサブユニットをコードする遺伝子は多重遺伝子族に属し(ヒトでは16種類のメンバーが存在する)、組み立てられるサブユニットの組み合わせによってかなり多くの種類の受容体が形成される(さらなる情報に関してはLigand-Gated Ion Channel databaseを参照)。これらの受容体の速度論的、電気生理学的、薬理学的性質は極めて多様であり、ニコチンに対しても大きく異なる効果濃度で応答する。こうした機能的多様性によって、2つの主要なタイプの神経伝達に関与することが可能となっている。その1つである古典的なシナプス伝達(wiring transmission)機構では高濃度の神経伝達物質が放出され、隣接する受容体に即座に作用する。対照的にvolume transmisson(ボリューム伝達、拡散性伝達、総量的伝達)では、軸索終末から放出された神経伝達物質は細胞外空間を拡散して受容体(離れた位置にある可能性もある)に到達する[33]。ニコチン受容体はその種類によってシナプス上の異なる位置に存在する場合があり、例えば、筋肉型のニコチン受容体は常にシナプス後側で機能するのに対し、神経型の受容体はシナプス後(古典的な神経伝達に関与する)とシナプス前の双方に存在し[34]、複数の神経伝達物質の放出に影響を及ぼしている。
脊椎動物では17種類のサブユニットが同定されており、筋肉型と神経型のサブユニットに分けられる。α8サブユニット/遺伝子はニワトリなどの鳥類には存在するものの、ヒトやその他の哺乳類には存在しない[35]。
これらのサブユニットは、アミノ酸配列の類似性に基づいて4つのサブファミリー(I–IV)に分類される[36]。さらに、サブファミリーIIIは3つのタイプに分類される。
| 神経型 | 筋肉型 | ||||
| I | II | III | IV | ||
|---|---|---|---|---|---|
| α9, α10 | α7, α8 | 1 | 2 | 3 | α1, β1, δ, γ, ε |
| α2, α3, α4, α6 | β2, β4 | β3, α5 | |||
神経型のニコチン受容体は、α2–α10、β2–β4からなるファミリーのサブユニットから組み立てられる[37]。これらのサブユニットは、1980年代半ばから1990年代初頭にかけてラットやニワトリの脳由来のcDNAからクローニングされ、神経型のニコチン受容体サブユニットをコードする11種類(ニワトリでは12種類)の遺伝子が同定されている[38]。さまざまなサブユニットの組み合わせでアセチルコリンやニコチンによって活性化される機能的受容体を形成することが可能であり、またサブユニットの組み合わせによって多様な機能的・薬理学的性質を有する受容体のサブタイプが生み出されることが発見された[39]。単独で発現した際に機能的受容体を形成することができるのはα7、α8、α9、α10サブユニットであり、他のαサブユニットは機能的受容体を形成するためにβサブユニットの存在を必要とする[37]。脳内では、β2サブユニットを含有する受容体(β2nAChR)やα7nAChRは広く発現しているが、他のサブユニットの発現はより限定的である[40]。
重要なニコチン受容体遺伝子クラスターの1つ(CHRNA5/A3/B4)には、α5、α3、β4サブユニットをコードする遺伝子が含まれている。遺伝学的研究により、これら3つの遺伝子をコードする座位の一塩基多型(SNP)が、ニコチン依存症、肺がん、慢性閉塞性肺疾患(COPD)、アルコール依存症、末梢動脈疾患のリスク因子として同定されている[37][41]。これらの遺伝子は染色体15q24–25領域に強固なクラスターとして存在している。この座位にコードされるサブユニットは、末梢神経系や、内側手綱核など中枢神経系の重要部位に発現している優勢なニコチン受容体サブタイプを形成している[37]。CHRNA5/A3/B4遺伝子クラスターに関するその後の研究により、これら「神経型」のニコチン受容体は神経細胞以外の細胞でも発現しており、そこでは炎症などさまざまな基礎的過程に関与していることが明らかにされた[42]。CHRNA5/A3/B4遺伝子群は多くの細胞種において共発現しており、3つの遺伝子のプロモーター領域の転写活性は多数の同じ転写因子によって調節されている。このことから、これらの遺伝子のクラスター形成は遺伝子発現制御を反映したものである可能性が示唆されている[37]。
8p11領域に位置するCHRNB3とCHRNA6も遺伝子クラスターとしてグループ分けされている[41]。複数の研究により、CHRNB3–CHRNA6内のSNP(rs6474413、rs10958726)がニコチン依存症や喫煙行動と関連づけられている[41]。この領域の遺伝的多様性は、コカインやアルコールなどの薬物乱用に対する感受性にも影響することが示されている[43]。α6またはβ3サブユニットを含むニコチン受容体は特に腹側被蓋野や黒質といった脳領域に発現しており、ドーパミン放出における役割のため薬物関連行動に重要な意味を持つ[44]。これらの遺伝子の多様性は、タンパク質のアミノ酸の変化や転写・翻訳調節の変化など、多くの機構で乱用薬物に対する感受性を変化させる[43]。
よく研究されている他のニコチン受容体遺伝子にはCHRNA4やCHRNB2があり、これらは常染色体優性夜間前頭葉てんかん(ADNFLE)と関連している[41][45]。どちらのサブユニットも脳内に存在し、これら2つのサブユニットの変異は全般てんかんの原因となる。こうした変異の例として、CHRNA4遺伝子の776ins3変異は夜間てんかん発作や精神疾患と関連しており、またCHRNB2遺伝子のI312M変異はてんかんだけでなく、学習や記憶など非常に特異的な認知機能の欠陥も引き起こすようである[45][46]。これら2つの遺伝子間の遺伝的多様性、SNPやその他の遺伝的修飾の解析からはCHRNB2遺伝子よりもCHRNA4遺伝子の方が多様性が高いことが示されており、このことはCHRNB2遺伝子にコードされるβ2サブユニットがα4サブユニットよりも多くのサブユニットと結合していることを示唆している。また、CHRNA2遺伝子も夜間前頭葉てんかんの3番目の候補遺伝子としての報告がなされている[41][45]。
CHRNA7遺伝子と精神疾患のエンドフェノタイプ、ニコチン依存症との関連がいくつかの研究で報告されており、α7サブユニットとそれに関する研究は臨床的に重要であると考えられている[45]。CHRNA7は統合失調症に関与すると考えられていた最初の遺伝子群の1つでもある。転写活性を低下させるCHRNA7遺伝子プロモーターの多型が統合失調症と関連しており、このことは統合失調症患者の脳内でα7ニコチン受容体が減少しているという知見とも一致する[45]。統合失調症患者の病理解剖による研究では、脳内の主要なニコチン受容体であるα4β2受容体とα7受容体の双方が有意に減少していることが示されている[47]。さらに、統合失調症患者は喫煙率が有意に高く、喫煙によるニコチン摂取が一種の自己治療となっている可能性が示唆される[48]。
ニコチン受容体は5個のサブユニットから構成される。そのため、サブユニットの組み合わせには莫大な可能性があるが、一部の組み合わせは他よりも多く存在する。最も広く発現しているサブタイプとしては、(α1)2β1δε(成体筋肉型)、(α3)2(β4)3(神経節型)、(α4)2(β2)3や(α7)5(中枢神経系(CNS)型)がある[49]。下の図では主要なサブタイプの比較を示す。
| 受容体の種類 | 部位 | 作用と機能 | アゴニスト | アンタゴニスト |
|---|---|---|---|---|
| 筋肉型: (α1)2β1δε[49]または(α1)2β1δγ | 神経筋接合部 | 主にNa+とK+の透過性の増大によってEPSPに寄与する | ||
| 神経節型: (α3)2(β4)3 | 自律神経節 | 主にNa+とK+の透過性の増大によってEPSPに寄与する | ||
| CNS型(heteromeric): (α4)2(β2)3 | 脳 | 主にNa+とK+の透過性の増大によって、シナプス前・後双方で興奮性電位に寄与する[49]。ニコチンの注意向上や報酬効果、そしてニコチン依存症の病理に関与している主要なサブタイプである[51][52][53]。 |
| |
| CNS型(heteromeric): (α3)2(β4)3 |
脳 | シナプス前・後双方で興奮性電位に寄与する |
|
|
| CNS型(homomeric): (α7)5 | 脳 | 主にNa+、K+、Ca2+透過性の増大によって、シナプス前・後双方で興奮性電位に寄与する[49]。ニコチンの認識能への影響の一部に関与している主要なサブタイプである[54]。さらに、このサブタイプの活性化は神経変性疾患下での神経血管カップリングや[55]、虚血性脳卒中時の神経発生を改善する可能性がある[56]。また、ニコチンの血管新生促進作用にも関与しており、喫煙者における慢性腎臓病の進行を加速する[57][58][59]。 |
|
|
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.