氷
固体の状態にある水 ウィキペディアから


なお、天文学では宇宙空間に存在する一酸化炭素や二酸化炭素、メタンなど水以外の低分子物質の固体をも氷(誤解を避けるためには「○○の氷」)と呼ぶこともある。また惑星科学では、天王星や海王星の内部に存在する高温高密度の水や、アンモニアの液体のことを氷と呼ぶことがある。さらに日常語でも、固体の二酸化炭素をドライアイスと呼ぶ。
この記事では、水の固体を扱う。
氷の特徴

- 結晶
- 無色透明(水以外の不純物や空気が混じらない場合)で、六方晶系の結晶を持つ。融点は通常の気圧で摂氏0度。ただし、圧力を変えることで相変化を起こし、結晶構造や物理的性質に差がある、様々な高圧相氷になることが知られている。この場合、我々が普段目にする「普通の」氷は「氷I」と呼ばれる。2021年現在、圧力が高い状態において氷IIから氷XIX(19)まで発見されている[1][2]。特に、極めて高い圧力下では、水素結合が縮んで水分子の配列が変わる。このように様々な相が存在することを多形という。
- 熱
- 氷は特異的に凝固熱、融解熱が大きい。例えば融解する時に、潜熱として1キログラムあたり約 80 kcal (333.5 kJ) の熱を周囲から奪う。これは同量の水を0℃から80℃まで温めることができるほどの熱量である。雪を食べると体力を消耗するとして、寒地では(特に遭難時)禁忌とされている。また、氷表面の水分子は結合が不完全でベアリングボールのように転がりやすく、氷表面は滑りやすい。この現象は2018年5月にドイツのマックス・プランク研究所の永田勇樹らのグループによって解明された[3][4]。−7℃でこの性質は最も強く現れ、スケート、スキー、カーリング、そりなどはこの性質を活かしている。また、氷が溶け始めると逆に滑りにくくなる。従来、氷表面が滑る仕組みは圧力による界面の融解で説明されてきたが、象が氷上でハイヒールを履いて立っても圧力は大幅に不足する。
- 体積
- 通常気圧において凍る際は体積が約11分の1増加する。すなわち、比重が0.9168 と小さくなり、水に浮く。物質は温度が低くなるほど分子の振動が小さくなるため、通常であれば温度が低くなるほど密度は大きくなり、従って気相よりも液相のほうが密度が大きく、液相よりも固相のほうが密度が高い。このように固相の方が液相よりも密度が低い物質は非常に珍しい。これは液相の水分子が水素結合で強固に結びついており、固相の場合よりも分子間の距離が小さいことが原因である。また、密閉された状態で凍ると周囲の物質を押し出し、時に破壊する。例えば岩の隙間に水が入り込んで氷になると、岩を破壊する。生物の細胞も凍結すると破壊され、生物の凍傷や凍死の原因となる。冬季の寒冷地では凍結による水道管の破裂を防ぐため、夜間は水抜栓を用いて水を冷気の及ばない地中に落とし、凍結を防ぐ。清涼飲料水類の缶にも「凍らせないでください」という注意書きが書かれている。水に溶けた炭酸は水が凍ると気体として追い出されてしまい、炭酸水を容器に入れて凍らせると爆発する危険がある。
- 不純物
- 液体が固体になる時、溶解している物質は結晶構造に加わらずに濃縮される。冷蔵庫などで氷を作ると、内部に白く気泡が残されるのはこのためで、気泡中には、溶けていた空気(二酸化炭素やその他不純物)が閉じ込められている。一方、透明な部分は不純物が少ない、純度が高い水になっている。透明な氷を作るためには、なるべく純粋な水をゆっくり凍らせる必要がある。一般に、一度煮沸して気体を追い出したり、大部分が凍結した段階で不純物が集まった水の部分を捨てたりするなどの方法が取られる(濃縮された方に用がある場合は、凍結濃縮法と呼ばれる)。
氷の製造
氷には、河川や湖水の冬季に氷結した物を切り出して保存・利用する「天然氷」と、機械によって製造される「人造氷」とがある。 長らく人類は天然氷のみを利用してきたが、19世紀、科学技術の発達により人造氷が現れると、衛生面・コストの点で天然氷の利用は主流ではなくなった。
我々は打ち水をすれば気温が下がることを知っているが、これは水が気化する際に熱を奪う(気化熱)ことによって起こる。機械による製氷も気化熱による冷却と同様の原理が利用される。
1748年、手回し式の減圧装置を用いることによるジエチルエーテルの気化熱を利用した製氷をスコットランドのウィリアム・カレンが行ったのが人造氷のはじまりとされる[5][6]
1834年には、エーテルを利用したコンプレッサー式製氷機の特許がアメリカのジェイコブ・パーキンスによって取られている[5][6]
日本では、明治以降に外国人居留地で小規模な製氷が行われるようになり、1883年(明治16年)東京製氷株式会社が設立されている(当初の製氷能力は、一日当たり6t)。
氷の利用
要約
視点


氷は冷却剤として複数の優れた性質を持っている。
- 融解熱が大きい - 氷の融解熱は333.5J/gとかなり大きく、少ない重量で効率的な冷却効果を得られる。
- 融点が十分低く、かつ低過ぎない - 融点が0度であるため0度未満まで冷却されにくく、冷却対象を凍結させにくい。細菌の繁殖を抑えつつ、細胞組織が水分の凍結によって破壊される事を回避出来るため、食品を冷却しても風味の変化を抑えられる。
- 安全である - 上述の性質により人体に触れても凍結の危険性が低い。また、溶けても水であるため毒性物質とならず、清潔な水で作れば食品に直接触れる用途や直接的な食用にも使える。
- 入手・処分が容易 - 水と家庭用冷凍庫程度の設備で製造出来るため、一般家庭でも入手が容易。近代以前でも雪や氷河など自然界の氷の利用が見られた。処分は溶けた水を捨てるだけでよい。
以上の性質から主に使い捨ての冷却剤として、極めて広範な用途で使用されている。
食用
冷却用
- 冷蔵庫 - 初期の冷蔵庫は、単に断熱性のある筐体の天井部分に巨大な氷を詰めて冷やすだけのものであった。現在のアイスボックスに近く、定期的に氷屋から氷を届けてもらう必要があった。現在においても電気冷蔵庫に保存した場合、食材によっては特有の臭いがつく場合があり、氷冷蔵庫が用いられる例もある。
- 生鮮食品の鮮度維持 - 生鮮食品(特に魚介類)を輸送する際、梱包に砕いた氷を充填する。沿岸漁業では、漁船は船倉に砕いた氷を積んで出航するため、大きな漁港では岸壁に氷を送るコンベヤダクトが備えられている。
- 人体の冷却 - 発熱時などに氷枕(氷嚢)として冷却を行なう。重篤な熱中症の場合氷水風呂も使われる。
- アイシング
- アイスクリームなどの製造 - 氷に塩化ナトリウムなどを加えると凝固点降下を起こす。この際に氷の融解熱と塩化ナトリウムなどの溶解熱を周囲から奪うことで氷点下数十度程度を作り出せる。初期のアイスクリームはこの作用を利用して作られた。
その他
- イグルー、かまくらなどの住居やホテル[注釈 1]。
- 燃料の結着・成型(例えばアルミニウム粉末を氷で固めたALICE推進剤)
- 氷像、氷による建築・装飾など。
- スケートリンク
- トイレの便器 - 主に飲食店のトイレで小便器に置き、小便を冷やして臭気を抑える効果を持たせている(当然、本物の氷を定期的に補充しなければ無意味である)。
- 1973年、南極大陸で氷の桟橋(Ice pier)が作られ利用された[7]。耐用年数は3〜5年で、寿命が来たら砕氷船に曳航されて除去される。
- 寒冷地では凍った湖や川などの上を道路や飛行場として利用し、臨時の鉄道も敷かれる[8](レニングラード包囲戦、アラスカ鉄道)。
- 氷山空母 - 氷山で航空母艦を作る計画。
氷利用の歴史
要約
視点
人為的に冷却効果を得る技術が登場するまで、氷自身が唯一の冷却材であったため、冬季や寒冷地にて得られた天然氷を融かさないよう保管する努力が講じられた。保管方法として、地下や洞窟の奥などに空間を作り、冷却効果を得ようと大量に氷を保管した。また、断熱効果を得るためオガクズなども用いられた。
日本ではこれを氷室(ひむろ)、英語ではアイスハウスと呼ぶ。歴史的には紀元前1780年頃のメソポタミア北部のテルカで使われた記録がある[9]。
昨今では、冬に降った大量の氷雪を保管しておいて夏期の冷房に利用しようとする試みや、気温が低く電力需要も少ない(そのため電力料金も安くなる)夜間に製氷しておき、昼間の冷房に役立てようとするサービスなどが普及しつつある。
→「氷貿易」および「en:Ice cutting」も参照
函館氷
日本において、冬以外に氷で冷やした飲み物が飲めるようになるのは、明治になってからになる。中川嘉兵衛という実業家が、明治4年、北海道・函館市で初めて天然氷の採氷事業に成功したことに始まる。嘉兵衛はまず、富士山の山麓に500坪の採氷池を掘り、そこから約2000個の天然氷を得ることに成功する。しかしこの氷は、江尻港(静岡市)までの8里(約31km)は馬で、その後は帆船を借りて一般貨物の2倍の運賃で横浜まで運んだものの、横浜到着時には全て溶けて水になってしまっていた。この後2年間休業したのち、諏訪湖、日光、釜山、青森からと、毎年場所を変えて氷を採り、横浜へと運搬したがいずれも失敗に終わった。しかし、嘉兵衛は諦めることなく、函館に渡り、6回目の採氷に挑戦した。この年は温暖であったため、僅かな氷しか採れず、250トンの氷を横浜に輸送することが出来たものの、採算は取れなかった。しかしこれに手応えを感じ、明治2年、函館の五稜郭の外濠を借り受け、亀田川の水を引き入れて7回目の採氷を行った。この7度目の挑戦にしてやっと事業が成功。明治5年(1872年)の『新聞雑誌』には、「製氷界の恩人――中川嘉兵衛」の見出しで、
| 「 | 昨夏横浜の氷会社より氷を売り出し、其価甚だ安く衆人の賞美大方ならず。(中略)文政天保の際に、奢侈を極めし貴人富豪と誰も知らざる所の一味を、一貧生にして飽まで消受すること、明代の余沢ならずや。 | 」 |
と述べられ、その事業が称賛されている。これまで簡単に手に入れられなかった夏場の氷が、安く手に入るようになり、人々が夏場に冷たいものにふれる始まりになった。また明治7年(1874年)の『東京日日新聞』においても、函館の天然氷採取が取り上げられ、功績が称賛されている。
| 「 | 氷の世に大功ある事は、第一熱病には必要の薬品にて、氷室ありし以来、炎症を助けしこと少なからず。第二暑中人意を快くし、第三我国の一産物を開けり | 」 |
製氷事業は病人の熱さましとして、また暑い夏の飲食用として、人々に歓迎された。
近年の需要動向
1980年代から1990年代にかけて、飲食店で業務用の自動製氷機が普及したため、食用氷純氷を扱う業者は販売不振に陥っていた[10]。しかし、2013年にコンビニエンスストアの挽きたてコーヒーが登場したことによって、再び食用氷の需要が上昇している[10]。 近年のかき氷ブームによる需要でふわふわ感が楽しめる氷として、またウイスキーをオン・ザ・ロックで飲む際に用いられる、高品質でほとんど無味無臭の氷として、製氷工場で作られた純氷が求められるようになってきた。
自然界の氷


大気中

地上
海上
地球外
相変化
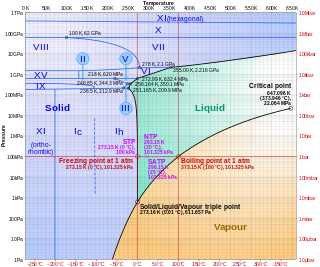
1気圧の環境では、氷は0℃以上で溶解して水になり、水は0℃以下で凝固して氷になる。611.657Pa以下の気圧では、温度が上昇すると氷が水蒸気に昇華する。
氷、水、水蒸気は、611.657Paの圧力、273.16K(0.01℃)の三重点で共存することができる[11][12]。
加圧下の多くの液体は、圧力が分子を固定することから高温でも凝固する。しかし、下図の100MPa周辺の水の場合は強い水素結合によって0℃以下で溶けている。この高圧下での氷の融解は、氷河の移動に寄与すると考えられている[13]。
氷の結晶構造は、2021年現在20種の多形と[1][2]、様々な密度の非晶質氷が判明している。
- 非晶質氷
- 非晶質氷(またはアモルファス氷)は分子配列の長距離秩序が無いアモルファス状態の氷の事である。非晶質氷は密度によって3つの形態に分けられる。大気圧で形成された低密度非晶質氷(LDA)や、より高い圧力で形成された高密度非晶質氷(HDA)および超高密度非晶質氷(VHDA)である。
- 宇宙空間では、地球上で最も優勢な六方晶系の氷は非常にまれで、非晶質氷が一般的である。しかし、火山活動によって六方晶系の氷が形成される可能性がある[14]。
- 氷の多形
→詳細は「en:Ice § Phases」を参照
脚注
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
