セシウム
原子番号55の元素 ウィキペディアから
セシウム (新ラテン語: caesium[3], 英: cesium [ˈsiːziəm]) は、原子番号55の元素。元素記号は、「灰青色の」を意味するラテン語の caesius カエシウスより Cs。軟らかく黄色がかった銀色をしたアルカリ金属である。融点は28.44 °Cで、常温付近で液体状態をとる5種類の金属元素のうちの一つである[注 1]。
| ||||||||||||||||||||||||||||||||||
| 外見 | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
黄色がかった銀白色 | ||||||||||||||||||||||||||||||||||
| 一般特性 | ||||||||||||||||||||||||||||||||||
| 名称, 記号, 番号 | セシウム, Cs, 55 | |||||||||||||||||||||||||||||||||
| 分類 | アルカリ金属 | |||||||||||||||||||||||||||||||||
| 族, 周期, ブロック | 1, 6, s | |||||||||||||||||||||||||||||||||
| 原子量 | 132.9054519(2) | |||||||||||||||||||||||||||||||||
| 電子配置 | [Xe] 6s1 | |||||||||||||||||||||||||||||||||
| 電子殻 | 2, 8, 18, 18, 8, 1(画像) | |||||||||||||||||||||||||||||||||
| 物理特性 | ||||||||||||||||||||||||||||||||||
| 相 | 固体 | |||||||||||||||||||||||||||||||||
| 密度(室温付近) | 1.93 g/cm3 | |||||||||||||||||||||||||||||||||
| 融点での液体密度 | 1.843 g/cm3 | |||||||||||||||||||||||||||||||||
| 融点 | 301.59 K, 28.44 °C, 83.19 °F | |||||||||||||||||||||||||||||||||
| 沸点 | 944 K, 671 °C, 1240 °F | |||||||||||||||||||||||||||||||||
| 臨界点 | 1938 K, 9.4 MPa | |||||||||||||||||||||||||||||||||
| 融解熱 | 2.09 kJ/mol | |||||||||||||||||||||||||||||||||
| 蒸発熱 | 63.9 kJ/mol | |||||||||||||||||||||||||||||||||
| 熱容量 | (25 °C) 32.210 J/(mol·K) | |||||||||||||||||||||||||||||||||
| 蒸気圧 | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| 原子特性 | ||||||||||||||||||||||||||||||||||
| 酸化数 | 1(強塩基性酸化物) | |||||||||||||||||||||||||||||||||
| 電気陰性度 | 0.79(ポーリングの値) | |||||||||||||||||||||||||||||||||
| イオン化エネルギー | 第1: 375.7 kJ/mol | |||||||||||||||||||||||||||||||||
| 第2: 2234.3 kJ/mol | ||||||||||||||||||||||||||||||||||
| 第3: 3400 kJ/mol | ||||||||||||||||||||||||||||||||||
| 原子半径 | 265 pm | |||||||||||||||||||||||||||||||||
| 共有結合半径 | 244±11 pm | |||||||||||||||||||||||||||||||||
| ファンデルワールス半径 | 343 pm | |||||||||||||||||||||||||||||||||
| その他 | ||||||||||||||||||||||||||||||||||
| 結晶構造 | 体心立方構造 | |||||||||||||||||||||||||||||||||
| 磁性 | 常磁性[1] | |||||||||||||||||||||||||||||||||
| 電気抵抗率 | (20 °C) 205Ω⋅m | |||||||||||||||||||||||||||||||||
| 熱伝導率 | (300 K) 35.9 W/(m⋅K) | |||||||||||||||||||||||||||||||||
| 熱膨張率 | (25 °C) 97 μm/(m⋅K) | |||||||||||||||||||||||||||||||||
| ヤング率 | 1.7 GPa | |||||||||||||||||||||||||||||||||
| 体積弾性率 | 1.6 GPa | |||||||||||||||||||||||||||||||||
| モース硬度 | 0.2 | |||||||||||||||||||||||||||||||||
| ブリネル硬度 | 0.14 MPa | |||||||||||||||||||||||||||||||||
| CAS登録番号 | 7440-46-2 | |||||||||||||||||||||||||||||||||
| 主な同位体 | ||||||||||||||||||||||||||||||||||
| 詳細はセシウムの同位体を参照 | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
セシウムの化学的・物理的性質は同じくアルカリ金属のルビジウムやカリウムと似ていて、水と−116 °Cで反応するほど反応性に富み、自然発火する。安定同位体を持つ元素の中で、最小の電気陰性度を持つ。セシウムの安定同位体はセシウム133のみである。セシウム資源となる代表的な鉱物はポルックス石である[5]。
セシウムは、ウランの代表的な核分裂生成物である[6]。放射性同位体のセシウム137は比較的多量に発生し、核兵器の使用や原発事故時の放射性降下物に含まれるため放射能汚染の原因となる。
2人のドイツ人化学者、ロベルト・ブンゼンとグスタフ・キルヒホフは、1860年に当時の新技術である炎光分光分析を用いて鉱泉からセシウムを発見した。初めての応用先は真空管や光電素子のゲッターであった。1967年、セシウム133の発光スペクトルの比振動数が国際単位系の秒の定義に選ばれた。それ以来、セシウムは原子時計として広く使われている。
1990年代以降のセシウムの最大の応用先は、ギ酸セシウムを使った掘穿泥水である。エレクトロニクスや化学の分野でもさまざまな形で応用されている。放射性同位体であるセシウム137は約30年の半減期を持ち、医療技術、工業用計量器、水文学などに応用されている。
名称
1860年、ドイツの化学者グスタフ・キルヒホフとロベルト・ヴィルヘルム・ブンゼンが、発光スペクトルの輝線が青色を呈することからラテン語の caesius(青色)にちなんで命名した[注 2][7][8]。
表記ゆれ
セシュウム常磐井守泰「種々の汚染対象物への布状セシュウム吸着材の適用経験」『日本原子力学会 年会・大会予稿集』2013年春の年会、日本原子力学会、2013年、629頁、doi:10.11561/aesj.2013s.0.629.0、NAID 130004569233。 (![]() 要購読契約), 中尾行憲「講89. 胎盤のセシュウム137沈着量について」『日本産科婦人科學會雜誌』第19巻第8号、日本産科婦人科学会、1967年、987-988頁、NAID 110002195198、NDLJP:10665848。、セシューム[9]とも。
要購読契約), 中尾行憲「講89. 胎盤のセシュウム137沈着量について」『日本産科婦人科學會雜誌』第19巻第8号、日本産科婦人科学会、1967年、987-988頁、NAID 110002195198、NDLJP:10665848。、セシューム[9]とも。
特徴
要約
視点
物理的性質

セシウムは非常に軟らかく(全ての元素の中で最小のモース硬度を持つ)、延性に富む銀白色の金属である。少しでも酸素が存在すると金色を帯びてくる[10][11]。
融点は28.4 °Cで、常温付近で液体である五つの元素のうちの一つである。金属の中でセシウムは水銀に次いで融点が低い[注 3][13]。加えて、沸点は641 °Cで金属としてはかなり低く、これも金属の中で水銀に次いで低い[14]。 比重は1.9であり、比重の軽いアルカリ金属類の中では最も大きい[15]。
化合物が燃焼するときに青から紫色の炎を伴うが、これはセシウムの炎色反応によるものである[16][17]。これは主に励起したセシウムの最外殻電子が基底状態に戻る際に発せられる波長455.5 nm、459.3 nmの青色を示す一対のスペクトル線および、697.3 nm、672.3 nmの赤色を示す一対のスペクトル線によるものであり、この特徴的な青色の輝線はセシウムの名前の由来ともなっている[18]。最外殻電子によるスペクトル線が二本に分かれて双子線となる理由は、電子のスピンに二つの方向があるためであり、他のアルカリ金属元素でも同様の双子線が見られる[18]。
化学的性質
金属セシウムは非常に反応性に富み、自然発火しやすい。また、低温でも水と爆発的に反応し、他のアルカリ金属よりも反応性が高い[10]。氷とは-116 ℃でも反応する[13]。高い反応性を持つため、金属セシウムは消防法で危険物に指定されている。保存や運送は、乾燥状態にした鉱物油などの炭化水素を満たした容器に入れて行う。同様の理由で、取り扱いはアルゴンや窒素などの不活性ガスの下で行わなければならない。真空で密閉されたホウケイ酸ガラスのアンプルで保存できる。100 g以上のセシウムは、ステンレス製の容器に密閉されて輸送される[10]。
セシウムの化学的性質は他のアルカリ金属、特に周期表で直上にあるルビジウムと似ており[19]、全ての金属陽イオンがそうであるように、セシウムイオンは溶液中でルイス塩基と反応して錯体を形成する。ほかの(放射性でない)アルカリ金属に比べて、原子量が大きく電気的に陽性なので、性質にわずかな違いが生ずる[20]。セシウムは、安定同位体の中では最も電気的に陽性なものである[注 4][13] セシウムイオンはより軽いアルカリ金属のイオンに比べて、より大きく、軟らかい。そのイオン半径の大きさに起因して、他のアルカリ金属元素より多い配位数を取る傾向がある[20]。このような、セシウムイオンの高い配位数を取る傾向とHSAB則における酸としての軟らかさは、セシウムイオンを他の陽イオンから分離するために利用される。この特性を応用して、放射性の 137Cs+ を大量の非放射性のカリウムイオン中から分離するために用いられるなど、核廃棄物の改善において研究が重ねられている[22]。このようにセシウムは基本的にイオン結合性の化合物を形成するが、気体状態では共有結合性の二原子分子であるCs2を形成し、Cs11O3のような一部の亜酸化物においてもCs-Csの共有結合が見られる[23]。
構造

他のアルカリ金属と同様、金属セシウムは標準状態において体心立方格子構造を取る立方晶であり(α-Cs)、格子定数は a = 614 pm、空間群は Im3m である。41 kbarの圧力下で面心立方格子構造へと相転移し(β-Cs)、その際の格子定数は a = 598 pm となる[24]。更に温度と圧力を上げると、菱面体晶系のγ-セシウムになる。
セシウムのイオン半径は非常に大きいため、イオン半径の小さい他のアルカリ金属元素よりも多い配位数を取る。この傾向は、他のアルカリ金属の塩化物が6配位の塩化ナトリウム型構造を取るのとは対照的に、セシウムの塩化物が8配位の塩化セシウム型構造を取ることに象徴される[20]。塩化セシウム型構造は、塩素原子が立方格子の角の部分に位置し、セシウム原子が立方格子の中央のホールに位置するような、二種の原子からなる8配位の単純な体心立方格子から成っている。臭化セシウム (CsBr) やヨウ化セシウム (CsI)、その他多くのセシウムを含まない化合物もこの塩化セシウム型構造を取る。塩化セシウム型構造は、Cs+ のイオン半径が174 pm、Cl- のイオン半径が181 pmと大きさが近いために形成される[25]。
化合物
→「Category:セシウムの化合物」も参照
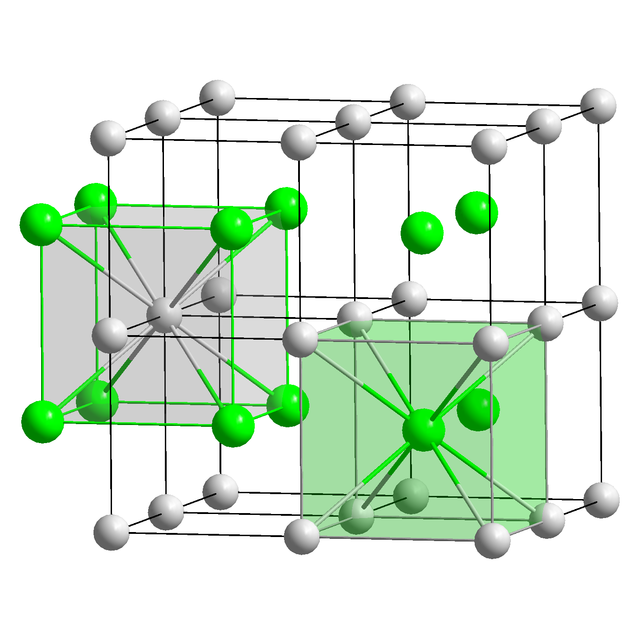
ほとんどすべてセシウム化合物は、セシウムを Cs+ カチオンとして持っており、これがさまざまなアニオンとイオン結合している。例外として、アルカリドである Cs- アニオンを含むものがある[26]。他の例外は亜酸化物で見られる。
Cs+ の塩は、アニオンが有色でない限りほとんど無色である。吸湿性であるものが多いが、他の軽いアルカリ金属よりはその度合いは弱い。セシウムの酢酸塩、炭酸塩、酸化物、硝酸塩、硫酸塩は水に可溶である。複塩の多くはあまり水に溶けないので、硫酸アルミニウムセシウムは鉱石からセシウムを精製するのに利用される。アンチモン、ビスマス、カドミウム、銅、鉄、鉛との複塩(たとえば CsSbCl4)も難溶性である[10]。
水酸化セシウムは吸湿性の強塩基性物質である[19]。これはケイ素などの半導体の表面をすみやかにエッチングする作用を持つ[27]。以前は、Cs+ と OH- の相互作用が小さいことから、CsOH は最も強い塩基であると考えられていた[16]。しかし、21世紀に入り、N-ブチルリチウムやナトリウムアミドをはじめ、CsOH より塩基性が強い化合物は数多く見いだされるに至った[19]。
ヨウ化セシウム (CsI) は、エックス線蛍光倍増管・ガンマ線検出用単結晶に用いられる。
酸化物

アルカリ金属元素は酸素との二元化合物を多く形成するが[28]、セシウムはさらに多くの酸素との二元化合物を形成する。セシウムが空気中で燃焼する際、超酸化物の CsO2 が主に生成する[29]。これは、超酸化物イオン (O2-) のような不安定な陰イオンが、イオン半径の大きなセシウムの格子エネルギー効果によって安定化されるためである[28]。
「通常の」セシウム酸化物である Cs2O は黄色からオレンジ色をした六方晶であり[30]、唯一の逆塩化カドミウム型構造を取る酸化物である[28][31]。250 °Cで蒸発し、400 °Cで金属セシウムと過酸化物 Cs2O2 に分解する[32]。過酸化物およびオゾン化物 CsO3[33][34] 以外にも、いくつかの明るい色をした亜酸化物について研究されている[35]。これらは Cs7O、Cs4O、Cs11O3、Cs3O(暗緑色[36])、CsO、Cs3O2[37] ならびに Cs7O2 が含まれる[38][39]。これらの酸化物に対応した硫化物、セレン化物およびテルル化物も存在する[10]。
合金
セシウムは他のアルカリ金属や金と合金をつくり、水銀とアマルガムをつくる。650 °C以下では、コバルト、鉄、モリブデン、白金、タンタル、タングステンとも合金をつくる。アンチモン、ガリウム、インジウム、トリウムとは、明瞭な金属間化合物をつくり、これらは感光性がある[10]。リチウム以外の他のアルカリ金属と混ざり、モル濃度で41%のセシウム、47%のカリウム、12%のナトリウムからなる合金は、すべての合金の中で最低の融点 (-78 ℃) を持つ[13][40]。いくつかのアマルガムが研究されていて、CsHg2 は紫色の金属光沢をもつ黒色物質で、CsHg は同様に金属光沢を持つ金色の物質である[41]。
同位体
→詳細は「セシウムの同位体」を参照
セシウムは112から151までの幅の質量数(すなわち、原子核中の核子数)を持つ39種の既知の同位体を有する。これらの内のいくつかは、古い星の中での遅い中性子捕獲プロセス(s過程)[42] ならびに超新星爆発時(r過程)に軽い元素から合成される[43]。しかしながら、唯一の安定同位体は78個の中性子を持つセシウム133のみである。セシウム133は+7/2と大きなスピン角運動量を持っており、この同位体を利用してNMR測定による構造解析が行われる(磁場強度11.74 Tのとき共鳴周波数65.6 MHz)[44]。
放射性同位体であるセシウム135は230万年という非常に長い半減期を有しており、セシウム137およびセシウム134はそれぞれ30年および2年という半減期である。セシウム137はベータ崩壊によって短命なバリウム137mに壊変し、その後非放射性のバリウムとなる。セシウム134は直接バリウム134に壊変する。質量数129、131、132および136の同位体は、半減期が1日から2週間の間であり、他の大部分の同位体の半減期は2–3秒から数分の1秒である。少なくとも21種類の準安定な核異性体が存在する。3時間未満の半減期を持つセシウム134m以外は非常に不安定で、2–3分以下の半減期で崩壊する[45][46]。
同位体元素のセシウム135は、ウランの核反応によって生成する長寿命核分裂生成物の一つである[47]。しかしながら、セシウム135の前駆体のキセノン135は非常に中性子を吸収しやすく、また、しばしばセシウム135に壊変する前に安定同位体であるキセノン136に変わるため、たいていの原子炉においてその核分裂収量は減少する[48][49]。
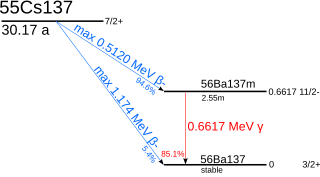
セシウム137はバリウム137mへとベータ崩壊するため、ガンマ線の強い発生源である[50]。セシウム137はストロンチウム90と同様に主要な中寿命核分裂生成物となる。これらは使用済み核燃料の放射能の原因となり、使用後、数年から最高で数百年間の冷却を必要とする[51]。例えば、セシウム137とストロンチウム90は現在、チェルノブイリ原子力発電所事故の周囲の地域で発生している放射能の発生源の大部分を占めている[52]。セシウム137は中性子の捕獲率が低いため、中性子捕獲によるセシウム137の処理ができず、自然に崩壊するのを待たねばならない[53]。
ほとんど全てのセシウムは、ベータ崩壊系列によって生成した中性子/陽子比の高いヨウ素とキセノンのベータ崩壊を通じて生成する[54]。ヨウ素やキセノンは揮発性であるため、核燃料や空気を通じて拡散し、放射性セシウムはしばしば初めに核分裂した場所から離れたところで生成する[55]。およそ1945年頃から始まった核実験によってセシウム137は空気中に放出され、放射性降下物の構成物質として地表に降り注いだ[10]。
人工的に作られる(ウランの核分裂により生ずる)セシウム137は、半減期30.07年の放射性同位体である。
体内に入ると血液の流れに乗って腸や肝臓にベータ線とガンマ線を放射し、カリウムと置き換わって筋肉に蓄積したのち、腎臓を経て体外に排出される。セシウム137は、体内に取り込まれてから体外に排出されるまでの100日から200日にわたってベータ線とガンマ線を放射し体内被曝の原因となるため、危険性が指摘されている。セシウム137に汚染された空気や飲食物を摂取することで、体内に取り込まれる。なお、ヨウ素剤を服用してもセシウム137の体内被曝を防ぐことはできない。セシウム137は医療用の放射線源に使われているが、1987年には、ブラジルのゴイアニアで廃病院からセシウム137が盗難に遭った上、光るセシウム137の塊に魔力を感じた住民が体に塗ったり飲んだりしたことで250人が被曝、4人が死亡する大規模な被曝事件が発生している(ゴイアニア被曝事故)。
生物濃縮
植物(農作物)での移行係数 (TF) は、農作物中濃度 (Bq) ÷ 土壌中濃度 (Bq) で表される。カリウム (K) と似た挙動を示すとされているが、動物と植物での挙動は異なる。なお、観測されている「濃縮」は環境中と細胞内での電解質濃度の差に由来するものであり、Kに対して際だってCsを濃縮する様な生物種は観測されていない。代謝に伴って常に生体内のアルカリ金属、アルカリ土類金属は細胞を出入りしており、重金属の場合のような蓄積に起因する「濃縮」は生じないとされる。
植物
植物の種類および核種により移行係数は異なる。イネ、ジャガイモ、キャベツを試料とした研究によれば、安定同位体のセシウム133と比較すると放射性のセシウム137は植物に移行しやすい。イネでは移行したセシウム元素の大部分が非可食部であるわらなどに含まれ、キャベツでは非可食部である外縁部のセシウムおよびストロンチウムの濃度が高くなることが報告されている[56]。
菌類
降下した放射性物質が土壌の表層に多く存在するため、表層の物質を主な栄養源とする菌類の種では植物と比較すると、特異的に高い濃縮度を示すものがあり、屋外で人工栽培されるシイタケやマイタケでも濃度が高くなる傾向があることが報告されている[57]。
魚類
主に軟組織に広く取り込まれて分布し、生物濃縮により魚食性の高い魚種(カツオ、マグロ、タラ、スズキなど)での高い濃縮度を示すデータが得られているが、底生生物を主な餌とする魚種(カレイ、ハタハタ、甲殻類、頭足類、貝類)では比較的濃縮度は低い。また大型の魚種ほど、濃縮度が高くなることが示唆されている。若い魚や高水温域に生息する魚ほど、代謝が良く排出量が多くなるため蓄積量は少ないと考えられている。体内に取り込まれる経路は、餌がほとんどであるが、鰓を通じて直接取り込まれる経路もあり、それぞれの経路の比率についてのデータは不足している[58]。メスのコモンカスベの体重と、体内に含まれる、137Cs/134Cs の比の間に、相関関係があるとの報告がある[59]。
用途
要約
視点
石油開発
現代でのセシウムの主要な用途のうちの一つは、石油採掘産業におけるギ酸セシウムを使った掘穿泥水である[60]。ギ酸セシウム水溶液 (HCOO-Cs+) は水酸化セシウムとギ酸との反応によって作られ、1990年代半ばに油井を掘削する際の仕上流体として開発された。掘穿泥水は油井を掘る際に用いられる溶液であり、これを掘削ドリルから噴出させて地表へと循環させることで地層を掘り進める際に発生する土砂を地表へと運びだし、常に掘削ドリルから噴出させることで、刃先の冷却と潤滑を行なって掘削効率を向上させる。同時に、採掘抗がこの溶液で満たされることによって適度な内圧が保たれ、採掘抗の崩落を防ぐとともに地下水の混入を防ぐなど、油井の掘削に欠かせない様々な機能が要求される[10][61]。ギ酸セシウム溶液はこのような特性要求を十分に満たしている[10]。
ギ酸セシウム溶液の密度は最高 2.3 g/cm3 と高い[62]。また、ギ酸カリウムもしくはギ酸ナトリウムと混ぜ合わせることで、密度を 1 g/cm3 まで低下させることができる。他の多くの高密度な溶液に用いられる物質と違い、ギ酸セシウムは相対的に環境負荷が小さい[62]。高密度であるために掘削流体中の有毒な浮遊物質の使用量を低減でき、また、多くのセシウム化合物がそうであるようにギ酸セシウムの反応性は比較的穏やかであるなど、環境的に大きな利点を有する。さらに生分解性であり、使用後にそのまま埋め立てることもできる。ギ酸セシウムはコストが高い点(1バレルおよそ4,000ドル、2001年[63])が欠点であるが、リサイクルの可能性も検討されている。また、臭化亜鉛 (ZnBr2) のような腐食性の高密度塩溶液と比較して、アルカリ金属のギ酸塩は扱いが安全であり、その腐食性の低さに起因して設備などの生産編成や採掘抗の金属素材に損傷を与えない。それらの要素はまた、使用後の洗浄と処分のコストがより少なく済むことも意味している[10]。
原子時計

セシウム133はセシウム原子時計の基準点に使われる。その時間は、セシウム133の超微細準位における電磁気的な遷移の観測によって決定される。最初の精密なセシウム原子時計は、1955年にイギリス国立物理学研究所においてルイ・エッセンによって作られた[64]。それ以降、原子時計は半世紀の間繰り返し改善され、周波数測定に準拠した時間の規格の基本となっている。このような原子時計には1014分の2から3ほどの精度があり、これは1日に2ナノ秒もしくは140万年に1秒の時間のずれに一致する。最新のものでは1015分の1と、より改善された精度を有し、これは恐竜の絶滅した6500万年前以降の期間でおよそ2秒のずれしか生じない事を意味しており[10]、「人類が達成した中で最も高精度な単位」であると考えられている[65]。
セシウム時計は、携帯電話における送信の計時や、インターネットにおける情報の流れの監視にも用いられる[66]。
電力および電子機器
セシウム蒸気を用いた熱電子発電は、熱エネルギーを電気エネルギーに変換する低出力の装置である。真空管のコンバーターを正極と陰極の間に置くことで、陰極の近くで蓄積される空間電荷を無効にすることができ、その際に電流の流れが強化される[67]。
光エネルギーを電流に変換する光電特性の意味でもまた、セシウムは重要である。金属間化合物である K2CsRb のようなセシウムベースの陰極は電子の放出のための立上がり電圧が低いため、セシウムは光電セルに用いられる[68]。セシウムを用いた光電デバイスの範囲は、光学的な文字認識システムや電気光電子増倍管、撮像管にまでおよぶ[69][70]。とはいえ、感光性材料の用途には、ゲルマニウムやルビジウム、セレン、ケイ素、テルルおよび他の元素をセシウムの代替とすることができる[10]。
ヨウ化セシウム (CsI)、臭化セシウム (CsBr)、フッ化セシウム (CsF) の結晶は、ガンマ線およびエックス線の検出に適したものとして、鉱物の調査や素粒子物理学の研究において広範囲に用いられ、シンチレーション検出器におけるシンチレーターに使われる。セシウムは重い元素であるため阻止能が向上でき、優れた検出感度を発揮させることができる。セシウムの化合物はまた、より早い応答能 (CsF) や、より低い吸湿性 (CsI) にも寄与する。
セシウムの蒸気は、多くの一般的な磁気センサに用いられる[71]。セシウムはまた、分光測色計の内部標準にも用いられる[72]。他のアルカリ金属のようにセシウムは酸素に対する強い親和性を有し、真空管における「ゲッター」として用いられる[73]。金属セシウムの他の用途としては、高エネルギーレーザー、蛍光灯におけるグローランプのガス、セシウム蒸気整流器などが含まれる[10]。
遠心分離
塩化物 (CsCl) や硫酸塩 (Cs2SO4)、トリフルオロ酢酸塩 (Cs(OCOCF3)) 溶液の高比重を利用して、一般的に分子生物学の分野において密度勾配超遠心法に用いられる[74]。この技術は主に、微量のウイルスや細胞内の細胞小器官および断片、そして生体サンプルからの核酸などの分離に利用される[75]。
化学的用途

セシウムの化学的用途は比較的少ない[76]。セシウム化合物によるドープ処理は、アクリル酸やアントラキノン、メタノール、無水フタル酸、スチレン、メタクリル酸メチルのモノマーおよび様々なオレフィンといった化合物の生産において、いくつかの金属イオン触媒の効果を強化するために用いられる。セシウムはまた、接触法による硫酸の生産において、触媒として用いられる五酸化バナジウムに添加される[77]。
フッ化セシウムは、有機化学において塩基としてまれに用いられる[19]。また、水を含まないフッ化物イオン源としても用いられる[78]。有機合成において、セシウム塩は時折カリウム塩やナトリウム塩の代替として、環化反応やエステル化反応、重合反応に用いられる。
原子力および同位体の用途
放射性同位体のセシウム137はコバルト60と同様に強いガンマ線を発するので、産業用のガンマ線照射用の線源として用いられる重要な放射性同位体である。その利点として、およそ30年という半減期、核燃料サイクル由来のセシウム137を利用できること、そして最終的に安定なバリウム137となることが挙げられる。水溶性が高いため食物および医薬品への照射には適さないという欠点もある[79]。セシウム137は農業や癌治療、また、食品や下水汚泥、医療器具の殺菌などに使われている[10][80]。放射線装置におけるセシウムの放射性同位元素は、特定の種類の癌を治療するために医療分野で用いられていた[81] が、よりよい代替手段が出現したことと、セシウム源として使われていた塩化セシウムがその水溶性によって広範囲に及ぶ汚染を引き起こすことから、徐々にこれらのセシウム源は使われなくなっていった[82][83]。セシウム137は、湿度や密度、水準測量、すきまゲージを含む、様々な産業用測定器に用いられている[84]。また、地質層の容積密度に対応する、岩層の電子密度を測定する検層装置にも用いられる[85]。
セシウム137は、水文学においてトリチウムと同様に用いられる。セシウム137は核兵器の爆発および原子力発電所からの放出物によって生み出される。1945年頃に開始され、1980年代まで続けられた核実験によってセシウム137は大気圏に放出され、すぐに水に吸収された。その期間における経年変化は、土壌や堆積物層の情報と関係付けることができる。セシウム134、およびより狭い範囲においてセシウム135もまた、原子力産業によるセシウムの放出量の算定に、水文学において用いられている。それらの同位体はセシウム133やセシウム137よりは存在量が多くないが、完全に人工的なものであることが利点である[86]。
その他の用途

惑星間での、あるいは惑星外への超長期間の航行を目的とした宇宙船のために設計された初期のイオンエンジンの推進剤として、セシウムおよび水銀が使われていた。電圧を印加したタングステン電極と接触させ、外殻の電子を奪うという方法でイオン化することにより、推進剤として用いられた。しかし、宇宙船の構成要素としてセシウムには腐食性についての懸念があったため、キセノンのような不活性ガスを推進剤として利用する方向へと開発は進んだ。キセノンは、地上でのテストにおいて取り扱いが簡単で、宇宙船に対する干渉がより少ない可能性がある[10]。結局、1998年から始まった実験的な宇宙船ディープ・スペース1号にはキセノンが使われた[87][88]。しかしながら、推進力を得るためにセシウムのような液体金属イオンを加速する単純なシステムを使う電界放射式電気推進エンジンも作られている[89]。
硝酸セシウムは近赤外スペクトルにおいて強い光を発するため[90]、LUU-19照明弾[91] のような赤外線照明弾においてケイ素を燃焼させるための酸化剤・炎色発光剤として用いられる[92]。セシウムはまた、SR-71軍用機における排気ガスのレーダー反射断面積を減らすために用いられる[93]。セシウムやルビジウムは電気伝導度を減少させるので、光ファイバーや暗視装置の安定性と耐久性を向上させるため、炭酸塩としてガラスに添加される。フッ化セシウムやフッ化セシウムアルミニウムは、マグネシウムを含有したアルミニウム合金をろう付けするために配合された融剤に用いられる[10]。
開発段階の用途
MHD発電システムは研究されているが、広く受け入れられることに失敗している[94]。セシウム金属はまた、高温ランキンサイクルターボ発電機の作動流体としての候補にも挙がっている[95]。セシウム塩はまた、ヒ素剤投与後の抗ショック剤としても検討されている。心臓の拍動に影響を与えるため、カリウム塩やルビジウム塩よりは使われる見込みが少ない。それらはまた、てんかんの治療にも用いられた[10]。
歴史
要約
視点


1860年、ドイツの化学者グスタフ・キルヒホフとロベルト・ヴィルヘルム・ブンゼンがバート・デュルクハイム(en:Bad Dürkheim)の鉱泉の水から発見した[注 5][7][8]。セシウムはキルヒホフとブンゼンが分光器を発明してからわずか1年後に発見された初めての元素であった[13]。
セシウムの純粋な試料を得るためには、44,000 Lの鉱水を蒸発させて240 kgの濃縮塩溶液を作らなければならなかった。分離過程は以下のようなものである。まずアルカリ土類金属は硫酸塩もしくはシュウ酸塩として沈殿分離され、溶液中にはアルカリ金属類が残された。次に硝酸塩へと変換してエタノールで抽出することで、ナトリウムを含まない混合物が得られた。この混合液から、リチウムは炭酸アンモニウムによって沈殿させて分離された。カリウム、ルビジウムおよびセシウムはヘキサクロリド白金(IV)酸によって不溶性塩を形成させた。これらのヘキサクロリド白金酸塩は、温水に対してわずかに溶解性の差異を示す。したがって、溶解性の低いセシウムおよびルビジウムのヘキサクロリド白金(IV)酸塩 ((Cs,Rb)2PtCl6) が分別晶出によってわずかに得られた。水素によるヘキサクロリド白金酸塩の還元の後、セシウムとルビジウムは炭酸塩のアルコールに対する溶解度の違いによって分離された。この過程によって、44,000 Lの鉱水から、9.2 gの塩化ルビジウムと7.3 gの塩化セシウムが得られた[7]。
キルヒホフとブンゼンの二人は、このようにして得られた塩化セシウムを用いてこの新しい元素の原子量が123.35であると推定した(現在一般に認められている値は132.9である)[7]。彼らは塩化セシウムの電気分解によって単体のセシウムを作ろうとしたが、金属の代わりに、肉眼での観察においても顕微鏡での観察においても金属物質であるというわずかな痕跡も示さない、青色の均一な物質が得られた。その結果、彼らはこれを亜塩化物 (Cs2Cl) であるとしたが、実際には恐らくコロイド状の金属と塩化セシウムの混合物であった[96]。水銀アノード電極を用いた塩化物溶液の電気分解では、水の存在下ですぐさま分解するセシウムアマルガムが生じた[7]。純粋な金属は結局、アウグスト・ケクレとブンゼンのもとで博士号のための研究をしていたドイツの化学者カール・セッテルベルグによって単離された[8]。1882年、セッテルベルグはシアン化セシウムの電気分解によって金属セシウムを作り出し、塩化物を原因とする問題を回避した[97]。
歴史的に最も重要なセシウムの用途は、主に化学および電気の分野における研究開発向けであった。セシウムの極めて少ない用途としては、1920年代まではラジオの真空管に用いられていた。それには、真空管製造後の管内の余分な酸素を除去するゲッターとしての役目と、熱せられたカソードの電気伝導度を向上させるためのコーティング剤としての役目の二つの機能があった。セシウムは1950年代までは高性能な工業用金属として認められていなかった[98]。非放射性セシウムの用途には光電材料、光電子増倍管、赤外分光光度計の光学部品、いくつかの有機反応における触媒、シンチレーション検出器用の結晶、MHD発電などが含まれる[10]。
1967年以降、国際単位系は時間の秒の単位の基準にセシウムの性質を用いた基準を採用している。国際単位系は、セシウム133原子の二つの基底状態における超微細準位間の移行と一致する、放射の9,192,631,770サイクルの長さを1秒と定義した[65]。1967年の第13回国際度量衡総会において、1秒の長さは「外部から疎外されない基底状態におけるセシウム133の超微細準位の移行によって発生もしくは吸収されるマイクロ波光線の9,192,631,770サイクルの時間」と定義された。
セシウムの放射性同位体であるセシウム137は、原子爆弾が投下された広島市と長崎市の両方で記録が残っている「黒い雨」(原子爆弾投下後に地上に「降下する」放射性降下物の一形態)に含まれていたと考えられていて、原子爆弾が投下後の広島における降雨範囲を特定するために土壌中のセシウム137の測定結果が利用されている。
産出
要約
視点

セシウムは地殻中に平均およそ3 ppmの濃度で存在していると見積もられており、比較的珍しい元素である[100]。これは、全ての元素の中で45番目の存在量であり、全ての金属の中では36番目である。それでもセシウムは、アンチモンやカドミウム、スズ、タングステンのような元素よりは豊富であり、水銀や銀よりは2桁多く存在するが、セシウムと化学的に密接に関連するルビジウムはさらに30倍ほど多い[10]。
その大きなイオン半径のため、セシウムは「不適合元素」の一つである[101]。マグマが結晶化する過程で、セシウムは液相で濃縮され最後に結晶化する。したがってセシウムは、これらの濃縮過程によって形成されるペグマタイト鉱物に最も大きく堆積する。ルビジウムはカリウムと置換する性質があるが、セシウムはルビジウムほどすぐには置換しないため、アルカリ蒸発岩のカリ岩塩(シルビン、KCl)やカーナライト (KMgCl3•6H2O) には0.002%程度のセシウムのみしか含まれない。したがって、セシウムは鉱物ではほとんど見られない。パーセント単位のセシウムは緑柱石 (Be3Al2(SiO3)6) およびアボガドロ石 ((K,Cs)BF4) で見られることがある。また、最高15重量パーセントの Cs2O を含むものとして密接に関連した鉱物ペツォッタイト (Cs(Be2Li)Al2Si6O18) が、最高8.4重量%の Cs2O を含むものとして希少鉱物のロンドン石 ((Cs,K)Al4Be4(B,Be)12O28) が、セシウム濃度がより少なく広範囲にわたるものとしてローディズ石がある[10]。唯一の経済的に重要なセシウム源の鉱物はポルサイト (Cs(AlSi2O6)) である。これらは、世界中において数か所しかないベグマタイト地帯でのみ見つかり、より商業的に重要なリチウム鉱石であるリシア雲母およびペタライトと関連している。ペグマタイトの内部では、粒度が大きく、鉱物成分が強く分離していることで、採鉱のための良質な鉱物が形成されている[102]。
世界で最も豊富なセシウム源の一つは、カナダのマニトバ州のベルニク湖にあるタンコ鉱山である。その鉱床には350,000トンのポルサイト鉱石が埋蔵されていると見積られており、これは世界の埋蔵量の2/3を占めているといわれている[102][103]。しかし、ポルサイトに含まれるセシウムの化学量論的容量は42.6%であるが、この鉱床から採掘された純粋なポルサイト試料ではおおよそ34%のセシウムしか含まれず、平均容量は24 重量%でしかない[103]。商用のポルサイトでは19%を超えるセシウムを含む[104]。ジンバブエのビキタにおけるペグマタイト鉱床ではペタライトのために採掘されるが、かなりの量のポルサイトも含んでいる。注目に値する量のポルサイトは、ナミビアのエロンゴ州でも採掘されている[103]。現在のセシウムの世界の鉱山からの採掘量は年間5から10トンであり、可採年数は数千年にもなる[10]。
生産
要約
視点
ポルサイト鉱石の採掘は選択的な過程であり、大部分の金属鉱山の操業と比較して小規模である。鉱石は砕かれたあと手作業で選鉱されるが、通常は濃縮工程を経ずそのまま磨り潰される。セシウムは主に酸による分解、アルカリによる分解、直接還元の三つの方法でポルサイトから抽出される[10][105]。
酸分解において、ポルサイト中のケイ酸塩は塩酸 (HCl) や硫酸 (H2SO4)、臭化水素酸 (HBr)、フッ化水素酸 (HF) のような強酸によって溶解される。塩酸によって可溶性塩化物の混合物が作られ、不溶性の塩化セシウムの複塩はアンチモンとの複塩 (Cs4SbCl7) やヨウ素との複塩 (Cs2ICl)、セリウムとの複塩 (Cs2(CeCl6) として沈殿する。これらを分離したのち、沈殿物として得られた純粋な複塩は分解され、水分を蒸発させることで純粋な塩化セシウムが得られる。硫酸を用いた方法では、セシウムミョウバン (CsAl(SO4)2•12H2O) として直接不溶性の複塩が得られる。セシウムミョウバン中の硫酸アルミニウムは、ミョウバンを炭素と共に焼成することで不溶性の酸化アルミニウムに変化させ、可溶性の 硫酸セシウム (Cs2SO4) を水で抽出して水溶液とすることで分離される[10]。
炭酸カルシウムおよび塩化カルシウムとともにポルサイトを焼成させることで不溶性のケイ酸カルシウムと可溶性の塩化セシウムが得られる。これを水もしくは希アンモニア水 (NH4OH) で溶出させることで塩化セシウム溶液が得られる。この溶液を蒸発させることで塩化セシウムを得ることができ、反応させることでセシウムミョウバンもしくは炭酸セシウムを得ることもできる。商業的に採算の合う方法ではないが、真空中でカリウムまたはナトリウムもしくはカルシウムを用いて鉱石の直接還元させることで、直接金属セシウムを生産することができる[10]。
塩類として採掘されたセシウムは、大部分が石油掘削などに利用するためギ酸セシウム (HCOOCs) に直接変換される。発展途上な市場へと供給するため、キャボット社 (Cabot Corporation) は1997年にカナダのマニトバ州ベルニク湖近郊のタンコ鉱山で、年間12,000バレルのギ酸セシウム溶液を生産する能力を有する工場を建設した[106]。セシウムの小規模生産物として主要なものは塩化セシウムおよび硝酸セシウムである[107]。
あるいは、鉱石から精製したセシウム化合物から金属セシウムが製造されることもある。塩化セシウムおよびその他のセシウムハロゲン化物はカルシウムもしくはバリウムによって700 °Cから800 °Cで還元され、次いで蒸留することによって金属セシウムが得られる。
同様に、アルミン酸塩や炭酸塩、水酸化物も、マグネシウムによって還元することができる[10]。金属セシウムはまた、溶融させたシアン化セシウム (CsCN) の電気分解によって単離することもできる。特に純粋でガスを含まないセシウムは、水溶性の硫酸セシウムとアジ化バリウムから作られるアジ化セシウム (CsN3) を390 °Cで熱分解することによって得られる[105]。真空下での利用では、二クロム酸セシウムをジルコニウムと反応させることによって気体を副生させずに純粋なセシウム金属が生成する[107]。
2009年の純度99.8%の金属セシウムの価格は、メタルベースで1 g当たり10ドル(1オンス当たり280ドル)であるが、化合物はかなり安価である[103]。
健康と安全性に対する危険性
要約
視点

セシウム化合物は普通の人にとっては滅多に触れることがない物質だが、大部分のセシウム化合物はカリウムとセシウムの化学的類似性に由来するわずかな毒性がある。大量のセシウム化合物への曝露は刺激と痙攣を引き起こすが、それほどの量の自然中におけるセシウム源とは通常遭遇せず、環境化学においてセシウムは主要な汚染物質ではない[109]。マウスにおける塩化セシウムの半数致死量 (LD50) の値は体重1 kgあたり2.3 gであり、これは塩化カリウムおよび塩化ナトリウムの値にほぼ等しい[110]。
金属セシウムはもっとも反応性の高い元素のひとつであり、水との接触に際して非常に高い爆発性を有する。金属セシウムと水との反応によって生成する水素ガスは、その反応と共に放出される熱エネルギーによって加熱され、発火と激しい爆発を引き起こす。
| NFPA 704 |
|---|
| 金属セシウムに対するファイア・ダイアモンド表示 |
そのような反応は他のアルカリ金属においても起こるが、セシウムにおいては、この爆発が冷水によっても十分引き金となり得るほどに強力である[10]。金属セシウムは非常に強い自然発火性を持ち、空気中において自然に発火して水酸化物やさまざまな酸化物を形成する。水酸化セシウムは非常に強い塩基であり、ガラスは速やかに腐食される[111]。
放射性物質の漏洩に由来して、同位体元素のセシウム134およびセシウム137は少量が生物圏に存在しているが、場所によって異なる放射能負荷の指標となる。放射性セシウムは放射性ヨウ素や放射性ストロンチウムなどの他の多くの核分裂生成物と比較すると人体に蓄積しにくい。他のアルカリ金属と同様に、放射性セシウムは尿と汗によって比較的早く排出される。一方で、放射性セシウムはカリウムとともに、果物や野菜などの植物の細胞に蓄積する傾向がある[112][113][114]。汚染された森で放射性のセシウム137をキノコが子実体に蓄積することも示されている[115]。湖へのセシウム137の蓄積はチェルノブイリ原子力発電所事故後に強く懸念されていた[116][117]。国際原子力機関などは、セシウム137のような放射性物質は放射能兵器もしくは「汚い爆弾」に用いることが可能であると警告した[118]。チェルノブイリ原子力発電所事故で放出された放射性セシウムによる健康リスク調査でも、危険性の程度に関して様々な主張がある[119][120][121]。
脚注
参考文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.






