カンプトテシン
ウィキペディアから
カンプトテシン(Camptothecin、CPT)は細胞毒性のあるキノリンアルカロイドで、DNA酵素のI型トポイソメラーゼ(トポI)の働きを阻害する。1966年、M.E.ウォール(M.E.Wall)とM.C.ワニ(M.C.Wani)が天然産物から抗がん剤を系統的に選別している際発見した。中国原生のカンレンボク(Camptotheca acuminata)の樹皮と幹から単離された。カンプトテシンは予備的な臨床試験で著しい抗がん活性があることが示されたが、溶けにくく有害な副作用もある。この欠点があるため、この物質の利点を引き延ばす誘導体が数多く作られ、良い結果が得られた。2つのカンプトテシン類似物質トポテカン(topotecan)とイリノテカン(irinotecan)が承認され、今日におけるがん化学療法で用いられている[1][2]。
構造

カンプトテシンは平面的に5つの環状構造が連なった構造をしている。5つの環は、ピロロ[3,4-β]-キノリン(pyrrolo[3,4-β]-quinoline)部分(A環、B環、C環)、ピリドン(pyridone)部分(D環)、α-ヒドロキシラクトン(alpha-hydroxy lactone)環(E環、20位にキラル中心を持つ(S)体立体配置)で構成される。この平面的構造がトポイソメラーゼ阻害における最も重要な因子の一つであると考えられている[3][4]。
結合
カンプトテシンはトポI・DNA複合体(共有結合複合体)と結合し三者複合体(三位複合体)となり、それによって安定化する。これがDNAの再結合反応を妨げ、その結果DNAの損傷がアポトーシスを引き起こす。カンプトテシンはトポIとDNAに水素結合によって結合する。構造の中で最も重要な部分はE環で、この部分は酵素の3つの部分と相互作用する。20位のヒドロキシ基が酵素の533番目のアスパラギン酸(Asp533)の側鎖と水素結合を形成する。キラル炭素の立体配置が (S) 体であることが重要である。なぜなら (R) 体は不活性であるからである。ラクトンは364番目のアルギニン(Arg364)のアミノ基と2つの水素結合を形成する。D環は非切断鎖上の+1シトシンと相互作用し、水素結合を形成してトポI・DNA共有結合複合体を安定化させる。この水素結合は、D環の17位にあるカルボニル基と+1シトシンのピリミジン環のアミノ基との間に形成されるものである [5][6]。
物理・化学的性質
カンプトテシンは弱酸であるため、ラクトン環は加水分解によって開環しやすい。開環型は不活性型であるため、トポIを阻害するためには環を閉じなければならない。閉環型は酸性条件下で存在しやすく、多くのがん細胞の微小環境ではそのようになっている。カンプトテシンは受動輸送によって輸送される。細胞への取り込みは親油性条件下で行われやすく、それによって細胞内への蓄積が促進される。親油性条件はカンプトテシンをより安定化させる。なぜならラクトンの赤血球細胞への分配を改善し、それによってラクトンの加水分解が少なくなるからである。カンプトテシンはヒト血清アルブミン(human serum albumin、HSA)と親和性がある。特にカルボン酸型の場合に親和性が高いが、それはラクトン環型とカルボン酸型の間の化学平衡がカルボン酸側へと移るからである。還元された薬剤とヒト血清アルブミン相互作用は活性を改善しうる[5][7]。
構造と活性との関係
要約
視点

研究により7、9、10、11位の置換はカンプトテシンの活性と物理的性質の向上(有効性と代謝安定性など)をもたらすことが示されている。ラクトン環をメチレン単位によって大きくし、ホモカンプトテシン(homocamptothecin)などにすることも性能を向上させる。12位と14位を置換すると不活性な誘導体となる[7]。
A環・B環の修飾
アルキル置換
7位のエチレン(C2H5)やクロロメチル(CH2Cl)などのアルキルによる置換は細胞毒性を増加させることが示されている。これらの官能基は腫瘍の活性増加をもたらすトポIの存在下でDNAと反応することができる。7位において炭素鎖の長さを増加させることは親油性を増加させ、その結果としてヒト血清の活性と安定性を向上させることも示されている[7][5]。別の7位に修飾を受けたカンプトテシン相同体としてシラテカン(silatecan)とカレニテシン(karenitecin)がある。これらは強力なトポI阻害剤でどちらも7位にアルキルシリル基を持つ。これが親油性を与えより安定化させている。シラテカン(7-シリルカンプトテシン)は薬剤とヒト血清アルブミンとの相互作用を減少させ、これが血中安定性をもたらし血液脳関門を越えられるようにもしている。DB-67は10位ヒドロキシ基誘導体でシラテカンの中で最も活性が高い。カレニテシンの一種であるBNP1350は細胞毒性を持ち、薬剤耐性に打ち勝つ能力を呈する。イミノメチルやオキシイミノメチルなど更に別の置換でもカンプトテシンの親油性を導入できる。その中で最も強力な化合物はオキシイミノメチル誘導体のST1481で、これは輸送機構によって引き起こされる薬剤耐性に打ち勝つことができる利点を持つ[7]。炭素鎖の7位にある塩基性窒素は化合物をより親水性にするため、より水に溶けやすくなる。一例を挙げると、CKD-602と呼ばれる誘導体は、強力なトポI阻害剤で水溶性の低さとカンプトテシンで見られるような毒性をうまく克服している[7][8]。
かなり大きな活性がアミノ(NH2)、ニトロ(NO2)、ブロモ(Br、臭素)、クロロ(Cl、塩素)のような電子求引性基を9位と10位に、ヒドロキシ基を10位か11位に置くことにより実現できる。ところが、これらの化合物は比較的水溶液に溶けにくく、管理が難しい。10位と11位両方のメトキシ基は同時に不活性化を導く[3][7]。
6員環カンプトテシンの類似物質
6員環のカンプトテシン類似物質はより強力になることが示されている。例えば、メチレンジオキシ基またはエチレンジオキシ基が10位と11位に結合したものは5員環または6員環を形成するが、これはより水溶性が高い誘導体となり効果が強くなる。またエチレンジオキシ置換体はメチレンジオキシ置換体よりも効果は少ないことが示されている。その理由はエチレンジオキシ置換体と酵素との間にできる望ましくない立体的相互作用のためである[3][7]。
9位のアミノ基やクロロ基、あるいは7位のクロロメチル基に10,11-メチレンジオキシ類似物質を付加すると細胞毒性を増加させるが、水溶性は低下する。10,11-メチレンジオキシまたはエチレンジオキシ類似物質をよく水に溶けるようにするいい方法は、7位に水溶性置換基を導入することである。
ルートテカン(Lurtotecan)は以下のものを要求する。7位の4-メチルピペラジノ-メチレンを10,11-エチレンジオキシ類似物質にすると非常に強力になることが臨床的研究でしめされている[3]。
7位と9位の間にも、10位と11位と同様に環が形成される。これは水溶性誘導体を作る新たな機会を生み出す。これらの6員環カンプトテシンは電子求引性基が11位に、メチル基またはアミノ基が10位に置かれた場合に最も活性が高くなる。エキサテカン(exatecan)は6員環カンプトテシンの一例で、これは7位と9位に6員環が、10位がメチル基に、11位がフルオロ基に置換されたものである。これがトポテカン(topotecan)よりも水溶性で最も強力である[3][7][9]。
C環とD環の修飾
C環とD環は抗腫瘍活性において欠かせない役割を持っている。他の細胞毒性分析において、いずれの位置の置換も元の化合物より効果が減少する[3]。
E環の修飾

E環の構造的変化の多くはカンプトテシン活性を失わせる。有効な置換として考えられるのは、ヒドロキシ基を塩素(Cl)、フッ素(F)、臭素(Br)のいずれかと置換するというものである。というのもこれらの分極率(polarizability)はいずれも酵素複合体を安定化させるのに十分だからである[7]。
他の可能性のある修飾は、E環のヒドロキシ基とラクトンとの間にメチレン基を挿入するというもので、これによって7員環β-ヒドロキシラクトン基ができる。これはいわゆるホモカンプトテシン(homocamptothecin、hCPT)と呼ばれるものである。ホモカンプトテシンのヒドロキシ基はラクトンを非常に活性化させるカルボキシ基の誘電効果を低減させる。これはトポIに最適な遊離状態のヒドロキシ基と、その存在によってより安定化する共有結合複合体との間の相互作用を促進する。
ホモカンプトテシンのE環はよりゆっくりと開き、その開裂反応は不可逆的である。ホモカンプトテシンはヒトの血漿での安定性がカンプトテシンよりも向上する。なぜならタンパク質結合が減少し、赤血球への親和性が増すからである[3][7]。
カンプトテシン類似物質
カンプトテシンの発見以来、様々なカンプトテシン類似物質が合成されてきた。以下に示すのは、上述したカンプトテシン類似物質の概略図である。

| 類似物質 | R1 | R2 | R3 | R4 |
|---|---|---|---|---|
| トポテカン(Topotecan) | -H | CH2N(CH3)2 | -OH | H |
| イリノテカン(Irinotecan) | CH2CH3 | H |  |
H |
| DB 67 |  |
H | OH | H |
| BNP 1350 | CH2CH2Si(CH3)3 | H | H | H |
| エキサテカン(Exatecan) | 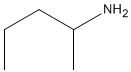 |
CH3 | F | |
| ルートテカン(Lurtotecan) |  |
H | 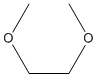 | |
| ST 1481 | CH=NOC(CH3)3 | H | H | H |
| CKD 602 | CH2CH2NHCH(CH3)2 | H | H | H |
参照文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

