アミロイドβ
アルツハイマー病患者の脳に見られるアミロイド斑の主成分たるペプチド ウィキペディアから
アミロイドβ(アミロイドベータ、英: Amyloid beta、略称: Aβ)は、アルツハイマー病患者の脳に見られるアミロイド斑の主成分として、アルツハイマー病に重大な関与を行う36–43アミノ酸のペプチドである[2]。このペプチドはアミロイド前駆体タンパク質 (amyloid precursor protein, APP) に由来し、β-セクレターゼとγ-セクレターゼによる切断によって産生される。Aβ分子は凝集し、いくつかの形態の柔軟な可溶性のオリゴマーを形成する。現在では、特定の誤ったフォールディング(ミスフォールディング)をしたオリゴマー(「シード」として知られる)が他のAβ分子のミスフォールドを誘導し、プリオンの感染と類似した連鎖反応が引き起こされると考えられている。(アミロイドβをプリオンの一種とみなす考え方もある。[3])このオリゴマーは神経細胞に対する毒性がある[4]。アルツハイマー病への関与が示唆される他のタンパク質であるタウタンパク質も同様にプリオン様のミスフォールドオリゴマーを形成し、ミスフォールドしたAβがタウのミスフォールドを誘導するという証拠も存在する[5][6]。
| Amyloid beta peptide (beta-APP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 識別子 | |||||||||
| 略号 | APP | ||||||||
| Pfam | PF03494 | ||||||||
| InterPro | IPR013803 | ||||||||
| SCOP | 2lfm | ||||||||
| SUPERFAMILY | 2lfm | ||||||||
| TCDB | 1.C.50 | ||||||||
| OPM superfamily | 304 | ||||||||
| OPM protein | 2y3k | ||||||||
| Membranome | 45 | ||||||||
| |||||||||
正常な機能
Aβの正常な機能はあまり解明されていない[8]。いくつかの動物での研究において、Aβの不在は明確な生理学的機能の喪失を引き起こさないことが示されている[9][10]。一方で、キナーゼの活性化[11][12]、酸化ストレスからの保護[13][14]、コレステロールの輸送の調節[15][16]、転写因子としての機能[17][18]、抗菌活性(Aβの炎症促進活性と関連している可能性)[19][20][21] など、いくつかの活性を有する可能性が発見されている。
グリンパティック系は哺乳類の脳から代謝廃棄物、特にAβを除去する[22]。除去の速度は睡眠中に大きく増加する[23]。しかし、アルツハイマー病に関して、グリンパティック系によるAβの除去の重要性は不明である[24]。
疾患との関連
要約
視点
Aβはアミロイド斑(アルツハイマー病の患者の脳に見つかる細胞外沈着物)の主要な構成要素である[25]。同様の斑はいくつかのレビー小体病や封入体筋炎においても出現する。また脳アミロイド血管症では、Aβは脳の血管を覆う凝集体を形成する。アミロイド斑はアミロイド線維と呼ばれる規則的に並んだ線維状凝集体から構成され[26]、そのフォールドは、タンパク質ミスフォールディング病と関連するプリオンなどの他のペプチドと共通している。
アルツハイマー病
可溶性オリゴマー状態のペプチドがアルツハイマー病の発症の原因因子である可能性が、研究からは示唆されており[27][28]、Aβのオリゴマーが最も毒性が高いと一般的には考えられている[29]。イオンチャネル仮説では、可溶性で非線維型のAβが膜でイオンチャネルを形成して神経細胞への無秩序なカルシウムの流入を引き起こし[30]、このことがアルツハイマー病で見られるカルシウムイオンの恒常性の破綻とアポトーシスの根底にあると想定されている[31][32]。また計算機による研究においても、Aβのペプチドは主にヘリックス型の形状で膜へ埋め込まれてオリゴマー化すること[33]、そして最終的にはチャネルを形成し、その安定性とコンフォメーションはコレステロールの存在と配置に敏感に関連するものであることが示されている[34]。遺伝学、細胞生物学、生化学、動物を用いた多数の研究によって、Aβがアルツハイマー病の病理に中心的な役割を果たすという概念は支持されている[35][36]。
脳のAβは孤発性アルツハイマー病の患者で上昇している。Aβは脳実質と脳血管のアミロイドの主要な構成要素であり、脳血管の病変に寄与し、神経毒性がある[35][36][37][38]。Aβがどのように中枢神経系に蓄積し、その後どのように細胞の病変が開始されるかについては解明されていない。一部の研究者は、Aβのオリゴマーがインスリン受容体の結合部位に関してインスリンと競合することで脳のグルコース代謝が損なわれ、アルツハイマー病の症状の一部が引き起こされることを発見した[39]。前駆体タンパク質APPからAβを作り出すタンパク質分解酵素であるγ-セクレターゼやβ-セクレターゼなど、Aβの産生を担う機構に関しては集中的にかなりの労力が注がれてきた[40][41][42][43]。Aβは主に可溶性のAβ40の形態で脳脊髄液や脳間質液などの体液中を循環する[35][44]。老人斑はAβ40とAβ42の双方を含み[45]、脳血管のアミロイドは主に短いAβ40からなるが、どちらの病変においても複数種類の配列のAβが見つかる[46][47][48]。中枢神経系におけるAβの生成は神経細胞の軸索の膜において、APPによって媒介されてβ-セクレターゼとプレセニリン1 (PS1) が軸索へ輸送された後に起こる[49]。
Aβの総量、またはAβ40とAβ42の相対的濃度[前者は脳血管の斑に、後者はneuritic plaque(周囲に神経突起を伴う老人斑)に濃縮されている]のいずれかの増加と[50]、家族性・孤発性アルツハイマー病の病理との関係が示唆されている。Aβ42はより疎水的であるため、最もアミロイド形成能の高い形態のペプチドである。中央部に存在する配列KLVFFAEがアミロイドを形成することが知られており[51]、おそらく線維の核を形成している。ある研究では、脳内のAβ42のレベルはアルツハイマー病の発症だけでなく脳脊髄液圧の低下とも相関しており、Aβ42断片の蓄積または除去不能が病理に関与している可能性が示唆されている[52]。
アミロイド斑がアルツハイマー病の病因であるとする「アミロイド仮説」は大多数の研究者に受け入れられているが、決定的に確立されているわけではない。代替的な仮説では、アミロイド斑よりもむしろアミロイドのオリゴマーが病気の原因となっているとされる[29][53]。オリゴマーを形成するがアミロイド斑を形成しないような遺伝子改変 (APPE693Q) がなされたマウスは、病気を発症する。さらにオリゴマーをアミロイド斑へ変換する改変がなされたマウス (APPE693Q X PS1ΔE9) は、オリゴマーだけを発現するマウスよりも症状が悪化することはない[54]。アルツハイマー病ではタウタンパク質の細胞内の蓄積も見られ、α-シヌクレインの凝集と同様に、これが疾患に関与している可能性もある。
がん
Aβはがんの発生への関与が示唆されており、その影響の解明のためにさまざまながんで研究が行われているが、その結果はほとんど決定的ではない。食道がん、大腸がん、肺がん、肝がんなどの生存者はアルツハイマー病の発症リスクが低下することが観察されており、多数のがんでAβのレベルが測定されている。すべてのがん、特に肝がんでAβのレベル上昇と正の関連があることが示された[55]。しかし、この関連の方向性はまだ確立されていない。ヒトの乳がんの細胞株に焦点を当てた研究では、これらのがん細胞株ではアミロイド前駆体タンパク質の発現レベルが上昇していることが示された[56]。
ダウン症候群
ダウン症候群の成人では、認知機能、記憶、微細運動、実行機能、視空間技能の低下などのアルツハイマー病の証拠と関連して、アミロイドの蓄積がみられた[57]。
形成
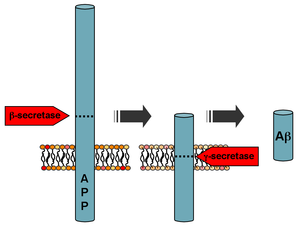
Aβは、機能未知の膜貫通型糖タンパク質であるAPPの連続的な切断によって形成される。APPはタンパク質分解酵素であるα-セクレターゼ、β-セクレターゼ、γ-セクレターゼによって切断されるが、Aβはβ-セクレターゼとγ-セクレターゼの連続的な作用によって生成される。AβペプチドのC末端を作り出すγ-セクレターゼはAPPの膜貫通領域の内部を切断し、30–51アミノ酸長の多数のアイソフォームが生み出される[58]。最も多いアイソフォームはAβ40とAβ42である。より長いAβ42は一般的には小胞体での切断によって生み出され、より短いAβ40はトランスゴルジ網での切断によって生み出される[59]。両者の間ではAβ40の方が多数を占めるが、より線維原性が高くそのため疾患と関連していると考えられているのはAβ42である。アルツハイマー病の早期の発症と関連するAPPの変異は、Aβ42の産生を相対的に増加させることが指摘されており、β-セクレターゼとγ-セクレターゼの活性を、主にAβ40を産生するように調節することがアルツハイマー病の治療法となる可能性が示唆されている[60]。
この治療的アプローチの大きな問題の1つは、β-セクレターゼやγ-セクレターゼのような、アミロイド形成経路以外にも機能的な役割を持つ酵素に干渉しなければならないことである。そのような例としてはγ-セクレターゼ阻害剤によってアプローチした臨床試験が挙げられ、この試験は重度の認知機能障害および皮膚がんの発生率の上昇などの結果に直面した[61]。
遺伝学
APPの常染色体優性変異は遺伝性の家族性アルツハイマー病を引き起こす。この形態のアルツハイマー病は全症例の10%以下であり、大部分はこのような変異を伴わないものである[63]。家族性アルツハイマー病は、タンパク質分解のプロセシングの変化の結果生じていると考えられる。
構造と毒性
Aβは一般的に天然変性タンパク質であると考えられている。このことは、Aβが溶液中では特定の三次元フォールドを取るのではなく、一群の複数の構造からなることを意味している。そのため結晶化されず、Aβに関する構造情報はNMRと分子動力学計算に由来している。Aβの26アミノ酸ポリペプチド (Aβ10–35) のNMR由来の初期のモデルは、明らかな二次構造要素が存在しない崩壊したコイル構造を示している[65]。しかし、より最近 (2012) のNMR構造 (Aβ1–40) は明確な二次構造と三次構造を有している[66]。レプリカ交換法による分子動力学計算からは、Aβは実際に異なる複数の構造状態からなることが示唆されており[67]、より近年の研究では、統計的な分析によって非常に多数の異なるコンフォメーションのクラスターが同定されている[68]。NMRに基づくシミュレーションによると、Aβ1–40とAβ1–42も非常に異なるコンフォメーションを取るようであり[69]、Aβ 1–42のC末端はAβ1–40よりも構造的である。
低温・低塩状態では、β構造を持たない五量体の円盤状のオリゴマーを単離することが可能である[70]。対照的に、界面活性剤の存在下で調製された可溶性オリゴマーは、線維のものとは異なる、平行型と逆平行型が混合したβシート構造を相当量含むという特徴があるようである[71]。計算機を用いた研究では、膜に埋め込まれたオリゴマーはβ-ターン-βモチーフ構造であることが示唆されている[72]。
Aβが神経を損傷し細胞死を引き起こす方法として示唆されている機構には、自己凝集の過程における活性酸素種の産生も含まれている。In vitroでは、神経細胞膜でこれが起こると、脂質過酸化反応が引き起こされて4-ヒドロキシノネナールと呼ばれる有毒なアルデヒドが産生され、イオン駆動性ATPアーゼ、グルコーストランスポーター、グルタミン酸トランスポーターの機能を損傷する。結果として、Aβは神経細胞膜の脱分極、カルシウムの過剰な流入、ミトコンドリアの損傷を促進する[73]。Aβペプチドの凝集はin vitroで膜を破壊する[74]。
介入戦略
要約
視点
→詳細は「アルツハイマー病の研究」を参照
アルツハイマー病の研究者は、アミロイドに対する可能な介入戦略をいくつか発見している[75]。
- β-セクレターゼ阻害剤: これらは細胞内の小胞体でのAPPの最初の切断を防ぐ。
- γ-セクレターゼ阻害剤 (セマガセスタットなど): これらは細胞膜でのAPPの2番目の切断を防ぎ、その後のAβと毒性断片の形成を止める。
- 選択的Aβ42低下薬剤 (タレンフルルビルなど): これらはγ-セクレターゼを調節し、Aβ42の産生を減少させて他の (より短い) Aβ断片の産生が起こりやすくする。
β-セクレターゼとγ-セクレターゼはAPPの細胞内ドメインからAβの産生を担うため、これらの活性を部分的に阻害する化合物が熱心に探し求められている。β-セクレターゼとγ-セクレターゼの部分的阻害を開始するためには、化合物はアスパラギン酸プロテアーゼの巨大な活性部位をブロックする必要があるが、それと同時に血液脳関門を通過する必要もある。
- 免疫療法: これはAβを認識して攻撃するよう、またはアミロイド斑の蓄積を防ぐかアミロイド斑やAβオリゴマーの除去を促進するよう、宿主の免疫系を刺激するものである。オリゴマー化は、個々の分子が有限個の分子からなる鎖へと変換される化学的過程である。Aβのオリゴマー化の防止は、能動的また受動的なAβに対する免疫化の一例である。この過程では、Aβに対する抗体は脳のアミロイド斑のレベルを低下させるために用いられる。アミロイドレベルの低下はミクログリアによる除去、またはペプチドを脳から体循環への再分配の促進によって行われる。現在臨床試験が行われているAβを標的とする抗体には、アデュカヌマブ、バピネウズマブ、クレネズマブ、ガンテネルマブ、ソラネズマブなどがある[76][77]。 このうちアデュカヌマブはP3中止が発表された[78][79]。CAD106やUB-311などのAβワクチンも現在臨床試験が行われている[76]。しかしながら、文献レビューでは免疫療法の有効性に疑問が投げかけられている。10種類の抗Aβ42抗体を調査した研究では、各試験では最小限の認知保護効果しか得られていないことが示されており、試験が行われた時点では症状が進行し過ぎていたためであると考えられる。無症候性の患者に適用し疾患の進行の早期における有効性を評価するためには、さらなる開発が依然として必要である[80]。
- 抗凝集薬剤[81] (アポモルヒネ、カルベノキソロンなど): カルベノキソロンは消化性潰瘍の治療によく用いられているが、神経保護効果も示し、言語流暢性や記憶固定といった認知機能を改善することが示されている。Aβ42断片に主に水素結合を介して強い親和性で結合することで、カルベノキソロンはペプチドが凝集する前に捕捉して不活性状態にし、また既に形成された凝集体を不安定化してそれらの除去を助ける[82]。これは抗凝集薬剤に大まかに共通の作用機構である[83]。
- スタチンなどのコレステロール低下薬の長期使用はアルツハイマー病の発症率の低下と関連していることが示されている。APPが遺伝学的に改変されたマウスでは、コレステロール低下薬は病理の全体的に抑制することが示されている。その機構はあまり解明されていないが、コレステロール低下薬はAPPのプロセシングに直接的な影響を与えているようである[84][85]。
- ノルバリンはアルツハイマー病治療薬の候補となる薬剤である。ノルバリンはアルギナーゼ阻害剤であり、血液脳関門を容易に通過し、脳におけるアルギニンの喪失を低減させる。Aβの蓄積は、L-アルギニンの不足と神経変性とに関連している。ノルバリンを投与されたマウスは、空間記憶が改善し、神経可塑性関連タンパク質が増加し、Aβが減少した[86]。
- エルゴチオネインはトランスポーターOCTN1を介して血液脳関門を通過する水溶性アミノ酸である。エルゴチオネインにAβの蓄積阻害作用があることが示唆された[87]。
アミロイドβの計測

イメージング化合物、特にチオフラビンの1種であるピッツバーグ化合物B (Pittsburgh compound B, 6-OH-BTA-1) は、in vitroおよびin vivoでAβに選択的に結合する。この技術は、PETイメージングと組み合わせることで、アルツハイマー病患者においてアミロイド斑が蓄積した領域のイメージングに利用される[88]。
死後または組織生検による測定
Aβは免疫染色によって準定量的に測定することが可能であり、またAβが存在する位置も決定することができる。Aβは、脳アミロイド血管症の場合のように主に血管に存在するか、または白質中の老人斑に存在する[89]。
Aβを検出する高感度の手法の1つはELISAであり、Aβを認識する1組の抗体を利用して行う免疫吸着分析である[90][91]。
原子間力顕微鏡はナノスケールの分子表面を可視化することが可能であり、in vitroでAβの凝集状態を決定するために利用される[92]。
二面偏波式干渉は、伸長する線維の分子サイズと濃度を測定することで、凝集の初期段階を計測することができる光学的技術である[93][94]。これらの凝集過程は、脂質二重層上でも研究を行うことができる[95]。
血液試料を用いた測定
インピーダンスに基づいて全血試料中のAβレベルを測定する新たな研究の有望性が示されている。抗Aβ抗体とともに調製されたくし型微小電極を用いて、抗体へのAβの結合に伴うインピーダンスの変化を計測する。対照マウスと変異型APP/PS1を持つトランスジェニックマウスに適用した場合、血漿中のAβレベルの差によって両者を区別することが可能であった[96]。
出典
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.