Treonina
composto chimico Da Wikipedia, l'enciclopedia libera
La Treonina, Thr o T[2], è un α-amminoacido utilizzato nella biosintesi delle proteine. La sua struttura contiene un gruppo carbossilico, che in condizioni fisiologiche si presenta in forma deprotonata ; rispetto a questo troviamo in posizione α una funzione amminica primaria che in condizioni fisiologiche si presenta in forma protonata , ed una catena laterale polare contenente un gruppo ossidrilico . Nelle condizioni di pH fisiologico la Treonina si trova come zwitterione neutro e polare. Essa è un aminoacido essenziale in quanto non viene sintetizzato dal corpo umano: può solo essere assunto attraverso la dieta. Quando ci si riferisce alla Treonina si intende la L-treonina, ossia lo stereoisomero acido-(2S,3R)-2-amino-3-idrossibutanoico, questa infatti è la configurazione naturale.[3]
| Treonina | |
|---|---|
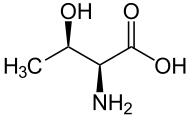 | |
 | |
| Nome IUPAC | |
| L-treonina | |
| Abbreviazioni | |
| T Thr | |
| Nomi alternativi | |
| acido 2(S)-ammino-3(R)-idrossibutanoico acido α-amminico-β-idrossibutirrico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H9NO3 |
| Massa molecolare (u) | 119,12 |
| Aspetto | solido cristallino bianco |
| Numero CAS | |
| Numero EINECS | 201-300-6 |
| PubChem | 6288 e 6971019 |
| DrugBank | DBDB00156 |
| SMILES | C[C@H]([C@@H](C(=O)O)N)O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 293 K | pK1: 2,09 pK2: 9,10 |
| Punto isoelettrico | 5,64 |
| Solubilità in acqua | 200 g/L a 298 K |
| Coefficiente di ripartizione 1-ottanolo/acqua | -0.7 |
| Temperatura di fusione | 255 °C (528 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −807,2 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 3098 (intraperitoneale, ratto) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
Fonti alimentari
Riepilogo
Prospettiva
La treonina è uno degli amminoacidi di cui sono composte proteine e peptidi, sia animali che vegetali. Si assume che, per un adulto, il fabbisogno giornaliero sia di 15 mg/kg di peso corporeo.[4] Gli esempi nella tabella seguente riportano le più abbondanti fonti alimentari di Treonina basata su 100 g di alimento; la percentuale è indicata sulla quantità totale di proteine.[5]
| Alimento | Treonina
[g/100 g di alimento] |
Proteine
[g/100 g di alimento] |
Treonina/Proteine
[%] |
|---|---|---|---|
| Albume disidratato | 3,69 | 81,1 | 2,99 |
| Proteine di soia isolate | 3,14 | 88,32 | 2,77 |
| Spirulina disidratata | 2,29 | 57,47 | 1,32 |
| Merluzzo | 2,75 | 62,82 | 1,73 |
| Soia | 1,95 | 49,2 | 0,96 |
| Farina di arachidi | 1,79 | 52,2 | 0,93 |
| Latte in polvere | 1,6 | 35,5 | 0,57 |
| Fesa di vitello | 1,56 | 35,73 | 0,56 |
| Manzo sgrassato cotto | 1,56 | 29,7 | 0,46 |
| Parmigiano | 1,53 | 37,86 | 0,58 |
| Farina di soia | 1,51 | 38,09 | 0,58 |
| Pancetta affumicata | 1,5 | 33,92 | 0,51 |
| Carne di coniglio cotto | 1,48 | 33,02 | 0,49 |
| Grana | 1,32 | 35,75 | 0,47 |
Negli alimenti indicati la Treonina è presente quasi esclusivamente come residuo peptidico e non in forma libera.
Storia
La Treonina è stato l’ultimo tra i 20 comuni amminoacidi proteici ad essere scoperto. È stata individuata nel 1936 ad opera di William Cumming Rose, in collaborazione con Curtis Meyer. Questo amminoacido è stato chiamato Treonina in quanto simile nella struttura all'acido treonico, un monosaccaride di formula molecolare .[6]
Chimica
Riepilogo
Prospettiva
Stereochimica
Tra gli amminoacidi proteinogenici la Treonina fa parte, assieme all'isoleucina, della ristretta famiglia di α-amminoacidi naturali contenenti due centri stereogenici. I possibili stereoisomeri sono quattro e posseggono rispettivamente configurazione assoluta: (2S,3R), (2R,3S), (2S,3S) e (2R,3R). Quando si parla di L-treonina ci si riferisce allo stereoisomero (2S,3R), il più rappresentato in natura. Raramente è possibile trovare in composti biologici lo stereoisomero (2S,3S) chiamato L-allotreonina[2], principalmente come metabolita vegetale.[7]
  |
| L-Treonina (2S,3R) e D-Treonina (2R,3S) |
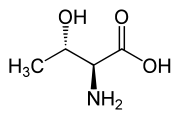 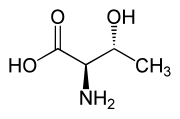 |
| L-allo-Treonina (2S,3S) e D-allo-Treonina (2R,3R) |
Biochimica
La Treonina fa parte degli amminoacidi con catena laterale polare. All'interno delle proteine i residui di treonina si possono trovare nella porzione centrale della struttura secondaria di foglietto β: solo per questo amminoacido risulta essere la posizione preferenziale.[8][9]
Quando presenti in α eliche i residui di treonina modificano la normale struttura delle stesse:[10] la catena laterale della treonina forma spesso legami ad idrogeno con la serina dando luogo a motivi riccorrenti, come l'ST-turn[11], ST-motif[12][13] e ST-staple.[14][15]
Analogamente alla serina, il suo gruppo laterale può subire reazione di O-glicosilazione, cioè l'addizione di una molecola di glucosio, oltre a fosforilazione (con serina, tirosina, idrossiprolina e idrossilisina): questa è una caratteristica fondamentale, per esempio, per spiegare il funzionamento, dei recettori cellulari di membrana.
Biosintesi
Riepilogo
Prospettiva

La Treonina, come accennato, non viene sintetizzata nel corpo umano, ma una sua sintesi può essere riscontrata in altri tipi di organismi. La biosintesi della Treonina in E. coli comincia con la formazione del piruvato a partire dal glucosio tramite la glicolisi.[16] Il piruvato viene ossidato ad acido ossalacetico ad opera del piruvato carbossilasi. Quest'ultimo subisce il trasferimento di un gruppo amminico per mezzo della aspartato transaminasi per formare L-aspartato.[17] A partire dall'L-aspartato cominciano una serie di vie metaboliche che conducono alla sintesi di diversi amminoacidi: Lisina, Metionina, Isoleucina, Glicina e Treonina; nello schema a fianco è riportata la sola via che conduce all'amminoacido di interesse.[18] Nella fattispecie:
- Lo L-aspartato viene fosforilato ad aspartil-β-fosfato per mezzo dell'enzima aspartato chinasi consumando ATP. A questo livello si ha il controllo inibitorio della via di sintesi tramite retroinibizione da prodotto finale data dalla Treonina stessa.
- A questo punto il substrato subisce una riduzione con rimozione del gruppo fosfato e formazione del gruppo aldeidico della aspartil semialdeide ad opera della aspartato-semialdeide deidrogenasi, consumando .
- Successivamente la aspartil semialdeide viene ridotta a L-omoserina ad opera dell'omoserina deidrogenasi, consumando ulteriore .
- Quindi si ha una O-fosforilazione della L-omoserina ad opera della omoserina chinasi a produrre la 4-fosfo-L-omoserina consumando ATP.
- Quest'ultima viene de-fosforilata ad opera della liasi treonina sintasi formando la L-treonina.[16]
Catabolismo
Riepilogo
Prospettiva
La L-treonina è catabolizzata in un sistema complesso di vie metaboliche, che in quanto tale è difficilmente razionalizzabile unitariamente. Complessivamente esistono quattro principali vie di degradazione:[19]

- Nella prima la Treonina è catabolizzata dalla treonina deidratasi a 2-ossabutanoato, il quale è convertito a propanoil-CoA[20]
- Nella seconda via la treonina è ossidata dalla L-treonina 3-deidrogenasi a formare L-2-ammino-3-ossobutanoato tramite , scisso successivamente dal 2-ammino-3-chetobutirrato CoA ligasi in glicina ed acetil-CoA: questa via è stata osservata in archibatteri[21], batteri[22], funghi[23], uccelli[24] e mammiferi[25]. In assenza dell'ultimo enzima lo L-2-ammino-3-ossobutanoato si converte in 1-ammino-2-propanone; quest'ultimo può essere trasformato in metilgliossale, grazie a l'ossigeno e a ammino ossidasi.[26]
- Nella terza via metabolica, differentemente da quanto detto per la seconda, anziché in metilgliossale la L-treonina viene trasformata in (R)-ammino-2-propanolo O-2 fosfato, grazie all'azione della L-treonina chinasi.[27]
- Nella quarta via scinde la treonina direttamente in glicina ed acetaldeide tramite l'enzima L-treonina aldolasi; quest'ultima via è stata dimostrata grazie a studi su alcuni ceppi di Pseudomonas putida.[28]
Nessuna di queste vie è completamente rappresentata in un unico organismo: lo schema riportato è il sunto della gran parte delle vie metaboliche scoperte.
Produzione
Riepilogo
Prospettiva

La L-treonina non viene prodotta per sintesi chimica, in quanto il processo risulta economicamente poco conveniente, a causa della formazione del diastereoisomero (2S,3S) che rende troppo costosa la purificazione del prodotto.[29][30] Si predilige quindi la sintesi per fermentazione, utilizzando un bioreattore in cui si fa avvenire la crescita di opportuni batteri ingegnerizzati allo scopo di produrre grandi quantità di L-treonina in maniera stereoselettiva. Una volta conclusa la fase di fermentazione, vi è una separazione della biomassa cellulare con tecniche di ultrafiltrazione o centrifugazione: la biomassa ottenuta può essere utilizzata nella formulazione di fertilizzanti.[31] In passato, a questo punto, si procedeva con una separazione in colonna a scambio ionico degli aminoacidi, ma questa tecnica è caduta in disuso a fronte di progressi in campo tecnico.[29][31] Attualmente si procede con il trattamento delle acque madri aggiustando il pH della miscela ottenuta: il controllo del pH è di estrema importanza per le successive fasi di cristallizzazione, si riscontra infatti che certi amminoacidi cristallizzano solo da soluzioni che si trovano in uno specifico range di pH. È quindi necessario il suo controllo per ottenere una cristallizzazione in maniera selettiva verso un amminoacido e il più quantitativa possibile.[32][33] La lavorazione procede con successive fasi di concentrazione termica, e infine si fa avvenire la cristallizzazione della L-Treonina.[29] L'ultima fase della produzione è la separazione dei cristalli dalle acque madri, che vengono riciclate, e l'essiccamento del prodotto ottenuto.[31][32]
Utilizzi
Riepilogo
Prospettiva
Uomo
Si possono trovare commercialmente miscele di amminoacidi contenenti anche la treonina, generalmente utilizzati per la nutrizione parenterale.[34]
Si è studiata la sua applicazione nell'ambito della neurologia per il trattamento di patologie come la sclerosi laterale amiotrofica[35][36], la sclerosi multipla[37][38][39] e spasticità[40]: non risultano ancora evidenze scientifiche circa l'utilità di terapie di questo tipo, ed anzi in taluni casi si sono evidenziati addirittura possibili trend negativi, ancora da dimostrare.[35]
Allevamento
Integratori di L-treonina sono utilizzati anche nell'industria della produzione di mangimi: nella fattispecie è stato provato come possa migliorare l'immunità, la salute intestinale, le capacità antiossidanti e la performance di crescita dei polli in tenera età.[41] Una sua supplementazione in eccesso in galline ovaiole ha dimostrato anche l'incremento delle prestazioni di posa e dell'unità Haugh.[42] Entrambi i fattori descritti risultano essere importanti perché limitano l'impiego di risorse naturali.
Organocatalisi
Molti derivarti della Treonina, particolarmente gli O-terz-butildimetilsilil derivati, sono utilizzati come organocatalizzatori nelle reazioni di condensazione aldolica stereoselettiva, e varianti di essa, di chetoni ciclici con aldeidi: il meccanismo d'azione è quello via enammina e la tecnica fornisce buone rese con elevati eccessi enantiomerici.[43][44][45][46] L'utilizzo di questi catalizzatori risulta particolarmente utile, in quanto la L-treonina è commercialmente disponibile in forma enantiopura a prezzi molto accessibili.
Note
Voci correlate
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.






