Ciclopropano
composto chimico Da Wikipedia, l'enciclopedia libera
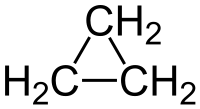
Il ciclopropano è un idrocarburo ciclico formato da tre atomi di carbonio e da sei atomi di idrogeno (C3H6) o (CH2)3, da cui il vecchio nome di trimetilene datogli dallo scopritore A. Freund nel 1882.[3] È una molecola di simmetria elevata (D3h)[4] ed il più semplice dei cicloalcani. L'anello è il più piccolo possibile: questo e la tensione che ne deriva (vide infra) fa del ciclopropano una molecola di notevole interesse teorico[5][6] e determina inoltre una particolare reattività, con la possibilità di apertura dell'anello stesso e quindi della rottura di un legame C–C.[7]
| Ciclopropano | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H6 |
| Massa molecolare (u) | 42,08 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 200-847-8 |
| PubChem | 6351 |
| DrugBank | DBDB13984 |
| SMILES | C1CC1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,68 (liq. a -33 °C) |
| Indice di rifrazione | 1,3799 (-42 °C) |
| Solubilità in acqua | 502 mg/L |
| Coefficiente di ripartizione 1-ottanolo/acqua | 1,72 |
| Temperatura di fusione | −127 °C (146 K) |
| Temperatura di ebollizione | −32,8 °C (240,4 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 220 - 280 |
| Consigli P | 210 - 410+403 [1][2] |
A temperatura ambiente è un gas incolore facilmente liquefacibile, dall'odore idrocarburico dolce, molto infiammabile.[8] Alcuni suoi derivati rivestono importanza in campo biologico e biochimico.[9] È stato usato come anestetico.[10]
Struttura e proprietà
Il ciclopropano, pur essendo cineticamente stabile, è un composto endotermico: ΔHƒ° = +39,30 kJ/mol;[11] infatti, riscaldato ad alta temperatura (450-500 °C), si isomerizza a propene[12] (meno endotermico, ΔHƒ° = +20,41 kJ/mol[13]) e i meccanismi di questa reazione sono stati esaminati in dettaglio;[14][15] se la stessa è operata con nichel metallico come catalizzatore, la reazione procede già a partire da 120 °C, mentre per l'analoga reazione del ciclobutano occorrono 200 °C.[16]
Con un'indagine di diffrazione elettronica[17] in fase gassosa è stato possibile determinare per il ciclopropano le lunghezze di legame C-C, (150,1 pm) e queste risultano minori della lunghezza C-C standard negli alcani, che è di 154 pm; la lunghezza dei legami C-H è di 108,3 pm, lievemente minore del normale (109 pm[18]); gli angoli ∠HCH, di 114,5°,[19][20] risultano maggiori del valore atteso per l'ibridazione sp3 (109,5°) e sono maggiori che nel CH2 nel propano (106,1°),[21] che è il corrispondente idrocarburo a catena aperta.
Tensione angolare e torsionale
Riepilogo
Prospettiva
I tre atomi di carbonio del ciclo giacciono nei vertici di un triangolo equilatero, ma gli angoli di 60° che necessariamente ne risultano si allontanano notevolmente dall'angolo di legame ideale (109,5°) del carbonio ibridato sp3; ciò genera una forte tensione angolare, la quale comporta il piegamento dei legami C-C verso l'esterno (banana bonds), indebolendoli.[22] Tutti gli atomi di idrogeno sono poi necessariamente tenuti in posizione eclissata (angolo diedro HCCH = 0°) e ciò dà luogo a tensione torsionale (o di eclissamento), la quale invece può essere parzialmente evitata nel ciclobutano non esattamente planare.
La somma di queste due tensioni (angolare e torsionale) costituisce la tensione d'anello, cui corrisponde un surplus di energia potenziale nella molecola e quindi una sua minore stabilità.[23] Tale destabilizzazione ammonta a 27,5 kcal/mol (~9,2 kcal/mol per atomo C), appena maggiore di quella del ciclobutano (26,5 kcal/mol, ma solo 6,6 kcal/mol per atomo C).[24]
Tutto questo si riflette in un comportamento chimico che differisce dai cicloalcani con anelli ad almeno cinque termini o superiori. Questo si evidenzia, in particolare, in una certa facilità a subire reazioni di apertura dell'anello tramite reazioni di addizione: addizione di H2 (idrogenazione catalitica) a dare propano, addizione di acidi alogenidrici HX ed anche di alogeni X2 per dare derivati a catena aperta: alogenuri di 1-propile e 1,3-dialogenopropano, rispettivamente; ancora, addizione di acqua in ambiente acido, per dare n-propanolo.[25] In tali reazioni il ciclopropano viene in parte ad assomigliare al comportamento degli alcheni.[25][26] Differisce però da questi ultimi nei riguardi dell'ossidabilità a freddo: con permanganato diluito o con ozono non reagisce.[25]
Ciclopropile
Il ciclopropile (ciclo-C3H5–), come sostituente, è un gruppo funzionale che assomiglia al vinile nella sua capacità di stabilizzare un radicale o un carbocatione adiacenti: in questo senso il ciclopropilmetile è spesso paragonato all'allile o al benzile.[27] Attraverso indagini di RMN e altri studi, a proposito del carbocatione ciclopropilmetile [(ciclo-C3H5)–CH2+] ,[28] si trova che l'orbitale p vuoto presente sul C cationico ibridato sp2 giace parallelo al piano dell'anello triatomico (omoconiugazione,[29] conformazione bisecata[30]) e che questa la disposizione è analoga a quella che si ha nella coniugazione di un anello ciclopropanico con un doppio legame adiacente.[31]
Sintesi
- Sintesi di Wurtz:
Br-CH2-CH2-CH2-Br + 2 Na → CH2--CH2 + 2 NaBr
\ /
CH2Questa reazione può avvenire anche con altri alogenuri alchilici bi-sostituiti (1,3-dicloro propano, ad esempio) e può essere catalizzata anche da altri metalli (ad esempio lo zinco).
- Addizione di carbene agli alcheni:
CH2=CH2 + CH2N2 → CH2--CH2
\ /
CH2
In realtà CH2N2 è una molecola di diazometano, composto che in presenza di luce genera il carbene (.CH2.), che è un radicale con due elettroni spaiati. Quest'ultimo è capace di inserirsi nel doppio legame formando il ciclo.
Reazioni
CH2--CH2 + 9/2 O2 → 3 CO2 + 3 H2O + calore
\ /
CH2- Idrogenazione a dare il propano:
CH2--CH2 + H2 → CH3-CH2-CH3
\ /
CH2- Trattamento con acidi alogenidrici (HCl,HBr,HI) a dare l'alogenuro alchilico corrispondente:
CH2--CH2 + HX → CH3-CH2-CH2-X
\ /
CH2Note
Voci correlate
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
