Berilium fluorida
senyawa kimia Dari Wikipedia, ensiklopedia bebas
Berilium fluorida adalah senyawa anorganik dengan rumus BeF2 . Padatan putih ini adalah prekursor utama untuk pembuatan logam berilium. Strukturnya menyerupai kuarsa, tetapi BeF2 sangat larut dalam air.
 | |
 | |
| Nama | |
|---|---|
| Nama IUPAC
Berilium fluorida | |
| Nama lain
Berilium difluorida Difluoroberilan | |
| Penanda | |
Model 3D (JSmol) |
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID |
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA) |
|
| |
| |
| Sifat | |
| BeF2 | |
| Massa molar | 47.01 g/mol higroskopis |
| Penampilan | tidak berwarna |
| Densitas | 1.986 g/cm3 |
| Titik lebur | 554 °C (1.029 °F; 827 K) |
| Titik didih | 1.169 °C (2.136 °F; 1.442 K)[1] |
| sangat mudah larut | |
| Struktur | |
| Trigonal, α-quartz | |
| P3121 (No. 152), simbol Pearson hP9[2] | |
a = 473.29 pm, c = 517.88 pm | |
| Linear | |
| Termokimia | |
| Kapasitas kalor (C) | 1.102 J/K or 59 J/mol K |
| Entropi molar standar (S |
45 J/mol K |
| Entalpi pembentukan standar (ΔfH |
-1028.2 kJ/g or -1010 kJ/mol |
| Energi bebas Gibbs (ΔfG) | -941 kJ/mol |
| Bahaya[3] | |
| Lembar data keselamatan | InChem MSDS |
| Piktogram GHS |     |
| Keterangan bahaya GHS | {{{value}}} |
| H301, H305, H311, H314, H315, H319, H330, H335, H372, H411 | |
| P201, P202, P260, P264, P270, P271, P273, P280, P281, P284, P301+310, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P308+313, P310, P312, P314, P320, P321, P322, P330, P361 | |
| Titik nyala | Tidak mudah terbakar |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median) |
90 mg/kg (oral, tikus besar) 100 mg/kg (oral, tikus)[4] |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan) |
TWA 0.002 mg/m3 C 0.005 mg/m3 (30 menit), dengan puncak maksimum 0.025 mg/m3 (sebagai Be)[5] |
REL (yang direkomendasikan) |
Ca C 0.0005 mg/m3 (sebagai Be)[5] |
IDLH (langsung berbahaya) |
Ca [4 mg/m3 (sebagai Be)][5] |
| Senyawa terkait | |
Anion lain |
Berilium klorida Berilium bromida Berilium iodida |
Kation lainnya |
Magnesium fluorida Kalsium fluorida Stronsium fluorida Barium fluorida Radium fluorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| verifikasi (apa ini ?) | |
| Referensi | |
Sifat
Berilium fluorida memiliki sifat optik yang khas. Dalam bentuk kaca fluoroberilat memiliki indeks bias terendah untuk padatan pada suhu kamar 1,275. Daya sebarnya paling rendah untuk benda padat pada 0,0093, dan koefisien nonliniernya juga paling rendah pada 2 × 10−14.
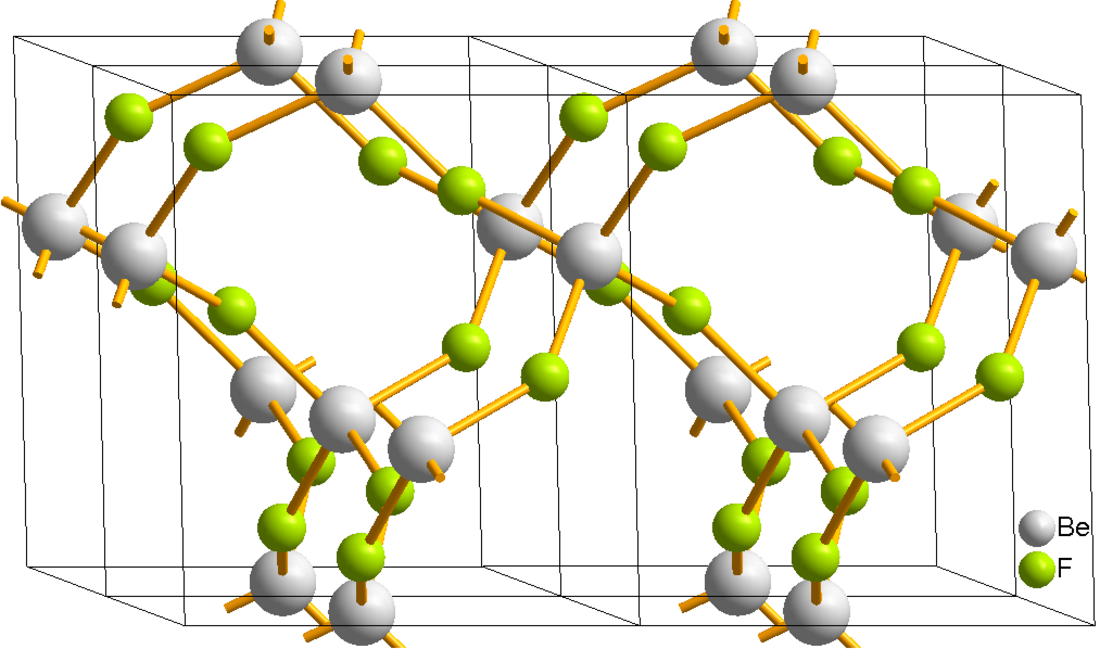
Struktur dan ikatan

Struktur padat BeF2 menyerupai kristobalit . Pusat Be2+ adalah empat koordinat dan tetrahedral dan pusat fluorida adalah dua koordinat.[6] Panjang ikatan Be-F sekitar 1,54 Å.[7] Serupa dengan SiO2, BeF2 juga dapat mengadopsi sejumlah struktur terkait. Sebuah analogi juga terdapat antara BeF2 dan AlF3 : keduanya mengadopsi struktur yang diperpanjang pada suhu rendah.
BeF2 gas dan cair
Gas berilium fluorida mengadopsi struktur linier, dengan jarak Be-F 143 pm.[8] BeF2 mencapai tekanan uap 10 Pa pada 686 °C, 100 Pa pada 767 °C, 1 kPa pada 869 °C, 10 kPa pada 999 °C, dan 100 kPa pada 1172 °C.[9]
'Molekul' berilium fluorida cair memiliki struktur tetrahedral yang berfluktuasi. Selain itu, kerapatan cairan BeF2 menurun di dekat titik bekunya, karena ion Be2+ dan F– mulai berkoordinasi lebih kuat satu sama lain, menyebabkan perluasan rongga antar unit formula.[10]
Produksi
Pemrosesan bijih berilium menghasilkan Be(OH)2 yang tidak murni. Bahan ini bereaksi dengan amonium bifluorida menghasilkan amonium tetrafluoroberilat:
- Be(OH)2 + 2 (NH4)HF2 → (NH4)2BeF4 + 2 H2O
Tetrafluoroberilat adalah ion yang kuat, yang memungkinkan pemurniannya dengan pengendapan berbagai ketidakmurnian sebagai hidroksidanya. Pemanasan murni (NH4)2BeF4 menghasilkan produk yang diinginkan:
- (NH4)2BeF4 → 2 NH3 + 2 HF + BeF2
Secara umum reaktivitas ion BeF2 dengan fluorida cukup analog dengan reaksi SiO2 dengan oksida.[11]
Penggunaan
Penyusutan BeF2 pada 1300 °C dengan magnesium dalam wadah grafit memberikan cara yang paling praktis untuk logam berilium:[8]
- BeF2 + Mg → Be + MgF2
Klorida bukanlah prekursor yang berguna karena volatilitasnya.[12][13]
Keselamatan
Senyawa berilium sangat beracun. Peningkatan toksisitas berilium dengan adanya fluoride telah dicatat sejak tahun 1949.[14] LD 50 pada tikus adalah sekitar 100 mg/kg melalui konsumsi dan 1,8 mg/kg melalui injeksi intravena.
Referensi
Pranala luar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.