Ֆոսգեն
քիմիական միացություն From Wikipedia, the free encyclopedia
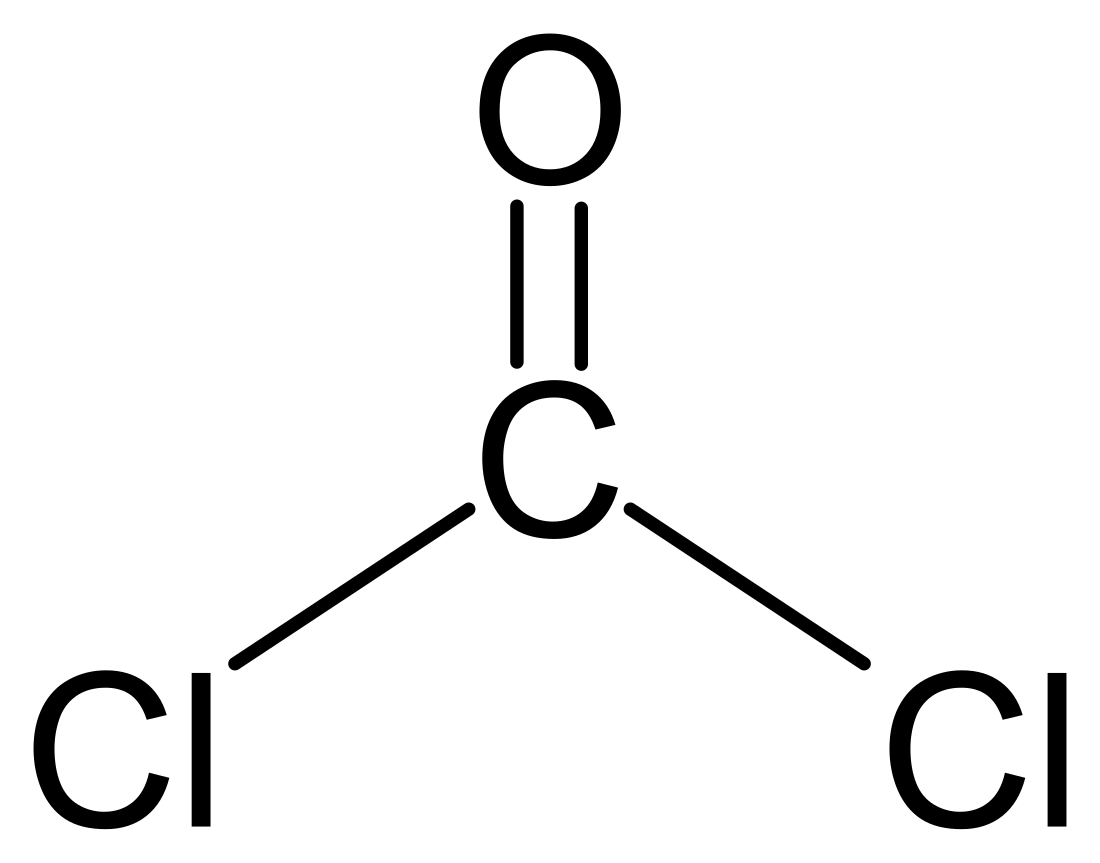
Ֆոսգեն (COCl2)։ Ածխաթթվի դիքլորանհիդրիդ։ Օգտագործվել է առաջին համաշխարհային պատերազմում, որպես թունանյութ։
| Ֆոսգեն | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | Կարբոնիլի դիքլորիդ |
| Ավանդական անվանում | ֆոսգեն |
| Քիմիական բանաձև | CCl₂O |
| Ֆիզիկական հատկություններ | |
| Ագրեգատային վիճակ | տհաճ հոտով անգույն գազ |
| Մոլային զանգված | 1,6E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,43 ± 0,01 գ/սմ³[2] գ/սմ³ |
| Իոնիզացման էներգիա | 11,55 ± 0,01 Էլեկտրոն-վոլտ[2] և 1,8E−18 ջոուլ[3] կՋ/մոլ |
| Հալման ջերմաստիճան | −198 ± 1 ℉[2] և −127,9 °C[3] °C |
| Եռման ջերմաստիճան | 47 ± 1 ℉[2] և 8 °C[3] °C |
| Գոլորշու ճնշում | 1,6 ± 0,1 մթնոլորտ[2] |
| Քիմիական հատկություններ | |
| Կառուցվածք | |
| Դիպոլ մոմենտ | 1,17 |
| Դասակարգում | |
| CAS համար | 75-44-5 |
| PubChem | 6371 |
| EINECS համար | 200-870-3 |
| SMILES | C(=O)(Cl)Cl |
| ЕС | 200-870-3 |
| RTECS | SY5600000 |
| ChEBI | 6131 |
| Թունավորություն | |
| Թունավորություն | խիստ թունավոր է, ունի խեղդող հատկություններ
 |
| IDLH | 8,1 ± 0,1 mg/m³[2] |
| ԳՀՀ պատկերագրեր |   |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Հատկություններ

Ջրում վատ է լուծվում, իսկ օրգանական լուծիչներում՝ լավ(բենզոլ, տոլուոլ, քլորոֆորմ, քացախաթթու և այլն)։ Այն թափանցիկ գազ է, որի հոտը նման է նեխած մրգերի հոտի։ 8,2 °C ջերմաստիճանից ցածր ջերմաստիճաննորում վեր է ածվում անգույն հեղուկի։ Սենյակային ջերմաստիճանում այն կայուն նյութ է։ Տաքացնելիս մասամբ քայքավում է առաջացնելով քլոր և շմոլ գազ, իսկ 800 °C բարձր ջերմաստիճանում ամբողջությամբ դիսոցվում է[4]։ Ֆոսգենի պայթյունից անջատված թունանյութերի քանակը շատ քիչ է, դրա համր ֆոսգենը օգտագործում են պայթուցիկ նյութերում։ Ֆոսգենը երկաթե բալոններում երկար պահելիս առաջանում է երկաթի պենտակարբոնիլ՝ Fe(CO)5 (կարմրադեղին հեղուկ, որը ծանր է ֆոսգենից և տրոհվում է լույսի ազդեցությամբ ֆոտոկատալիտիկ եղանակով, շմոլ գազի անջատմամբ)։ Ֆոսգենը համարյա չի հիդրոլիզվում, դրա համար ֆոսգենի ամպը երկար ժամանակ կարող է մնալ օդում։ Ակտիվ փոխազդում է ամոնիակի հետ առաջացնելով կարբամիդ և ամոնիումի քլորիդ`
- :
Այս ռեակցիան օգտագործվում է ֆոսգենի արտահոսքը հայտնաբերելու համար ամոնիակի լուծույթով թրջված բամբակը ֆոսգենի միջավայրում սկսում է արձակել ծուխ, որը կազմված է ամոնիումի քլորիդի բյուրեղներից։
- [5]:
Ֆոսգենի լրիվ պոլիկոնդեսացումից երկատոմ ֆենոլների հետ առաջացնում են պոլիկարբոնատներ`
- [5]:
Ֆոսգենը մտնում է Ֆրիդել-Կրաֆցի ռեակցիայի մեջ, օրինակ՝ եռակի արոմատիկ ամինների հետ, առաջացնելով ամինոխառնված դիարիլկետոններ, որոնք օգտագործում են ներկանյութերի սինթեզի համար՝
- :
Քանակական և որակական անալիզի համար օգտագործում նրա ռակցիան անալինի հետ N,N'դիֆենիլմիզանյութի CO(NHC6H5)2 առաջացմամբ[5]։
Ստացում

Առաջինը ֆոսգեն ստացավ Հեմֆրի Դեվին 1812 թվականին։ Ֆոսգենը ստացվում է քլորոֆորմի թթվեցումից օդի թթվածնով, լույսի ազդեցությամբ։ Արդյունաբերության մեջ ֆոսգեն ստանում են CO և Cl2 տաքացումով՝ ակտիվ ածխի առկայությամբ՝
- :
Լաբարատորիաում կարելի հեշտ ստանալ SO3-ի և CCl4-ի խառնուրդի տաքացումից՝
Որպես թունանյութ
Ունի խեղդող հատկություններ։ Մահացու կոնցետրացիան 0,01 - 0,03 մգ/լ, 15 րոպեի ընթացքում։0,022 մգ/լ կոնցենտրացիաով ֆոսգենը արդեն մահացու է 30 րոպեից։0.1 մգ/լ կոնցենտրացիաով ֆոսգենով թունավորման դեպքերի 50 տոկոսը 30 - 60 րոպեների ընթացքում բերել է մահվան, իսկ մնացած 50 տոկոսը մնացել են պարալիզացված։ Ֆոսգենի և թոքային հյուսվածքի հպաման ժամանակ առաջանում է ալվեոլների խոցելիություն և արագ զարգացող թոքային իդեմա։ Անտիդոտ գոյություն չունի։ Ֆոսգենից պաշտպանվել կարելի է միայն հակագազի միջոցով։
Թունային հատկությունները
Ֆոսգենի գոլորշիները շատ թունավոր են։ Թունավորման հստակ նախանշանները ի հայտ են գալիս թունավորումից 4-ից 8 ժամ հետո։ Տարբեր աղբյուրներում գրված տեղեկություններից ապացուցվել է, որ 0,004 մգ/լ կոնցենտրացիաով ֆոսգենը 60 - 90 րոպեների ընթացքում թունավորում չի առաջացնում։ 0,01 մգ/լ կոնցենտրացիաով ֆոսգեն պարունակող մթնոլորտում կարելի է մնալ ընդամենը մեկ ժամ։ Փոքր կոնցենտրացիաով ֆոսգենը ազդում է համային ռեցեպտորների վրա։ Ֆոսգենի հոտը զգացվում է 0,004 մգ/լ կոնցենտրացիաի ժամանակ, բայց ֆոսգենը խոչընդոտում է հոտառական նյարդի ազդեցության։ Այդ ժամանակ ֆոսգենի ավելի մեծ կոնցենտրացիաները անզգալի են մարդու կողմից։
Ֆիզիոլոգիական ազդեցությունը
Լատենտային շրջանից հետո առաջանում է ուժեղ հազ, հևոց և դեմքի ու շուրթերի կապտություն։ Արագ զարգացող իդեմիան տանում է շնչահեղձության։ Արյան ճնշումը կտրուկ ընկնում է, հիվանդը սկսում է շնչել աղմուկով և վերջապես մահանում։ Ֆոսգենի մեծ կոնցենտրցիաներով թունավորման ժամանակ իդեմիան չի զարգանում։ Հիվանդը սկսում է խորը շնչել, ընկնում է գետնին, սկսում է թպրտալ, երեսի գույնը սկսում է կապտել և հիվանդը մահանում է։ Հեգլերը ֆոսգենով թունավորումը նկարագրում էր այս օրինակով՝
| Ուժեղ և առողջ մի երիտասարդ, գետով անցնելիս պատահական ընկավ ֆոսգենի ամպի մեջ։ Նա արագ դուրս եկավ տհաճ հոտով մթնոլորտից` բարձանալով ցամաք։ Հետո երիտասարդը դիմեց բժշկին իր մոտ առաջացած հազի պատճառով։ Բժիշկը չկարողացավ հայտնաբերել հիվանդության որևէ նախանշաններ, սակայն նա հիվանդին զննեց շատն լավ։ Բժշկի բաղադրատոմսին հետևելով նա գնաց քայլելու։ Դրանից հետո չորս ժամ անց նրան բերեցին հիվանդանոց խորացված իդեմայով և ուժեղ ցիանոզով, բայց նրա սրտի աշխատանքը շատ լավ էր։ Դրանից 4,5 ժամ անց հիվանդը մահացավ։ - Հեգլեր |
Մունտշը այսպես է նկարագրել ֆոսգենով թունավորումը՝
| Ցիանոզը և հևոցը հասնում են իրենց բարձրագույն աստիճանին, սկսում են տնքալ և խնդրել օդ։ Մահացողը կարծես թե խեղդվում է սեփական հեղուկում, որը լցնում է նրա թոքերը ... - Մունտշ |
Օգտագործումը զինամթերքում

Զինական տեսանկյունից նրա կարևորագույն հատկություններից է լավ լուծելիությոունը քլորոպիկրինում, իպրիտում, արիլ և ալկիլքլորարսիններում և թթվային ծխագոյացնող նյութերում՝ սիլիցիումի քառավալենտ քլորիդ, անագ, տիտան։ Ֆոսգենի և ծուխ առաջացնող նյութերի խառնուրդները օգտագործվել են առաջին և երկրորդ համաշխարհային պատերազմներում։
Կիրառություը օրգանական սինթեզում
Օգտագործում են մի շարք ներկանյութեր, պոլիկարբոնատներ, միզանյութ և նրա ածանցյալները, իզոցիանատներ, անջուր մետաաղների քլորիդներ, պեստիցիդներ ստանալու համար[5]։
Ծանոթագրություններ
Wikiwand - on
Seamless Wikipedia browsing. On steroids.




![{\displaystyle {\xrightarrow {NaOH}}Na[OC_{6}H_{4}C(CH_{3})_{2}C_{6}H_{4}OCO]_{n}+(2n-1)NaCl}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3e55e431e84ee7e9d533733e513416b4c1351214)
![{\displaystyle COCl_{2}+C_{6}H_{5}N(CH_{3})_{2}\rightarrow CO[C_{6}H_{5}N(CH_{3})_{2}]_{2}+Cl_{2}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f724a86d3b71ccb4127982ac9fe13bb83f703113)

