Nátrium-oxid
szervetlen vegyület From Wikipedia, the free encyclopedia
A nátrium-oxid szervetlen vegyület, képlete Na2O. Kerámiákban és üvegekben használják fel. Vízzel reagálva nátrium-hidroxid keletkezik belőle:
- Na2O + H2O → 2 NaOH
| Nátrium-oxid | |||
 nátrium-oxid | |||
 nátrium-oxid | |||
| |||
| IUPAC-név | nátrium-oxid | ||
| Más nevek | dinátrium-oxid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 1313-59-3 | ||
| PubChem | 73971 | ||
| ChemSpider | 66599 | ||
| EINECS-szám | 215-208-9 | ||
| InChIKey | KKCBUQHMOMHUOY-UHFFFAOYSA-N | ||
| UNII | 3075U8R23D | ||
| UN-szám | 1825 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | Na2O | ||
| Moláris tömeg | 61,9789 g/mol (0,061 9789 kg/mol) | ||
| Megjelenés | fehér színű szilárd anyag | ||
| Sűrűség | 2270 kg/m³ (2,27 g/cm³) | ||
| Olvadáspont | 1132°C | ||
| Forráspont | 1950 °C bomlik | ||
| Oldhatóság (vízben) | hevesen reagál, NaOH keletkezik | ||
| Kristályszerkezet | |||
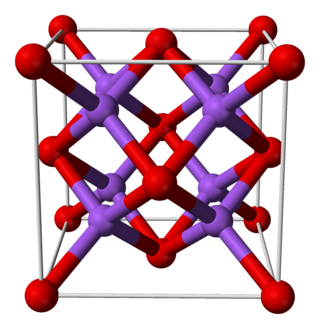
| Kristályszerkezet | antifluorit (lapon centrált köbös), cF12 | ||
| Tércsoport | Fm3m, No. 225 | ||
| Koordinációs geometria | tetraéderes (Na+); köbös (O2−) | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH | −414,2 kJ/mol | ||
| Standard moláris entrópia S | 75,1 J mol−1 K−1 | ||
| Veszélyek | |||
| MSDS | ICSC 1653 | ||
| EU osztályozás | Maró (C)[1] | ||
| EU Index | nincs listázva | ||
| Főbb veszélyek | Korrozív, vízzel hevesen reagál | ||
| R mondatok | R14, R34[1] | ||
| S mondatok | S8, S26, S30, S36/37/39, S45[1] | ||
| Lobbanáspont | Nem gyúlékony | ||
| Rokon vegyületek | |||
| Azonos kation | nátrium-szulfid nátrium-szelenid nátrium-tellurid | ||
| Azonos anion | lítium-oxid kálium-oxid rubídium-oxid cézium-oxid | ||
| Rokon nátrium-oxidok | nátrium-peroxid nátrium-szuperoxid | ||
| Rokon vegyületek | nátrium-hidroxid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az M2O alkálifém-oxidok (M = Li, Na, K, Rb) antifluorit rácsban kristályosodnak, melyben az anionok és kationok helye a CaF2 rácsban találhatóhoz képest fel van cserélve, a nátriumionokat tetraéderesen 4 oxid anion veszi körül, míg az oxidionokhoz kocka alakban 8 nátriumion koordinálódik.[2][3]
Felhasználása
Üveggyártás
A nátrium-oxid – bár nem Na2O formában teszik beléjük, és nem is különálló nátrium-oxid komponensként van bennük jelen – az üvegek fontos komponense, jellemzően mintegy 15% mennyiségben. További összetevő a szilícium-dioxid (kb. 70%) és kalcium-oxid (kb. 9%). A szóda folyósítószer, a szilícium-dioxid olvadáspontját csökkenti. A közönséges üveg (nátronüveg) olvadáspontja alacsonyabb, mechanikai tulajdonságai pedig – valamivel jobb elaszticitása következtében – kedvezőbbek a szilícium-dioxidénál. Ezeket a változásokat a szilícium-dioxid és nátrium-karbonátból keletkező – Na2[SiO2]x[SiO3] általános képletű – nátrium-szilikátok keletkezése okozza.
Előállítása
Nátrium-hidroxid, nátrium-peroxid vagy nátrium-nitrit fémnátriummal végzett reakciójával állítják elő:[4]
- 2 NaOH + 2 Na → 2 Na2O + H2
- Na2O2 + 2 Na → 2 Na2O
- 2 NaNO2 + 6 Na → 4 Na2O + N2
A nátrium levegőn történő égetésekor Na2O és körülbelül 20% nátrium-peroxid (Na2O2) keletkezik.
- 6 Na + 2 O2 → 2 Na2O + Na2O2
Fordítás
Ez a szócikk részben vagy egészben a Sodium oxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
További információk
Wikiwand - on
Seamless Wikipedia browsing. On steroids.