Glükóz
From Wikipedia, the free encyclopedia
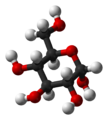
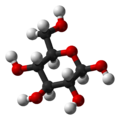
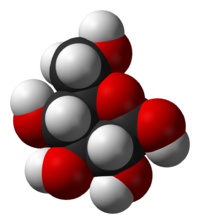
A glükóz – köznapi nevén szőlőcukor – (C6H12O6, rövidítése: Glc) egy monoszacharid, ezen belül 6 szénatomot és aldehidcsoportot tartalmazó aldohexóz. Fontossága a biológiai folyamatokban alapvető: a sejtek energia- és metabolitforrásként hasznosítják. Bioszintézise szén-dioxidból és vízből kiindulva fotonenergia felhasználásával történik a zöld növényekben a fotoszintézis során. Élő szervezetben a glükóznak csak a D enantiomerje fordul elő, melyet dextróznak neveznek. Az L-glükóz biológiailag inaktív, a sejtek nem tudják hasznosítani.
|
|
Ez a szócikk egy középiskolai dolgozat vagy egyetemi jegyzet stílusában íródott. |
| Glükóz | |
 | |
 | |
 | |
| IUPAC-név | 6-(hidroximetil)oxán -2,3,4,5-tetrol VAGY (2R,3R,4S,5R,6R)-6-(hidroximetil) tetrahidro-2H-pirán-2,3,4,5-tetraol |
| Más nevek | szőlőcukor, dextróz |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 50-99-7 (D-glükóz) 921-60-8 (L-glükóz) |
| PubChem | 5793 |
| ChemSpider | 5589 |
| EINECS-szám | 200-075-1 |
| KEGG | C00031 |
| MeSH | Glucose |
| ChEBI | 4167 |
| RTECS szám | LZ6600000 |
| ATC kód | B05CX01, V04CA02, V06DC01 |
| Gyógyszer szabadnév | glucose |
| SMILES | C(C1C(C(C(C(O1)O)O)O)O)O |
| Gmelin | 83256 |
| UNII | 5SL0G7R0OK |
| ChEMBL | 1222250 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | C6H12O6 |
| Moláris tömeg | 180,16 g mol−1 |
| Sűrűség | 1,54 g cm−3 |
| Olvadáspont | α-D-glükóz: 146 °C β-D-glükóz: 150 °C |
| Veszélyek | |
| EU osztályozás | nincsenek veszélyességi szimbólumok[1] |
| R mondatok | (nincs)[1] |
| S mondatok | (nincs)[1] |
| LD50 | 25 800 mg/kg (patkány, szájon át)[1] |
| Rokon vegyületek | |
| Rokon vegyületek | fruktóz mannóz galaktóz |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A szó a görög glykysz (γλυκύς = édes) szóból származik.[2]
A VIII. Magyar Gyógyszerkönyvben négy néven hivatalos:
| Glükóz, vízmentes | Glucosum anhydricum |
| Glükóz-szirup | Glucosum liquidum |
| Glükóz-szirup, porlasztva szárított | Glucosum liquidum dispersione desiccatum |
| Glükóz-monohidrát | Glucosum monohydricum |
Történet
A glükózt mazsolából izolálta 1747-ben a német Andreas Sigismund Marggraf.[3][4] A glükózt szőlőben Johann Tobias Lowitz fedezte fel 1792-ben, és megkülönböztette a szacharóztól. Glükóznak Jean Baptiste Dumas nevezte el 1838-ban, ez a kémiai irodalomban terjedt el. Friedrich August Kekulé a dextróz nevet javasolta a latin dexter, „jobb” szóból, mivel a glükóz vizes oldalban a lineárisan polarizált fény síkja jobbra fordul. Ezzel szemben a l-fruktóz (d-fruktóz) és -glükóz (l-glükóz) a lineárisan polarizált fényt balra forgatja. A korábbi d és l betűket használó nevezéktan a lineárisan polarizált fény síkjának forgatásától függ, melyet később felváltott az optikai rotáción alapuló d- és l előtagot használó, mely a karbonilcsoporttól legtávolabb található királis központ konfigurációjától függ, és a d- és l-glicerinaldehidnek felel meg.[5][6]
Mivel a glükóz sok élőlénynek alapvető szükséglet, kémiai szerkezetének megfelelő ismerete a szerves kémia általános fejlődéséhez hozzájárult. Ez nagyrészt Hermann Emil Fischer vizsgálatainak eredménye, aki felfedezéseiért megkapta az 1902-es kémiai Nobel-díjat.[7]
A glükózszintézis a szerves anyag szerkezetét is meghatározta, és Jacobus Henricus van 't Hoff kémiai kinetikai és kötéselrendeződési elméletét igazolta a szénvegyületekről.[8] 1891 és 1894 közt Fischer leírta az ismert cukrok sztereokémiai elrendeződését, és helyesen jelezte előre a lehetséges izomereket van 't Hoff aszimmetrikusszénatom-elmélete alapján. A nevek kezdetben a természetes anyagokra utaltak. Enantiomerjeik azonos nevet kaptak a szabályos nevezéktanok bevezetésekor az abszolút sztereokémia figyelembevételével (például: Fischer-nevezéktan, d/l-nevezéktan).
A glükózmetabolizmus felfedezéséért Otto Meyerhof 1922-ben elnyerte a fiziológiai vagy orvostudományi Nobel-díjat.[9] Hans von Euler-Chelpin és Arthur Harden 1929-ben a cukor fermentációjáért és a folyamat során lévő enzimmegoszlásért kapták a kémiai Nobel-díjat.[10][11] 1947-ben Bernardo Houssay a hipofízis glükóz- és glükózszármazék-metabolizmusban játszott szerepéért, Carl és Gerty Cori a glikogén és a glükóz átalakulásáért kapták a fiziológiai vagy orvostudományi Nobel-díjat.[12][13][14] 1970-ben Luis Leloir a kémiai Nobel-díjat glükózalapú cukornukleotidok felfedezéséért kapta a szénhidrátok bioszintézisében.[15]
Szerkezet
Nyílt láncú alak

A glükóznak nyílt láncú és gyűrűs alakja is létezik. A nyílt láncú alakjának lánca hatszénatomos, elágazás nélküli lánc. Az 1-es szénatom egy aldehidcsoport (formilcsoport) része, a többi öt szénatomhoz egy-egy hidroxilcsoport kapcsolódik. A nyílt láncú alak 4 aszimmetriás szénatomot tartalmaz.
Gyűrűs alak
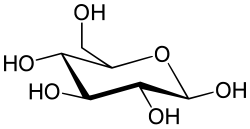
A glükóz gyűrűvé is záródhat. Legstabilabb a szék alakú, hattagú, piranózgyűrűs alakja. A piranózgyűrűs glükóz neve glükopiranóz. Gyűrűvé záródáskor az 5. szénatomon lévő hidroxilcsoport és a formilcsoport között intramolekuláris félacetál kötés jön létre, laktolgyűrű alakul ki. A gyűrűvé záródás következtében az eredetileg a formilcsoportot alkotó szénatom (1-es szénatom) is aszimmetriássá válik. Az ezen a szénatomon a gyűrűvé záródáskor kialakuló ún. glikozidos hidroxilcsoportnak kétféle térállása lehetséges. Éppen ezért a gyűrűs D-glükóznak kétféle anomer módosulata lehetséges: α-D-glükóz és β-D-glükóz (α-D-glükopiranóz és β-D-glükopiranóz) . Az α és a β alak átalakulhat egymásba. Az α-alak optikai forgatóképessége +112°, a β-alak optikai forgatóképessége +18,7°. A D-glükóz vizes oldatában egyensúlyi elegy alakul ki, ez körülbelül 62% β-D-glükózt, 38% α-D-glükózt és kevés nyílt láncú D-glükózt tartalmaz, az oldat forgatóképessége +52,7°. Az α módosulatban a glikozidos hidroxilcsoport a gyűrű tengelyével párhuzamos (axiális) helyzetű, a β módosulatban a tengelyre merőleges (ekvatoriális) helyzetű. A két módosulat közül a β a stabilabb.
A glükóz piranózgyűrűjének a ciklohexánszármazékokhoz hasonlóan kétféle székalkata lehetséges. A szénhidrátkémiában a kétféle székalkatú konformáció jelölése C1 illetve 1C. Az α-D glükóz és a β-D-glükóz esetében a C1 konformáció a stabilabb, mert így a hidroxilcsoportok (α-D-glükóz esetén a glikozidos hidroxilcsoportot kivéve) és a CH2OH csoport a kedvezőbb, ekvatoriális helyzetbe kerülnek. Az α-L-glükóz és a β-L-glükóz esetén azonban az 1C konformáció a kedvezőbb.
α-D-
glükopiranózβ-D-
glükopiranózα-D-
glükopiranózβ-D-
glükopiranóz
Izomerjei
Az aldohexózok nyílt láncú alakja 4 kiralitáscentrumot tartalmaz. Ezek az kiralitáscentrumok nem azonos telítettségűek. Így 24=16-féle aldohexóz lehetséges. Ezek közül 8 a D-sorozathoz, 8 az L-sorozathoz tartozik. Csak néhány található meg közülük az élő szervezetben, ezek többsége a D-módosulat. A legjelentősebbek a D-glükóz, a D-mannóz és a D-galaktóz. Ha az aldohexóz hattagú laktolgyűrűvé (piranózgyűrűvé) záródik, új kiralitáscentrum alakul ki, a glikozidos hidroxilcsoportnak kétféle térállása lehetséges. Tehát 25=32 sztereoizomer lehetséges.
Mutarotáció
A D-glükóznak könnyen előállítható a két anomerje (α-D-glükóz, β-D-glükóz) külön-külön: vizes oldatból az α, piridinből a β módosulat kristályosodik ki. A tiszta α-módosulat optikai forgatóképessége +112°, a tiszta β-módosulaté +18,7°. A glükóz vizes oldatának optikai forgatóképessége +52,7°. Az optikai forgatóképességnek ez a változása a mutarotáció. Ennek az a magyarázata, hogy a glükóz két módosulata könnyen át tud alakulni egymásba, és az átalakulások következtében egy egyensúlyi elegy alakul ki.
Reakciói
Reakció savakkal és lúgokkal
A glükóz savakkal nem reagál. Lúgok hatására izomerizálódik, a D-glükóz D-fruktózzá és D-mannózzá alakul át. A háromféle cukor egyensúlyi keveréket alkot. Erélyesebb lúgos behatás hatására oxiredukciós folyamatok mennek végbe.
Redukció
Ha a glükóz formilcsoportja hidroxilcsoporttá redukálódik, egy nyílt láncú hatértékű alkohol, D-szorbit keletkezik. A D-szorbit cukoralkohol. Édes ízű, szilárd anyag, ami a természetben gyümölcsökben fordul elő. Édesítőszerként használják.
Oxidáció

A glükóz lúgos közegben könnyen oxidálódik. Enyhébb oxidáció hatására (pl. brómos víz, híg HNO3) szelektíven a glükóz aldehidcsoportja oxidálódik karboxilcsoporttá, glükonsav keletkezik. A glükonsav aldonsav. Instabil, könnyen γ-laktonná alakul.
A glükóz redukáló hatású, Fehling-próbát, ezüsttükörpróbát mutatja. Ez a glükóz nyílt láncú alakjában jelenlévő aldehidcsoporttal magyarázható. Fehling- és ezüsttükör-próbakor is a glükóz enyhe oxidációja játszódik le.
A glükóz erélyesebb oxidációjakor (pl. tömény HNO3 hatására) cukorsav keletkezik. Ekkor az aldehidcsoport és a láncvégi hidroxilcsoport oxidálódik karboxilcsoporttá. A cukorsav az aldársavak közé tartozik.
Ha a glükóz aldehidcsoportja védett (pl. glikozidkötés védi), akkor a láncvégi hidroxilcsoport oxidálódik karboxilcsoporttá, glükuronsav keletkezik. A glükuronsav az uronsavak közé tartozik. Laktolgyűrűt képez. A karboxilcsoport a γ helyzetű hidroxilcsoporttal γ-laktongyűrűt is képezhet.
Előfordulás
Szabad állapotban előfordul a természetben egyes gyümölcsökben (pl. a szőlőben, innen a szőlőcukor név). A vérben a koncentrációja éhgyomornál 70–100 mg/100 ml (3,9–5,6 mmol/l) értékek között, szénhidrátgazdag étkezés után 160 mg/100 ml (8,9 mmol/l) alatt számít normális értéknek.[16][17] Diszacharidok (pl. szacharóz, maltóz, cellobióz, laktóz) és poliszacharidok (pl. keményítő, glikogén, cellulóz) alkotórésze. A természetben csak a D-glükóz fordul elő.
Előállítása
A glükóz iparilag keményítő (például kukorica- vagy burgonyakeményítő) savas vagy enzimes hidrolízisével állítható elő. A burgonyakeményítő savas hidrolízisekor keletkező glükózt „krumplicukornak” is nevezik.
A glikolízis folyamata
Glikolízis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Jegyzetek
Források
Kapcsolódó szócikkek
Wikiwand - on
Seamless Wikipedia browsing. On steroids.