izomkontrakcióban részt vevő fehérje From Wikipedia, the free encyclopedia
Az aktin az eukarióta sejtek struktúrfehérjéje, amelynek globuláris molekulái egymáshoz kapcsolódva hosszú szálakat, mikrofilamentumokat képeznek. Szinte valamennyi sejtben megtalálható (az egyetlen ismert kivétel a fonalférgek hímivarsejtje). Molekulatömege kb. 42 kilodalton, átmérője 4-7 nm.
Az aktin a sejtváz egyik alapvető komponense, valamint az izomsejtekben az összehúzódási apparátus egyik részét, a vékony filamentumokat alkotja. Egyaránt jelen lehet szabad monomerként, ez a G-aktin (globuláris); vagy a filamentumok részeként, mint F-aktin (filamentózus). Mindkettő nélkülözhetetlen olyan alapvető sejtfunkcióknál, mint a mozgás, osztódás, vezikulumok és sejtszervecskék mozgatása, a sejt alakjának és külső kapcsolódásainak fenntartása, jelátvitel, vagy az erre specializálódott sejtekben az izomösszehúzódás.[1] Az aktin a génexpresszió ellenőrzésében is fontos szerepet játszik. Gerincesekben az aktinnak három változata (izoformja) ismert: az alfa, a béta és a gamma. Az alfa-aktin az izomösszehúzódást végzi, a béta és a gamma közösen látja el sejtváz funkcióit.
Az aktin biztosította mozgásképesség teszi lehetővé a sejtek számára, hogy gyorsan reagáljon a környezet ingereire, hogy a szomszédos sejtekkel kapcsolódva szöveteket hozzon létre, endocitózissal táplálkozzon vagy kórokozókat semlegesítsen. Szintén a sejtmotilitás eredményezi az embrióban a szervek kialakulását, a sebgyógyulást, másrészt viszont a tumorsejtek gyors terjedési képességét is. Aktinhoz hasonló fehérjék a baktériumokban is megtalálhatóak.[2]
Az aktin vagy a hozzá kapcsolódó fehérjék génjeinek mutációi súlyos örökletes betegségeket okozhatnak, mint az izmok rendellenességei, a szívfejlődés zavarai, vagy eredményezhetnek süketséget is. A citoszkeleton felépítése befolyásolhatja a vírusok és az intracelluláris parazita baktériumok fertőzőképességét is.[3]

Az aktint először a brit W. D. Halliburton figyelte meg 1887-ben izomból készített preparátumban, amit miozin-fermentnek nevezett el, de az anyagot nem elemezte.[4] A tényleges felfedezésre Szent-Györgyi Albert szegedi laboratóriumában került sor. Szent-Györgyi 1939-ben kezdett az izomműködés biokémiai mechanizmusát célzó kísérleteibe, amikor még csak a miozin volt ismert. Munkatársa, Banga Ilona a miozin preparálása közben véletlenül egy óra helyett egész éjszaka inkubálódni hagyta az izmot a sóoldatban és a szokásos híg folyadék helyett sűrű szirupot kapott. Ennek analízisét Szent-Györgyi tanítványa, Straub F. Brunó végezte el. Az anyaggal „aktivált” miozin megfigyelhető összehúzódásokat végzett, így azt aktinnak nevezték el. Megfigyelték, hogy az aktomiozin komplex mozgásához adenozin-trifoszfátra (ATP) is szükség van. A második világháború miatt eredményeiket nem tudták nemzetközi folyóiratokban publikálni, így a felfedezés közzétételére csak 1945-ben került sor az Acta Physiologica Scandinavica-ban.[5] Straub 1950-ben észlelte, hogy az aktin kötött ATP-t tartalmaz,[6] amely a mikrofilamentumokká történő polimerizálódás folyamán ADP-vé és szervetlen foszfáttá hidrolizál. Straub feltételezte, hogy a folyamatnak köze van az izomösszehúzódáshoz, bár elméletét csak 2001-ben sikerült kísérletileg alátámasztani, és csak a simaizom esetében.[6][7]
Az aktin aminosavsorrendjét M. Elzinga határozta meg 1973-ban,[8] a G-aktin háromdimenziós szerkezetére pedig 1990-ben derült fény.[9]
Az aktin aminosavsorrendje a legkevésbé változékonyak közé tartozik az élővilágban, az algák és az ember aktinja között csak 20% a különbség.[10] Strukturális szerepe mellett enzimként is működik, lassan ATP-t hidrolizál, bár a kötött ATP-re szerkezetének fenntartásához is szüksége van. Ezenkívül több protein-protein kölcsönhatást képes létrehozni, mint bármely más fehérje, így látva el sokrétű funkcióit.[2] Az aktinhoz kötődő fehérjék példája az izomműködésben szerepet játszó miozin, vagy a filamentumokat nyalábokba szervező villin.[11]
Az aktin az egyik leggyakoribb protein az eukarióta sejtekben, az izomsejtek teljes fehérjetömegének 20%-át teszi ki, más sejtek esetében pedig 1-5%-ot.[11] A fehérje nem egységes, az őt kódoló gének családot alkotnak, amely a pszeudogénekkel együtt az embernél több mint 30, a növényeknél pedig több mint 60 tagból áll.[2][12] Az aktinnak így némileg eltérő izoformái vannak, amelyek más funkciót látnak el: az α-aktin az összehúzódó struktúrák része, a β-aktin a mozgáshoz és endocizótishoz állábakat növesztő sejtekben található, a γ-aktin pedig a sejtek ún. stressz-szálait építi fel.[13]
A sejtekben az aktin két formában található meg: a globuláris alakú monomer a G-aktin, a filamentumokba rendeződő pedig az F-aktin (vagyis a szálak sok G-aktin monomerből épülnek fel). A citoszkeleton mikrofilamentumait két párhuzamos F-aktinszál alkotja, amelyek kettős hélixként egymás köré csavarodnak. Minden aktinmolekula megköt egy ATP- vagy ADP-molekulát is, amelyhez egy további magnéziumion kapcsolódik.
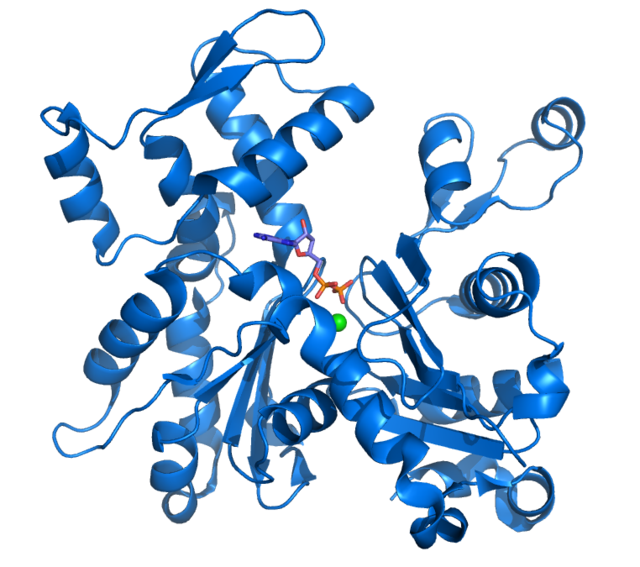
Pásztázó elektronmikroszkópos felvételeken a G-aktin globulárisnak (gömbszerűnek) látszik, röntgendiffrakciós analízissel azonban kiderül, hogy középen egy hasadék választja ketté. A hasadékban található az ATP-hasító enzimhatás aktív központja (ez a szerkezet más ATP-bontó enzimekben is előfordul, mint pl. a hexokinázban vagy a fehérjék megfelelő összehajtogatódását biztosító Hsp70-ben).[14] A funkcionális G-aktinnak vagy ATP-t vagy ADP-t kell megkötve tartania a hasadékában, bár az ATP-s változat a szabad aktinmonomerek esetében jóval gyakoribb.

A szerkezeti vizsgálatokhoz általában a nyúl harántcsíkolt izmából izolált G-aktint használnak, amelyet a röntgendiffrakcióhoz kristályosítanak is. Ennek méretei 67 x 40 x 37 Å, molekulatömege 41 785 dalton. Becsült izoelektromos pontja 4,8. Nettó elektromos töltése pH 7-nél -7.[8][15]
Ennek az aktinváltozatnak már 1973-ban meghatározták az aminosavsorrendjét. Összesen 374 aminosavból áll. N-terminusa savas jellegű és egy, az aminocsoportján acetilált aszparaginsavval kezdődik. A C-terminus viszont inkább bázikus, a lánc utolsó tagja egy fenilalanin, közvetlenül egy cisztein előtt. A peptidlánc két vége a 3D-s szerkezetben viszonylag közel található egymáshoz.[15]
Az aktin háromdimenziós szerkezete két (a nagy és a kis) doménből és a kettő közötti hasadékból áll. A molekulamodellt általában úgy állítják be, hogy a nagy domén essen balra. A molekula mindkét felét további két-két szubdoménre osztják. A kis doménen belül elkülöníthető az I. (jobbra alul, ide tartoznak az 1-32, 70-144 és 338-374 aminosavak) és II. szubdomén (jobbra fent, 33-69 aminosav). A nagyobbik félben található a III. (balra lent, 145-180 és 270-337 aminosavak) és IV. szubdomén (balra fent, 181-269 aminosavak). Az I. és III. szubdomén kilógó végei alkotják a molekula ún. „szöges”, a II. és IV. pedig a „hegyes” végét.
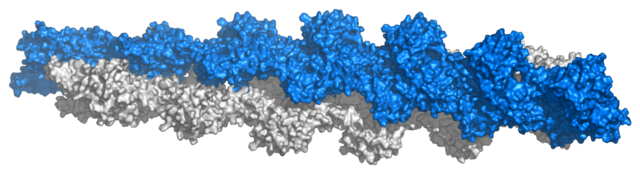
A sejten belüli körülmények között a G-aktin ATP hatására polimerizálódik F-aktinná.[16] A klasszikus értelmezés szerint az aktinfilamentum szerkezetét egyaránt fel lehet fogni egyszálú, 166°-kal balra csavarodó és 27,5 Å menetemelkedésű hélixnek, vagy szintén egyszálú, de jobbra csavarodó csavarvonalnak, ahol minden aktinmonomert négy másik vesz körbe.[17] A filamentum poláris szerkezetű, a monomerek egy irányban helyezkednek el benne. Transzmissziós elektronmikroszkópban (megfelelően preperálva) a monomerek nyílhegyekre emlékeztetnek, amelyek egyik vége a „hegyes” (vagy „-”), a másik a „szöges” („+”).[18] Az izom aktinfilentumai tropomiozint is tartalmaznak, amelynek 40 nm-es, hosszú molekulái körbetekerednek az aktinhélixen. Pihenő állapotban a tropomiozin elfedi az aktin és a miozin kapcsolódási helyeit, így gátolja az izomösszehúzódást. A tropomiozinhoz további troponinok tapadnak.[19]

A G-aktin polimerizációjának megindításához (nukleációjához) stimuláló faktorokra van szükség. Az egyik ilyen a citoplazmában található Arp2/3 komplex, amely aktindimert utánozva indítja be a további molekulák kötődését. Meglévő szálakhoz kapcsolódva a komplex képes elindítani elágazások létrejöttét.[20] A filamentum hosszirányú növekedését a timozin és profilin fehérjék szabályozzák. A timozin β4 a G-aktinhoz kapcsolódva akadályozza a fölösleges polimerizálódást, míg a profilin a G-aktin kötött ADP-jét ATP-re cseréli, elősegítve az újabb monomerek csatlakozását.
In vitro körülmények között a polimerizálódás több lépésből áll. Az ún. aktivációs fázisban a G-aktin két vegyértékű kationokat (Mg2+ vagy Ca2+), amely megváltoztatja a fehérje konformációját és hasonlóvá válik az F-aktinéhoz. A nukleációs fázisban az aktivált monomerekből kis, instabil dimerek vagy trimerek alakulnak. Amikor ezekből elegendően sok áll rendelkezésre, megkezdődik az elongációs fázis, a szál mindkét végéhez újabb monomerek tapadnak, de előfordul leválás is. A filamentum növekedése a „szöges” végen jóval gyorsabb, ezért azt + végként is jelzik. A monomerek kapcsolata nem kovalens.[21] Végül egyensúlyi állapot alakul ki, amikor a leválás kiegyensúlyozza az újabb monomerek kapcsolódását és a szál hossza lényegesen nem változik.[11]
Az aktinhoz kapcsolódott ATP valamivel a polimerizáció után hasad el (vagyis a kötés létrejöttéhez nem szükséges) és a keletkező szervetlen foszfátion egy darabig még a fehérjéhez tapadva marad.

A már említett profilinen és timozinen kívül más fehérjék is szabályozzák at aktinfilamentumok növekedését vagy lebontását. Ilyen pl. a gelszolin és a kofilin, amelyek a szálakat elvágva és a + végeket eltakarva a depolimerizáció felé irányítják a kötések létrejöttének/felbomlásának egyensúlyát.[22] Mások, mint a CapZ vagy a tropomodulin a végekhez kötődve (és a szálat nem eltörve) stabilizálja annak hosszát.[23][24]
Egyes toxinok is az aktinon keresztül fejtik ki a hatásukat. A szivacsok termelte latrunkulin és a gombaalkaloid citokalazin-D gátolja a polimerizációt, míg a gyilkos galóca falloidinje éppen ellenkezőleg, a filamentumok lebontását akadályozza meg.[25][26]
Az aktin számos más fehérjéhez kapcsolódik, ezért szerkezete konzervatív, az evolúció során keveset változott. Génjének bázissorrendje az ember és az élesztőgomba esetében 80,2%-ban azonos, a fehérje aminosavszekvenciája pedig 95%-os hasonlóságot mutat.[2] Az élesztőnek még csak egy aktingénje van, a fejlettebb eukariótákban azonban már a fehérje számos izoformája és az ezeket kódoló géncsaládjai ismertek.[27] Izoelektromos pontjaik alapján az izoformákat három csoportba sorolják. Közülük az alfa változat alapvetően az izmokban, a béta és a gamma az egyéb szövetekben fordul elő. Aminosavsorrendjük nagyon hasonló, de a sejtekben nem képesek helyettesíteni egymást.[28]
A tipikus aktingén egy kb. 100 bázispárnyi 5'-végi át nem íródó szakaszt, egy 1200 bp-s átíródó részt és egy 200 bp-s 3'-végi át nem íródó szakaszt tartalmaz. Legtöbbjüket intronok szakítanak meg, akár hat intron is egy génen belül.
A nem gömb alakú baktériumok aktinhoz hasonló génekkel (pl. MreB) rendelkeznek, amelyek terméke segít a sejt alakjának fenntartásában. A ParM gén plazmidokon található, és az általa kódolt protein szálakká polimerizálódva a sejtosztódáskor húzza szét a plazmid-DNS-t a leánysejtekbe; ennek mechanizmusa az eukarióta sejt mitózisában szerepet játszó mikrotubulusokéra emlékeztet.[29]
Az aktinfilamentumok a sejt citoszkeletonjának alapvető összetevői, amelyek egyrészt állványzatul szolgálnak, másrészt gyors polimerizációs/depolimerizációs ciklusukkal több létfontosságú funkciót látnak el.[30]

A sejtek mozgását a mikrofilamentumok teszik lehetővé, beleértve ebbe az izomszöveten kívüli sejteket is. Az F-aktin szerveződését akadályozó szerek (mint pl. a citokalazinok) gátolják a sejtek mobilitását is. Az aktin a hepatociták teljes fehérjetartalmának 2%-át, a fibroblasztok 10%-át és a vérlemezkék 50-80%-át teszi ki.[32] Az aktinnak több változata van, amelyek szerkezete és feladata kissé eltér; az α-aktin kizáróag az izmokban, a β és a γ egyéb sejtekben található meg. Utóbbiak többsége az állandó struktúrákon kívül található, a többi pedig jellemzően kétféle szerkezetben foglal helyet:

Különleges struktúrák az idegsejtek axonjaiban (a dendritekben nem) található, egymástól egyenlő távolságra elhelyezkedő aktingyűrűk, amelyek (az összekötő spektrinnel együtt) a hosszú, vékony axonok vázát adják és talán a nátriumioncsatornák szabályozásában is szerepet kapnak.[33]
Aktin a sejtmagban is található, ahol feladata elsősorban strukturális, fenntartja a sejtmag alakját,[34][35] szerepe van a kromatin szerveződésében,[31][36] sőt egyes gének kifejeződésére is hatással lehet, kötődik azok szabályozó régiójához.[37][38]
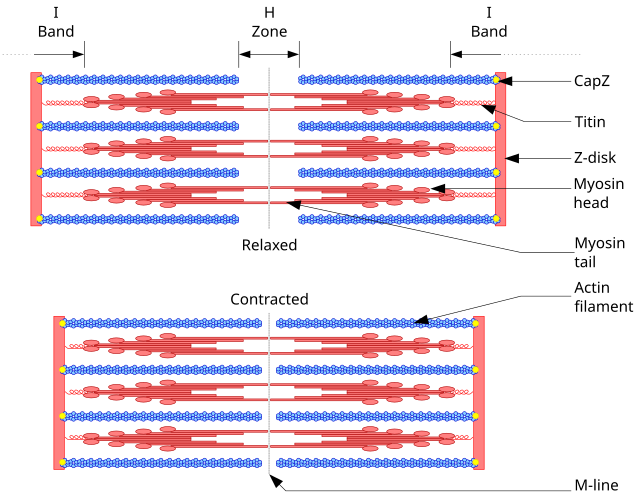
Az izomsejtek citoplazmáját jórészt miofibrillumok teszik ki. A miofibrillumok egymásba ágyazódó, aktinból álló vékony filamentumokból (átmérője 7 nm) és miozin-alkotta vastag filamentumokból (15 nm) tevődnek össze.[39] ATP felhasználásával a miozinmolekula fejrésze az aktinhoz kapcsolódik (aminek kötőrészét pihenő állapotban a tropomiozin fedi el), annak "+" vége felé mozdul el, aminek hatására a vastag és vékony filamentumok elcsúsznak egymás mellett (ún. csúszó filamentum-modell); az izom megrövidül. Az egész folyamatot általában egy külső szignál, az izomhoz kapcsolódó ideg akciós potenciálja indítja el, amelynek hatására megnő a Ca2+-ionok belső koncentrációja. A kalcium hatására a troponin szabályozóprotein konformációja megváltozik, hat a tropomiozinra, amely felszabadítja a miozin kötőhelyét az aktinszálon.[19]
Az emlősök többségének hat aktingénje van: az ACTB és az ACTG1 a citoszkeleton, az ACTA1 a harántcsíkolt izom, az ACTA2 a simaizom, az ACTG2 a bél izmai, az ACTC1 pedig a szívizom aktinját kódolja. Mutációik nagy többsége dominánsan öröklődik, mert általában megakadályozzák a G-aktin F-aktinná való polimerizálódását.
Az ACTA1 terméke a simaizmok aktinja, bár kifejeződik a szívizomban és a pajzsmirigyben is.[48] Mutációi megváltoztathatják az izom szerkezetét és izombetegséget, miopátiát okozhatnak. Ilyen a fonalas miopátia (ahol az izomszövetben vékony pálcikák vagy fonalak jelennek meg), vagy a vékony filamentumok túltengésével járó örökletes miopátia. A betegséget általában az arc jellegzetes formája jelzi és izomgyengeséggel, a motoros képességek visszamaradottságával, légzési nehézséggel jár.
A bél simaizmaiban aktív ACTG2-nek nem ismertek olyan mutációi, amelyek patológiás állapotot eredményeznének. Az egyéb simaizmokban (pl. a vérerekben) kifejeződő ACTA2 MYH11 mutációja vizsgálatok szerint az örökletes aorta-aneurizmák mintegy 14%-ért felelős. A mutáns aktinmolekulák illeszkedése kevésbé pontos, és az izomösszehúzódás erőssége limitált.[49] Lehetséges, hogy a gén mutációi okozzák az agy ereinek abnormális működésével járó Moyamoya-kórt és hajlamossá teszik hordozóikat más érbetegségekre (pl. koszorúér-betegség) is.[50]

A szívizomban kifejeződő ACTC1 génnek több, betegséget okozó mutációja ismert. Ezek felelősek az 1R típusú kitágulásos (dilatatív) kardiomiopátiáért, vagy a 11. típusú hipertrófiás kardiomiopátiáért (utóbbinál az esetek kb. 5%-a vezethető vissza erre). Az aktin mutációira vezethetők vissza a szívpitvar bizonyos rendellenességei is.[51][52]
A citoplazma aktinját adó ACTB bonyolult gén, és több, nem működő pszeudogénje is ismert. Hat exonja alternatív splicinggel a β-aktin legalább 21 különböző variációját képes produkálni. Ennek megfelelően többféle feladatot lát el (a citoszkeletonban, a hiszton-aciltranszferáz komplexben, a sejtmagban) és meghibásodása esetén is változatosak a kórképek, mert szerepet játszhat többek között karcinómákban, fertőzésekben, az idegrendszer fejlődési rendellenességeiben vagy a tumorsejtek terjedésében.[53] Mutációiról kimutatták, hogy hemangioperiktómát (a hajszálerek falának szarkómáját),[54] fiatalkori disztóniát (az idegrendszer degeneratív megbetegedését),[55] vagy az immunrendszer neutrofil granulocitáinak diszfunkcióját és ennek következtében makacs és visszatérő fertőzéseket okozhatnak.[56]
A γ-aktint kódoló ACTG1 gén szintén hat exont tartalmaz, amelyekről 22 különféle mRNS íródhat át. Hat domináns öröklődésű pontmutációja ismert, amelyek a fülben található sztereocíliumok szerkezetének megváltoztatásával különböző mértékű halláskárosodást eredményeznek. A γ-aktin kis mennyiségben a vázizomban is kifejeződik és hiánya kísérleti állatokban szintén miopátiához vezet (emberben hasonló kórképet még nem írtak le).[57]
Egyes baktériumok, mint a sejten belül szaporodó Listeria monocytogenes, egyes rickettsiák vagy a Shigella flexneri a belső védelmi mechanizmust úgy kerülik el, hogy aktinfilamentunokba csomagolják magukat. A Listeria és a Shigella a kapszuláján ún. „üstökösfarkat” képez, amellyel mozogni is képesek.[58] A Pseudomonas aeruginosa biofilmet képez, ahol elrejtőzhet a fehérvérsejtek vagy akár a gyógyszerek elől. A biofilmet a gazdaszervezet DNS-éből és aktinfilamentumaiből hozza létre.[59]
Az eukariótákon belül az aktin és a citoszkeletont felépítő másik fehérje, a tubulin nagy hasonlóságot mutat. Az ACTG2 (γ-aktin) gén terméke például teljesen megegyezik az emberben és az egérben, bár magának a génnek a szekvenciája csak 92%-ban azonos.
A baktériumok citoszkeletonja nem olyan komplex, mint az eukariótáké, de az aktinhoz nagyon hasonló szerkezetű fehérjékkel rendelkeznek. Az MreB például az aktinfilamentumokhoz hasonló, de többnyire nem helikális szálakká áll össze.[60] Háromdimenziós szerkezete is igen hasonló. A bakteriális FtsZ protein pedig a tubulinra emlékeztet.[61] A ParM aktinszerű fehérjét plazmid kódolja és a plazmd-DNS szabályozásához van rá szükség.[2][62]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.