Xene supresor de tumores
From Wikipedia, the free encyclopedia
Remove ads
Un xene supresor de tumores ou antioncoxene, é un xene que regula a célula durante a división celular.[1] Se a célula crecese incontrolablemente, orixinaría un cancro. Cando un xene supresor de tumores muta, isto causa unha perda ou redución da súa función. En combinación con outras mutacións xenéticas, isto podería permitir que a célula se replicase anormalmente. A perda de función destes xenes pode ser incluso máis significativa para o desenvolvemento de cancros humanos que a activación de oncoxenes.[2]
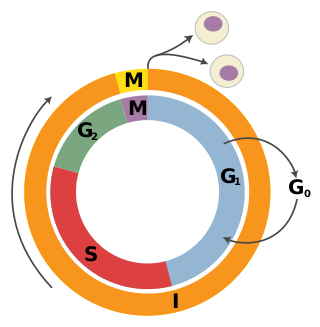
Os xenes supresores de tumores poden agruparse nas seguintes categorías: xenes conserxes (caretaker), xenes porteiros (gatekeeper) e, máis recentemente, xenes paisaxistas (landscaper). Os xenes conserxes aseguran a estabilidade do xenoma por medio da reparación do ADN e, en consecuencia, ao mutaren permiten a acumulación de mutacións.[3] Por outra parte, os xenes porteiros regulan directamente a proliferación celular ao inhibiren a progresión do ciclo celular ou inducir a apoptose.[3] Finalmente, os xenes paisaxistas regulan a proliferación ao contribuíren ao ambiente que rodea a célula, e cando mutan poden causar un ambiente que promove unha proliferación non regulada.[4] Os esquemas de clasificación están evolucionando a medida que se fan avances médicos en campos como a bioloxía molecular, xenética e epixenética.
Remove ads
Historia
O descubrimento dos oncoxenes e a súa capacidade de desregular procesos celulares relacionados coa proliferación celular e o desenvolvemento apareceu primeiro na literatura como algo oposto á idea dos xenes supresores de tumores.[5] Porén, a idea de que unha mutación xenética orixinase un incremento do crecemento tumoral deu paso a outra posible explicación xenética, a de que hai xenes que exercen un papel na diminución do crecemento celular e do desenvolvemento das células. Esta idea non se solidificou ata que se realizaron os experimentos de Henry Harris sobre hibridación de células somáticas en 1969.[6]
Nos experimentos de Harris fusionábanse células tumorais con células somáticas normais para obter células híbridas. As células obtidas tiñan cromosomas de ambas as células parentais e ao proliferaren, unha maioría destas células híbridas non tiña a capacidade de orixinar tumores en animais.[6] A supresión da tumorixenicidade nestas células híbridas levou a que se formulase a hipótese de que os xenes nunha célula somática normal realizaban accións inhibitorias para parar o crecemento dos tumores.[6] Esta hipótese inicial levou finalmente ao descubrimento do primeiro xene supresor de tumores clásico por Alfred Knudson, coñecido como xene Rb, que codifica a proteína supresora do tumor retinoblastoma.[5]
Alfred Knudson, un pediatra e xenético do canco, propuxo que para que se desenvolvese o retinoblastoma, eran necesarias dúas mutacións alélicas para perder as copias funcionais dos dous xenes Rb, o que causaba a tumorixenicidade.[6] Knudson observou que a miúdo o retinoblastoma se desenvolvía en ambos ollos en pacientes novos nos primeiros anos de vida, mentres que nalgúns raros casos o retinoblastoma se desenvolvía máis tarde na vida e só era unilateral.[5] Este padrón de desenvolvemento único serviulle a Knudson e outros grupos científicos en 1971 a hipotetizar correctamente que o desenvolvemento temperán do retinoblastoma era causado pola herdanza xenética dunha mutación de perda de función nun xene RB de liña xerminal seguido dunha mutación de novo posterior no seu alelo funcional Rb. A aparición máis esporádica do desenvolvemento unilateral de retinoblastoma hipotetizouse que se desenvolvía moito máis tarde na vida debido a dúas mutacións de novo que eran necesarias para a perda completa das propiedades supresoras de tumores.[5] Este descubrimento constituíu a base da hipótese dos dous impactos. Para verificar que a perda de función dos xenes supresores de tumores causa un incremento de tumorixenicidade, realizáronse experimentos de deleción intersticial no cromosoma 13q14 para observar o efecto de eliminar os loci do xene Rb. Esta deleción causou un incremento do crecemento tumoral no retinoblastoma, o que suxería que a perda ou inactivación dun xene supresor de tumores pode incrementar a tumorixenicidade.[6]
Remove ads
Hipótese dos dous impactos
A diferenza dos oncoxenes, os xenes supresores de tumores xeralmente seguen a hipótese dos dous impactos (two-hit hypothesis), que afirma que deben estar afectados os dous alelos que codifican unha determinada proteína para que se manifeste un efecto.[7] Se só un dos alelos do xene está danado, o outro aínda pode producir suficiente cantidade da proteína correcta para manter apropiadamente a función. Noutras palabras, os alelos supresores de tumores mutantes son xeralmente recesivos, mentres que os alelos de oncoxenes mutantes son tipicamente dominantes.


A hipótese propúxoa A.G. Knudson para casos de retinoblastoma.[7] Observou que o 40% dos casos en EUA desta doenza eran causados por unha mutación na liña xerminal. Porén, os proxenitores afectados podían ter fillos sen a doenza, pero os fillos non afectados tiñan de adultos fillos con retinoblastoma.[8] Isto indica que se pode herdar unha liña xerminal mutada pero non desenvolver a doenza. Knudson observou que a idade do comezo do retinoblastoma seguía unha cinética de segunda orde, o que implicaba que cumprían dous eventos xenéticos independentes para a manifestación do retinoblastoma. Recoñeceu que isto era consistente coa presenza dunha mutación recesiva que afectaba a un só xene, pero que se necesitaba unha mutación bialélica para a aparición do tumor. Os casos hereditarios implican unha mutación herdada e ademais unha soa mutación adicional no alelo normal.[8] O retinoblastoma non hereditario necesitaba dúas mutacións, unha en cada alelo.[8] Knudson tamén sinalou que os casos hereditarios adoitaban desenvolver tumores bilaterais e aparecían nunha etapa temperán da vida, comparados cos non hereditarios, nos que os individuos só eran afectados por un tumor nun dos ollos.[8]
Hai excepcións á regra dos dous impactos para os supresores de tumores, como certas mutacións no produto xénico p53. As mutacións en p53 poden funcionar como dominantes negativas, o que significa que unha proteína p53 mutada pode impedir o funcionamento da proteína natural producida polo alelo non mutado.[9] Outros xenes supresores de tumores que non seguen a regra dos dous impactos son os que presentan haploinsuficiencia, como PTCH no meduloblastoma e NF1 no neurofibroma. Outro exemplo é p27, un inhibidor do ciclo celular, que cando ten mutado un dos alelos causa un incremento da susceptibilidade a carcinóxenos.[10]
Remove ads
Funcións
As proteínas codificadas pola maioría dos xenes supresores de tumores inhiben a proliferación ou supervivencia celular. Por tanto, a inactivación de xenes supresores de tumores orixina o desenvolvemento de tumores ao eliminar as proteínas reguladoras negativas. Na maior pate dos casos, as proteínas supresoras de tumores inhiben as mesmas vías regulatorias celulares que son estimuladas polos produtos dos oncoxenes.[11] Aínda que os xenes supresores de tumores teñen a mesma función principal, teñen varios mecanismos de acción, que realizan os seus produtos transcritos, entre os que están os seguintes:[12]
- Proteínas intracelulares, que controlan a expresión xénica dunha etapa específica do ciclo celular. Se estes xenes non se expresan, o ciclo celular non continúa, o que inhibe a división celular (por exemplo, pRB e p16).[13]
- Receptores ou transdutores de sinais de hormonas segregadas ou sinais de desenvolvemento que inhiben a proliferación celular (por exemplo, o factor de crecemento transformante (TGF)-β e a APC).[14]
- Proteínas de control dos puntos de comprobación que desencadean a parada do ciclo celular en resposta a danos no ADN ou defectos cromosómicos (por exemplo, BRCA1, p16 e p14).[15]
- Proteínas que inducen a apoptose. Se non pode repararse o dano, a célula inicia a morte celular programada para eliminar a ameaza que supón para todo o organismo (por exemplo, p53).[16]
- Adhesión celular. Algunhas proteínas implicadas na adhesión celular impiden que as células tumorais se dispersen, bloqueando a perda de inhibición por contacto e inhibindo a metástase. Estas proteínas denomínanse supresoras da metástase (por exemplo, CADM1)[17][18]
- Proteínas implicadas na reparación de erros no ADN. Os xenes conserxes codifican proteínas que funcionan na reparación de mutacións no xenoma, impedindo que as células se repliquen levando esas mutacións. Ademais, o incremento da taxa de mutacións pola diminución da reparación do ADN leva a un incremento da activación doutros supresores de tumores e á activación de oncoxenes[19] (por exemplo, p53 e MSH2).[20]
- Certos xenes poden tamén actuar como supresores de tumores e oncoxenes. Os denominados protooncoxenes con función de supresión de tumores actúan como “axentes dobres” que regulan tanto positivamente coma negativamente a transcrición (por exemplo, os receptores NOTCH, TP53 e FAS).[21]
Remove ads
Influencias epixenéticas
A expresión dos xenes, incluíndo os supresores de tumores, pode modificarse por alteracións bioquímicas, como a metilación do ADN.[22] A metilación é un exemplo de modificación epixenética, que comunmente regula a expresión de xenes de mamíferos. A adición dun grupo metilo á cola dunha histona ou directamente no ADN causa que os nucleosomas se empaqueten apertadamente restrinxindo a transcrición de todos os xenes da rexión afectada. Este proceso non só ten a capacidade de inhibir a expresión xénica, senón que tamén pode incrementar a probabilidade de mutacións. Stephen Baylin observou que se rexións promotoras experimentan hipermetilación, isto pode resultar en posteriores erros na transcrición, silenciamento do xene supresor de tumores, pregamento incorrecto de proteínas e finalmente o crecemento dun cancro. Baylin et al. atoparon inhibidores da metilación chamados azacitidina e decitabina. Estes compostos poden axudar a previr o cancro ao induciren a reexpresión de xenes previamente silenciados, parar o ciclo celular de células tumorais e forzalas á apoptose.[23]
Están a facerse ensaios clínicos sobre tratamentos para a hipermetilación e terapias alternativas de supresión de tumores, como a prevención da hiperplasia de tecidos, desenvolvemento de tumores ou espallamento metastático.[24] Investigouse tamén a metilación de tecidos neoplásticos para no futuro poder identificar opcións de tratamento temperás para a modificación de xenes que poden silenciar un xene supresor de tumores.[25] Ademais da metilación do ADN, outras modificacións epixenéticas como a desacetilación de histonas ou proteínas que se unen á cromatina poden evitar que a ADN polimerase transcriba as secuencias desexadas, como as que conteñen xenes supresores de tumores.
Remove ads
Importancia clínica
Utilízase a terapia xénica para restablecer a función dun tipo de xene mutado ou eliminado. Cando se alteran xenes supresores de tumores dun xeito que resulta nunha menor ou ningunha expresión, poden orixinarse varios problemas graves para o hóspede. Por iso os xenes supresores de tumores son comunmente estudados e utilizados para a terapia xénica. As dúas estratexias principais usadas actualmente para introducir material en células son os métodos de entrega virais e non virais.[25]
Métodos virais
O método viral de transferir material xenético aproveita o poder dos virus.[25] Usando virus que son resistentes ás alteracións do material xenético, os métodos virais de terapia xénica para xenes supresores de tumores demostraron ser exitosos.[26] Neste método os vectores víricos máis usados son os vectores adenovirais e vectores adeno-asociados. A manipulación xenética in vitro destes tipos de vectores é doada e a súa aplicación in vivo é relativamente segura comparada con outros vectores.[25][27] Antes de inserir os vectores nos tumores do hóspede, son preparados para facer mutar ou eliminar as partes do seu xenoma que controlan a súa replicación, o que os fai máis seguros. Despois, o material xenético desexado insírese e lígase no vector.[26] No caso dun xene supresor de tumores, utilizouse con éxito o material xenético que codifica p53, o cal unha vez aplicado demostrou causar unha redución no crecemento do tumor ou da proliferación celular.[27][28]
Métodos non virais
Os métodos non virais de transferencia de material xenético son utilizados con menos frecuencia que os métodos virais.[25][27] Porén, o método non viral é o método máis caro, máis seguro, e dispoñible para a entrega de xenes, sen mencionar que os métodos non virais inducen menos respostas inmunes do hóspede e non teñen restricións sobre o tamaño ou lonxitude do material xenético transferible.[25] A terapia xénica non viral usa métodos químicos ou físicos para introducir o material xenético nas células desexadas.[25][27] Os métodos químicos utilízanse principalmente para a introdución do xene supresor de tumores e divídense en dúas clases, que son os plásmidos espidos ou os plásmidos cubertos de liposomas.[27] A estratexia do plásmido espido espertou grande interese debido que son fáciles de utilizar.[25] A inxección directa no músculo permite que o plásmido sexa captado pola célula de posibles tumores onde o material xenético do plásmido pode incorporarse no material xenético da célula tumoral e inverter calquera dano previo feito ao xene supresor de tumores.[25][27] O plásmido cuberto de liposomas é interesante tamén porque produce unha resposta inmune do hospede relativamente baixa e é eficiente para chegar ao seu destino celular.[27] As cápsula positivamente cargadas nas cales o material xenético está empaquetado axudan á atracción electrostática ás membranas cargadas negativamente das células, así como o ADN cargado negativamente das células tumorais.[25][27] Deste modo, os métodos non virais de terapia xénica son altamente efectivos á hora de restaurar a función de xenes supresores de tumores en células tumorais que perderon total ou parcialmente a súa función.
Limitacións
As terapias xénicas virais e non virais mencionadas antes utilízanse comunmente, pero ambas teñen algunhas limitacións que deberían ser consideradas. A limitación máis importante destes métodos é a eficacia coa cal os vectores adenovirais e adeno-asociados, plásmidos espidos ou plásmidos cubertos de liposomas son captados polas células tumorais do hóspede. Se non se consegue unha correcta captación polas células tumorias do hóspede, a reinserción introduce problemas como o recoñecemento polo sistema inmunitario do hóspede destes vectores ou plásmidos, destruíndoos, o cal afecta máis a efectividade global do tratamento de terapia xénica.[28]
Remove ads
Exemplos
- Proteína do retinoblastoma (pRb). A pRb foi a primeira proteína supresora de tumores descuberta nos retinoblastomas humanos; porén, as evidencias recentes implican tamén a pRb como factor de supervivencia tumoral. O xene RB1 é un xene porteiro que bloquea a proliferación celular, regula a división celular e a morte celular.[8] Especificamente, a pRb impide a progresión da célula desde a fase G1 á fase S ao unirse a E2F e reprimir a necesaria transcrición xénica.[29] Isto impide que a célula replique o seu ADN se hai danos.
- p53. TP53 é un xene conserxe que codifica a proteína p53, á que se lle chamou "o gardián do xenoma". A p53 ten moitas funcións diferentes na célula, entre elas a reparación do ADN, indución da apoptose, transcrición e regulación do ciclo celular.[30] A p53 mutado está implicada en moitos cancros humanos; das 6,5 millóns de diagnósticos de cancro que se fan cada ano un 37% está conectado con mutacións en p53.[30] Isto fixo que sexa unha diana habitual nas terapias do cancro. A perda homocigota de p53 atópase no 65% dos cancros de colon, o 30–50% dos cancros de mama e o 50% dos cancros de pulmón. A p53 mutada está tamén implicada na fisiopatoloxía de leucemias, linfomas, sarcomas e tumores neuroxénicos. As anormalidades no xene p53 poden ser herdadas na síndrome de Li-Fraumeni, que incementa o risco de desenvolver varios tipos de cancro.
- BCL2. BCL2 é unha familia de proteínas que están implicadas na indución ou inhibición da apoptose.[31] A principal función é o mantemento da composición da membrana das mitocondrias e impedir a liberación do citocromo c no citosol.[31] Cando se libera o citocromo c desde as mitocondrias comeza unha fervenza de sinalización para empezar a apoptose.[32]
- SWI/SNF. SWI/SNF é un complexo de remodelación da cromatina, que está perdido nun 20% dos tumores.[33] O complexo consiste en 10-15 subunidades codificadas por 20 xenes distintos.[33] As mutacións en cada complexo individual poden levar a un mal pregamento, o cal compromete a capacidade do complexo de funcionar xunto como un todo. O SWI/SNF ten a capacidade de mover os nucleosomas, o que condensa o ADN, permitindo a transcrición ou bloqueando a transcrición de certos xenes.[33] A mutación desta capacidade podería causar que os xenes se activen ou desactiven en momentos incorrectos.
A medida que o custo da secuenciación do ADN continúa a diminuír, poden secuenciarse ADNs celulares de máis cancros. Isto permite o descubrimento de novos supresores de tumores e pode proporcionar coñecementos sobre como tratar e curar diferentes cancros no futuro. Outros exemplos de supresores de tumores son pVHL, APC, CD95, ST5, YPEL3, ST7 e ST14, p16, BRCA2.[34]
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
