C-Src
From Wikipedia, the free encyclopedia
A proteína c-Src (c significa celular e Src, sarcoma), tamén chamada protooncoxene tirosina quinase Src ou protooncoxene c-Src é unha tirosina quinase non receptora que nos humanos está codificada no xene SRC do cromosoma 20. Pertence á familia das quinases da familia Src e é similar ao xene da v-Src (Src viral) do virus do sarcoma de Rous. Contén un dominio SH2, un dominio SH3 e un dominio tirosina quinase. Deste xene atopáronse dúas variantes de transcrición que codifican a mesma proteína.[1]
| SRC | |||
|---|---|---|---|
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB
Lista de códigos PDB
| ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Identificadores externos |
Bases de datos de encimas
| ||
| Número EC | 2.7.10.2 | ||
| Locus | Cr. 20 q11.23 | ||
| Padrón de expresión de ARNm | |||
 | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
A c-Src fosforila residuos de tirosina específicos noutras tirosina quinases. Xoga un papel na regulación do desenvolvemento embrionario e crecemento celular. Sinalouse que un nivel elevado de actividade de c-Src está ligado á progresión do cancro ao promover outros sinais.[2] As mutacións en c-Src poderían estar implicadas na progresión maligna do cancro de colon. c-Src non debería confundirse con CSK (quinase Src C-terminal), un encima que fosforila c-Src no seu C-terminal e proporciona regulación negativa da actividade encimática de Src.
A c-Src descubrírona orixinalmente os científicos estadounidenses J. Michael Bishop e Harold E. Varmus, polo cal recibiron o premio Nobel de Medicina de 1989.[3]
Descubrimento
En 1979, J. Michael Bishop e Harold E. Varmus descubriron que os polos normais posuían un xene que está estruturalmente relacionado con v-Src.[4] O xene celular normal recibiu o nome de c-src (src celular).[5] Este descubrimento cambiou o pensamento actual sobre o cancro desde un modelo no que o cancro era causado por unha substancia externa (un xene viral) a outro no que un xene que está normalmente presente na célula pode causar cancro. Crese que nalgún momento no pasado un virus ancestral incorporou por erro o xene c-Src que pertencía ao seu hóspede celular. Finalmente este xene normal mutou nun oncoxene de funcionamento anormal dentro do virus do sarcoma de Rous. Unha vez que o oncoxene se transfire de novo ao polo, pode orixinar cancro.
Estrutura
A familia Src de quinases consta de 9 membros, que son: c-Src, Yes, Fyn, Fgr, Yrk, Lyn, Blk, Hck e Lck.[6] A expresión destes membros da familia Src non é igual en todos os tecidos e tipos celulares. Src, Fyn e Yes exprésanse en todos os tipos celulares, mentres que os outros xeralmente se atopan en células hematopoéticas.[7][8][9][10]
A c-Src consta de 6 rexións funcionais: O dominio de homoloxía Src 4 (dominio SH4), a rexión única, o dominio SH3, o dominio SH2, o dominio catalítico e unha curta cola regulatoria.[11] Cando Src está inactivo, o grupo tirosina fosforilado na posición 527 interacciona co dominio SH2, que axuda a ao dominio SH3 a interaccionar co dominio linker flexible e así axuda a unidade inactiva estreitamente unida. A activación de c-Src causa a desfosforilación da tirosina 527. Isto induce alosterismo de longo rango pola dinámica de dominios proteicos, causando que a estrutura se desestabilice, resultando na apertura dos dominios SH3, SH2 e quinase e a autofosforilación do residuo de tirosina 416.[12][13][14]
A autofosforilación de Y416 así como a fosforilación de substratos de Src selecionados poténciase pola dimerización de c-Src.[15] A dimerización de c-Src é mediada pola interacción da rexión N-terminal miristoilada dun dos membros do dímero e o dominio quinase do outro membro.[15] Tanto o ácido mirístico unido ao N-terminal coma as secuencias peptídicas da rexión única están implicadas na interacción.[15] Dada a versatilidade inherente a esta rexión intrinsecamente desordenada, as fosforilacións multisitio, e a súa diverxencia dentro da familia, o dominio único probablemente funciona como un lugar de sinalización central que supervisa gran parte das actividades encimáticas e das funcións únicas das quinases da familia Src.[15]
A c-Src pode ser activada por moitas proteínas transmembrana como: receptores de adhesión, receptor tirosina quinases, receptores acoplados á proteína G e receptores de citocinas. A maioría dos estudos examinaron as receptor tirosina quinases e exemplos destes son a vía do receptor do factor de crecemento derivado de plaquetas (PDGFR) e o receptor do factor de crecemento epidérmico (EGFR).
A Src contén polo menos tres dominios proteicos flexibles, que, xunto coa miristoilación, poden mediar na adhesión a membranas e determina a localización subcelular.[16]
Función
Este protooncoxene pode exercer un papel na regulación do desenvolvemento embrionario e no crecemento celular.
Cando se activa Src, promove a supervivencia, a anxioxénese, a proliferación e vías de invasión. Tamén regula factores anxioxénicos e a permeabilidade vascular despois da isquemia-reperfusión cerebral focal,[17][18] e regula a actividade da metaloproteínase de matriz 9 despois da hemorraxia cerebral.[19]
Papel no cancro
A activcaión da vía c-Src observouse nun 50% dos tumores de colon, fígado, pulmóns, glándula mamaria e páncreas.[20] Como a activación de c-Src conduce á promoción da supervivencia, anxioxénese, proliferación e vías de invasión, obsérvase o crecemento aberrante de tumores en cancros. Un mecanismo común consiste en que hai mutacións xenéticas que resultan no incremento da actividade ou a sobreexpresión de c-Src que orixina a activación constante de c-Src.
Cancro de colon
A actividade de c-Src foi ben caracterizada no cancro de colon. Atopouse wue a expresión de Src é de 5 a 8 veces maior en pólipos premalignos que na mucosa normal.[21][22][23] Os elevados niveis de c-Src tamén están en correlación con estadios avanzados do tumor, tamaño do tumor e potencial metastático dos tumores.[24][25]
Cancro de mama
O EGFR activa c-Src, mentres qie o EGF tamén incrementa a actividade de c-Src. Ademis, a sobreexpresión de c-Src incrementa a resposta de procesos mediados por EGFR. Así, tanto EGFR coma c-Src amentan mutuamente os seus efectos. Atopáronse niveis de expresión elevados de c-Src nos tecidos de cancro de mama humano comparados cos tecidos normais.[26][27][28]
A sobreexpresión do receptor 2 do factor de crecemento epidérmico humano (HER2), tamén coñecido como erbB2, está correlacionada cunha prognose peor do cancro de mama.[29][30] Así, c-Src desempeña un papel na progresión do tumor nos cancros de mama.
Cancro de próstata
Os membros da familia Src de quinases Lyn, Src e Fgr son ampliamente expresados en células de próstata malignas comparados con células normais de próstata.[31] Cando as células de próstata primarias son tratatdas con KRX-123, o cal é un inhibidor de Lyn, nas células in vitro reduciuse a súa proliferación, migración e potencial invsivo.[32] Así, o uso do inhibidor da tirosina quinase é unha vía posible para reducir a progresión dos cancros de próstata.
Como diana de drogas
Desenvolvéronse para uso terapéutico varios inhibidores de tirosina quinases que teñen como diana a tirosina quinase c-Src (así como outras tirosina quinases relacionadas).[33] Un exemplo notable é dasatinib, que foi aprobado para o tratamento da leucemia mieloide crónica (CML) e leucemia linfocítica aguda cromosoma Filadelfia positiva.[34] Dasatinib está tamén en ensaios clínicos para o seu uso no linfoma non de Hodgkin, cancro de mama metastático e cancro de próstata. Outros fármacos inhibidores de tirosina quinases que están en ensaio clínico son bosutinib,[35] bafetinib, AZD-0530, XLl-999, KX01 e XL228.[2] Describiuse que o inhibidor de HSP90 NVP-BEP800 afecta a estabilidade da tirosina quinase Src e o crecemento de leucemias linfoblásticas agudas de células T e B. [36]
Interaccións
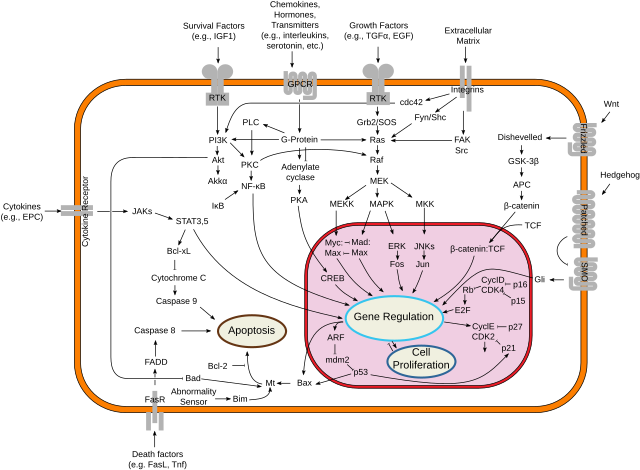
O xene Src interacciona coas seguintes vías:
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.