Hematopoese
From Wikipedia, the free encyclopedia
A hematopoese[1] (do grego αἷμα, "sangue" e ποιεῖν "facer"), tamén chamada hemopoese, hemocitopoese ou hematoxénese (as formas con i como hematopoiese etc. non se recomendan en galego[2][3]) é a formación das células do sangue, é dicir, de eritrocitos, leucocitos e plaquetas. Todos os compoñentes celulares do sangue derivan de células nai hematopoéticas que se encontran na medula ósea, a cal é, por tanto, o lugar onde ten lugar normalmente a hematopoese no adulto. Nunha persoa sa adulta, prodúcense aproximadamente 1011–1012 novas células sanguíneas cada día para manter estables os niveis de células sanguíneas na circulación periférica.[4][5]


[2] O eritrocito á dereita é unha representación máis precisa da súa aparencia real cando se mira a través dun microscopio.
[3] Outras células que derivan do monocito: osteoclastos, microglía (sistema nervioso central), células de Langerhans (epiderme), células de Kupffer (fígado).
[4] Para obter máis claridade, os linfocitos T e B están separados para indicar mellor que as células plasmáticas xorden da célula B. Teña en conta que non hai diferenza na aparencia das células B e T, a menos que se faga unha tinguidura específica.
Células nai hematopoéticas
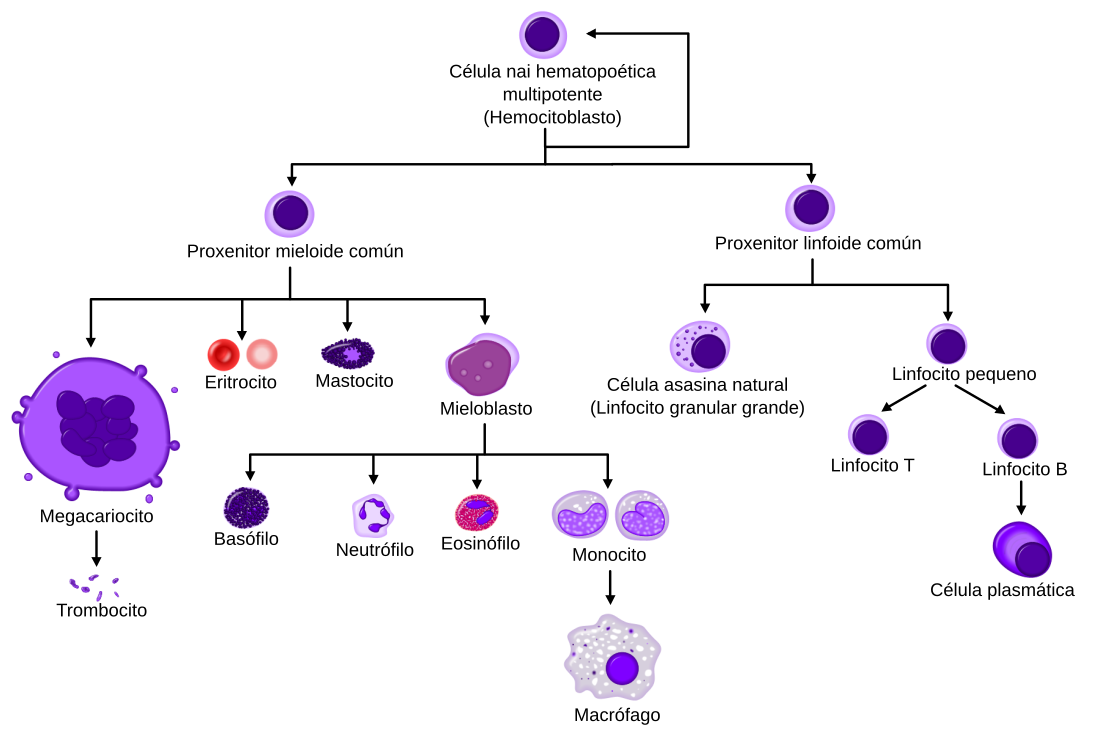
As células nai hematopoéticas (HSCs, polas súas siglas en inglés de hematopoietic stem cells) encóntranse na medula ósea e teñen a capacidade de dar lugar a todos os tipos de células sanguíneas maduras. As HSCs son células que se autorrenovan: cando proliferan, xa que polo menos algunhas das súas células fillas permanecen como HSCs, mentres que as outras se diferencian, de tal maneira que o conxunto de células nai non diminúe. Este fenómeno denomínase división asimétrica.[6] As outras células fillas das HSCs (células proxenitoras mieloides e linfoides) entran nunha das varias vías alternativas de diferenciación que levan á produción dun ou máis tipos específicos de células sanguíneas, pero non poden autorrenovarse. O conxunto de células proxenitoras é heteroxéneo e pode dividirse en dous grandes grupos: HSC autorrenovables de longo prazo e HSC autorrenovables só transitoriamente, tamén chamadas de curto prazo.[7] Este proceso que realizan é un dos principais procesos vitais do corpo.
As células sanguíneas divídense en tres grandes liñaxes, que se orixinan por tres grandes tipos de procesos hematopoéticos, chamados eritropoese, linfopoese e mielopoese. Estas tres liñaxes celulares son:[8]
- Células eritroides, que son os glóbulos vermellos que transportan o oxíxeno. Delas, tanto os reticulocitos coma os eritrocitos son funcionais e son liberadas ao sangue. De feito, o reconto de reticulocitos úsase para estimar a formación de células da liña eritroide, a cal se chama eritropoese.
- Linfocitos, que son as células esenciais para o funcionamento do sistema inmunitario adaptativo. Derivan de células proxenitoras linfoides comúns. A liñaxe linfoide está composta principalmente por células T e B, que forman parte dos glóbulos brancos do sangue. O seu proceso de formación denomínase linfopoese.
- Mielocitos, que comprenden o resto dos glóbulos brancos e as células da liña plaquetaria, como son os granulocitos, megacariocitos e macrófagos, todos eles derivados de células proxenitoras mieloides comúns. Están implicados en diversas funcións relacionadas coa inmunidade innata, inmunidade adaptativa, e coagulación do sangue. O seu proceso de formación denomínase mielopoese. A granulopoese (ou granulocitopoese) é a hematopoese de granulocitos. A megacariocitopoese é a hematopoese dos megacariocitos.
Localización

Nos embrións en desenvolvemento, a formación de sangue ocorre en agregados de células sanguíneas situados no saco vitelino, chamados illas sanguíneas (2ª semana embrionaria). A medida que progresa o desenvolvemento, a formación do sangue pasa a realizarse no bazo, fígado e ganglios linfáticos. Cando se desenvolve finalmente a medula ósea, esta pasa a asumir a tarefa de formar a maioría das células sanguíneas para todo o organismo. Porén, a maduración, activación e parte da proliferación de células linfoides ocorre en órganos linfoides secundarios (bazo, timo, e ganglios linfáticos). Nos nenos, a hematopoese ten lugar na medula dos ósos longos como o fémur ou a tibia. Nos adultos, ocorre principalmente nos ósos da pelve, cranio, vértebras, e esterno.[9]
Hematopoese extramedular
Nalgúns casos, o fígado, timo, e bazo poden volver a reiniciar a súa función hematopoética durante a vida adulta, se é necesario ou por razóns patolóxicas (por exemplo mielofibrose). Isto denomínase hematopoese extramedular. Cando se produce pode causar que eses órganos crezan en tamaño significativamente. Durante o desenvolvemento fetal, como os ósos e a medula ósea, se desenvolven máis tarde, o fígado funciona como o principal órgano hematopoético, polo que o fígado se agranda durante o desenvolvemento.[10]
Outros vertebrados
Nalgúns outros vertebrados, a hematopoese pode ocorrer onde haxa un estroma solto (pouco empaquetado) do tecido conectivo e unha produción lenta de sangue, en órganos como o intestino, bazo ou riles.[11]
Maduración
A medida que unha célula nai madura sofre cambios na súa expresión xénica que limitan os tipos de células en que pode converterse e que a achegan máis a un tipo celular específico. Estes cambios poden a miúdo ser rastreados monitorizando a presenza de proteínas da superficie celular. Cada cambio sucesivo move a célula máis preto do tipo celular final e limita a súa potencialidade de converterse noutro tipo de célula diferente.
Determinación
Hai dous puntos de vista para explicar a determinación. Para as células nai e outras células do sangue indiferenciadas da medula ósea, a determinación explícase xeralmente pola teoría do determinismo da hematopoese, na que factores estimulantes das colonias e outros factores do microambiente hematopoético determinan que as células sigan unha certa vía de diferenciación celular. Este é o modo clásico de describir a hematopoese. O outro punto de vista é a teoría estocástica, na que células sanguíneas indiferenciadas quedan determinadas para producir determinados tipos celulares de modo aleatorio. O microambiente hematopoético prevalece para que algunhas das células sobrevivan e algunhas entren en apoptose e morran. A medula ósea, ao regular este equilibrio entre os diferentes tipos celulares, pode alterar a cantidade de células diferentes que finalmente se producirán.[12]
Factores de crecemento hematopoéticos

A produción de células sanguíneas vermellas e brancas está regulada con gran precisión nos humanos sans, e a produción de leucocitos increméntase rapidamente durante unha infección. A proliferación e autorrenovación destas células depende de factores de crecemento. Un dos protagonistas clave na autorrenovación e desenvolvemento de células hematopoéticas é o factor de célula nai (SCF).[15] A ausencia deste factor é letal. Pero hai outros importantes factores de crecemento glicoproteicos, que regulan a proliferación e maduración, estes son por exemplo IL-2, 3, 6 e 7. Hai outros tres exemplos máis de factores que estimulan a produción de células nai comprometidas. Denomínanse factores estimulantes das colonias (CSFs) e inclúen o factor estimulante das colonias de granulocitos-macrófagos (GM-CSF), o factor estimulante das colonias de granulocitos (G-CSF) e o factor estimulante das colonias de macrófagos (M-CSF).[16] Estes estimulan a formación de granulocitos e son activos sobre as células proxenitoras ou sobre as células finais.
A eritropoetina cómpre para que unha célula proxenitora mieloide se converta en eritrocito.[13] A trombopoetina fai que as células proxenitoras mieloides se diferencien en megacariocitos (que son células formadoras de trombocitos ou plaquetas).[13] Exemplos de citocinas e das células sanguíneas ás que dan lugar son as que aparecen na imaxe da dereita.[17]
Factores de transcrición na hematopoese
Os factores de crecemento inician vías de transdución de sinais, que levan á activación de factores de transcrición. O sinal que reciben as células non é de tipo dixital. Isto significa que as células poden distinguir no sinal o tempo, a cantidade e a frecuencia. Por exemplo, a expresión de longo prazo de PU.1 ten como resultado dirixir a diferenciación da célula á liña mieloide, pero a indución de curto prazo da actividade PU.1 leva á formación de eosinófilos inmaturos.[18] Recentemente, informouse que factores de transcrición como o NF-κB poden ser regulados por microARNs (por exemplo, miR-125b) na hematopoese.[19]
A primeira molécula clave que intervén na diferenciación de células nai hematopoéticas a proxenitores muiltipotentes (MPP) é o factor de transcrición proteína alfa que se une ao amplificador CCAAT (C/EBP alfa). As mutacións na C/EBP alfa están asociadas coa leucemia mieloide aguda.[20] Despois, a vía divídese nunha liñaxe eritroide-megacariocítica ou linfoide e mieloide, que teñen un proxenitor común, chamado proxenitor multipotente sensibilizado a linfoide. Hai outros dous factores de transcrición principais: Pu.1 para a liñaxe eritroide-megacariocito, e GATA-1, que fai que se forme unha célula proxenitora multipotente sensibilizada a linfoide (lymphoid-primed).[21]
Outros factores son os da familia Ikaros[22], e Gfi1 ou IRF8. É importante tamén a intervención do mesmo factor varias veces na árbore da hematopoese. Por exemplo, a CEBP alfa no desenvolvemento de neutrófilos ou Pu.1. no desenvolvemento de monocitos e células dendríticas. Outra característica importante é que o proceso non é unidireccional.
Un exemplo é o factor PAX5, que é importante no desenvolvemento das células B e está asociado con linfomas.[23] Sorprendentemente, nos ratos knockout condicionais para pax5 as células B periféricas maduras poden desdiferenciarse a precursores da medula ósea de fases previas. Estes descubrimentos mostran que os factores de transcrición actúan como vixilantes do nivel de diferenciación e non só como iniciadores.[24]
As mutacións nos factores de transcrición están estreitamente conectados a cancros sanguíneos, como a leucemia mieloide aguda ou leucemia linfoblástica aguda. Por exemplo Ikaros regula numerosos eventos biolóxicos. Os ratos que non teñen Ikaros carecen de células B, células asasinas naturais e células T.[25] Ikaros ten seis dominios de dedo de cinc, catro son dominios de unión ao ADN conservados e dous son para a dimerización.[26] Un descubrimento moi importante é que están implicados diferentes dedos de cinc na unión con distintos sitios no ADN e esta é a razón do efecto pleiotrópico de Ikaros e a súa diferente implicación no cancro, pero principalmente son mutacións asociadas con pacientes BCR-Abl e é un marcador que indica mal prognóstico.[27]
O modelo baseado nas células mieloides
Durante a última década están acumulándose evidencias de que a maduración das HSCs segue un modelo baseado en mieloides en vez do modelo dicotómico "clásico". Neste último modelo, a HSC xera primeiro un proxenitor eritroide-mieloide común (CMEP) e un proxenitor linfoide común (CLP). O CLP produce células B e T. O modelo baseado no mieloide postula que as HSCs diverxen primeiro en CMEP e un proxenitor mielo-linfoide común (CMLP), que xera os proxenitores das células B e T por medio dun estado de proxenitor mieloide-T bipotencial e un proxenitor mieloide-B. A principal diferenza entre os modelos é que no modelo novo, todas as pólas das liñaxes eritroides, T e B reteñen o potencial de xerar células mieloides (mesmo despois da segregación das liñaxes de células T e B). O modelo propón a idea de que as células eritroides, T e B son tipos especializados dunha HSC mieloide prototípica. Poden verse máis detalles en Kawamoto et al. 2010.[28]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.