A inactivación do cromosoma X ou inactivación X, tamén chamada lyonización (por Mary F. Lyon), é un proceso por medio do cal unha das copias do cromosoma X é inactivada nalgunhas femias de mamíferos. O cromosoma X inactivo é silenciado ao ser empaquetado de modo que adopta a estrutura transcricionalmente inactiva de heterocromatina. Como practicamente todas as femias de mamífero teñen dous cromosomas X, a inactivación do X impide que teñan o dobre de produtos xénicos do cromosoma X que os machos, os cales só posúen unha copia de dito cromosoma (compensación de dose). A escolla de cal dos cromosomas X será inactivado é aleatoria en mamíferos placentarios como os humanos, pero unha vez que un cromosoma X é inactivado, este permanece inactivo durante toda a vida da célula e nas células descendentes desta que haxa no organismo. A diferenza da inactivación do X aleatoria observada en mamíferos placentarios, esta inactivación en marsupiais afecta exclusivamente ao cromosoma X procedente do pai.


1. Células embrionarias en estadio inicial dunha muller
2. Cromosoma X materno
3. Cromosoma X paterno
4. Mitose e evento de inactivación do cromosoma X aleatoria
5. O cromosoma paterno é inactivado ao chou nunha célula filla; o cromosoma materno é inactivado na outra
6. O cromosoma paterno é inactivado ao chou en ambas as células fillas
7. O cromosoma materno é inactivado ao chou en ambas as células fillas
8. Tres posibles combinacións de resultados aleatorias.

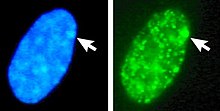
Esquerda: núcleo co ADN tinguido con DAPI. As frechas indican a localización do corpo de Barr (Xi). Dereita: proteínas histonas asociadas ao ADN deectadas.
Historia
En 1959 Susumu Ohno demostrou que os dous cromosomas X de mamíferos eran diferentes: un deles parecía similar aos autosomas; o outro estaba condensado e en estado heterocromático.[3] Este descubrimento suxeriu, independentemente a dous grupos de investigadores, que un dos cromosomas X sufría unha inactivación. En 1961, Mary F. Lyon propuxo a inactivación ao azar dun dos cromosomas X das femias para explicar o fenotipo a pintas de femias de rato heterocigotas para xenes da cor da pelame.[4] A hipótese de Lyon tamén explicaba por que unha das copias do cromosoma X das células das femias estaba moi condensada e por que os ratos cunha soa copia do cromosoma X se desenvolvían como femias infértiles. Isto suxeriulle[5] a Ernest Beutler, que estudaba femias heterocigotas para a deficiencia en glicosa-6-fosfato deshidroxenase (G6PD), que en tales heterocigotos había dúas poboacións de eritrocitos: as células deficientes e as normais,[6] dependendo de se o cromosoma X inactivado (no núcleo das células precursoras dos eritrocitos) contén o alelo G6PD normal ou defectivo.
Mecanismo
Ciclo da activación do cromosoma X
A inactivación do X forma parte do ciclo de activación do cromosoma X que ten lugar ao longo da vida da femia. O ovo e o cigoto fertilizado de ratos usan inicialmente transcritos maternos e todo o xenoma do embrión está silenciado ata a activación do xenoma cigótico. Por tanto, todas as células de rato sofren unha temperá inactivación impresa do cromosoma X derivado do pai durante o estadio embrionario de 4-8 células.[7][8][9][10] Os tecidos extraembrionarios (que dan lugar á placenta e outros tecidos de soporte do embrión) reteñen esta inactivación impresa temperanmente e así só o cromosoma X materno está activo neses tecidos.
Nos blastocistos temperáns, esta inactivación do X impresa inicial é revertida nas células da masa interna (que dan lugar ao embrión), e nestas células ambos os cromosomas X volven a estar activos de novo. Despois, cada unha destas células de forma independente e aleatoria inactivan unha copia do cromosoma X.[9] Este evento de inactivación é irreversible durante toda a vida do individuo, coa excepción da liña xerminal. Na liña xerminal feminina antes da entrada na meiose, a inactivación do X é revertida, polo que despois da meiose todos os ovocitos haploides conteñen un só cromosoma X activo.
Resumo
Con Xi indícase o cromosoma X inactivo e con Xa o activo. XP denota o cromosoma X paterno e XM o materno. Cando o ovo (que leva un XM) é fecundado por un espermatozoide (que leva un XP), fórmase un cigoto diploide. A partir do cigoto, a través da etapa adulta e ata a seguinte xeración de ovos, o cromosoma sofre os seguintes cambios:
- Cigoto XiP XiM → sofre a activación cigótica xenómica, que conduce a:
- XaP XaM → sofre unha inactivación X impresa (paterna), que orixina:
- XiP XaM → sofre activación X no estadio de blastocisto temperán, o que produce:
- XaP XaM → sofre inactivación X aleatoria na liñaxe embrional (células da masa interna) no estadio de blastocisto, o que orixina:
- XiP XaM OU XaP XiM → sofre unha reactivación X nas células xerminais primordiais antes da meiose, o que conduce a:
- Células xerminais diploides XaM XaP en detención meiótica. Dado que a meiose I só se completa coa ovulación, as células xerminais humanas existen neste estadio desde as primeiras semanas do desenvolvemento ata a puberdade. Cando a meiose se completa isto forma:
- Células xerminais haploides XaM E XaP (ovos).
O ciclo de activación X foi mellor estudado en ratos, pero fixéronse tamén múltiples estudos en humanos. Como a maioría das probas proceden dos ratos, o esquema anterior representa os eventos neses roedores. A terminación da meiose foi simplificada aquí para maior claridade. Os pasos 1-4 poden estudarse en embrións orixinados por fertilización in vitro, e en células nai en diferenciación; a reactivación X ocorre no embrión en desenvolvemento e as seguintes etapas (6-7) dentro do corpo da femia, o que é moito máis difícil de estudar.
Sncronización do momento
O momento en que ten lugar cada proceso depende da especie, e en moitos casos o momento preciso é obxecto de grandes debates.
| Proceso | Rato | Humano | |
| 1 | Activación xenómica cigótica | Estadio de 2-4 células[11] | Estadio de 2-8 células[11] |
| 2 | Inactivación X impresa (paterna) | Estadio de 4-8 células[10][12] | Non está claro se ten lugar en humanos[13] |
| 3 | Activación X | Estadio de blastocisto temperán | Estadio de blastocisto temperán |
| 4 | Inactivación X aleatoria na liñaxe embrional (células da masa interna) | Estadio de blastocisto tardío | Estadio de blastocisto tardío, despois da implantación[13] |
| 5 | Reactivación X en células xerminais primordiais antes da meiose | Desde antes da semana 4 do desenvolvemento ata a semana 14[14][15] |
Herdanza do status de inactivación a través das xeracións
Os descendentes de cada célula que inactivou un determinado cromosoma X tamén terán desactivado ese mesmo cromoxoma X. Este fenómeno, que pode observarse na coloración de coiraza de tartaruga da pelame dos gatos cando as femias son heterocigotas para o xene ligado ao sexo implicado, non debería confundirse co mosaicismo, que é un termo que se refire especificamente ao xenotipo de varias poboacións celulares presentes no mesmo individuo; ao contrario, a inactivación X, que é un cambio epixenético que ten como resultado un fenotipo diferente, non é un cambio a nivel xenotípico. Para unha liñaxe ou célula individual a inactivación é, por tanto, nesgada ou non aleatoria, e isto pode dar lugar a síntomas suaves nas 'portadoras' femininas de trastornos xenéticos ligados ao X.[16]
Selección dun cromosoma X activo
As femias normais posúen dous cromosomas X e nunha célula determinada un deles estará activo (designado como Xa) e o outro activo (Xi). Porén, os estudos de individuos con copias extra do cromosoma X indican que nas células con máis de dous cromosomas X hai un só Xa, e todos os demais cromosomas X están inactivados. Isto indica que o estado por defecto do cromosoma X en femias é a inactivación, pero sempre un dos cromosomas X se selecciona para estar activo.
Sábese que a inactivación do cromosoma X é un proceso aleatorio que se produce aproximadamente no momento da gastrulación no epiblasto (as células que darán lugar ao embrión). Os cromosomas X materno e paterno teñen igual probabilidade de inactivación. Isto suxeriría que se esperaría que as mulleres sufrisen trastornos ligados ao X nunha proporción do 50% con respecto aos homes (porque as mulleres teñen dous cromosomas X, mentres que os homes teñen só un); porén, na realidade, a frecuencia destes trastornos en femias é moito menor que esa cifra. Unha explicación desta disparidade é que entre o 12 e o 20% [17] dos xenes do cromosoma X inactivado seguen expresándose, o que proporciona ás mulleres unha protección adicional contra xenes defectuosos codificados no cromosoma X. Suxeriuse que esta disparidade tiña que ser unha proba dunha inactivación preferencial (non aleatoria). A inactivación preferencial do cromosoma X paterno dáse tanto en marsupiais coma en liñaxes celulares que forman as membranas que rodean o embrión,[18] mentres que nos mamíferos placentarios poden ser inactivados tanto o cromosoma X derivado do pai coma da nai en diferentes liñas celulares.[19]
O período de tempo en que se produce a inactivación do cromosoma X explica esta disparidade. A inactivación ocorre no epiblasto durante a gastrulación, o que dá lugar ao embrión.[20] A inactivación ocorre a nivel celular, resultando nunha expresión en mosaico, na cal grupos de células teñen un cromosoma X inactivo materno, mentres que noutros o cromosoma X inactivo é o paterno. Por exemplo, unha femia heterocigota para a hemofilia (unha enfermidade ligada ao X) tería aproximadamente a metade das súas células hepáticas funcionando perfectamente, o que normalmente é dabondo para asegurar unha coagulación do sangue normal.[21][22] Por azar poderían orixinarse significativamente máis células disfuncionais; porén, tales extremos estatísticos son improbables. As diferenzas xenéticas no cromosoma poden tamén facer que sexa máis probable que un determinado cromosoma X sufra inactivación. Ademais, se un cromosoma X ten unha mutación que dificulta o seu crecemento ou a fai non viable, as células que aleatoriamente inactivaron ese cromosoma X terán unha vantaxe selectiva sobre as células que aleatoriamente inactivaron o alelo normal. Así, aínda que a inactivación é inicialmente ao azar, as células que inactivan o alelo normal (deixando activo o alelo mutado) finalmente proliferarán menos e serán substituídas por células normais, as cales case todas teñen o mesmo cromosoma X activado.[21]
Hipotetízase que hai un 'factor de bloqueo' codificado nun autosoma, que se une ao cromosoma X e impide a súa inactivación. O modelo postula en concreto que hai un factor bloqueante limitante, polo que unha vez que a molécula de factor limitante dispoñible se une a un cromosoma X, o(s) restante(s) cromosoma(s) X non está(n) protexido(s) da inactivación. Este modelo está apoiado pola existencia dun só Xa nas células con moitos cromosomas X e pola existencia de dous cromosomas X activos en liñas celulares cun número de autosomas dúas veces o normal.[23]
As secuencias no centro de inactivación X (XIC), presentes no cromosoma X, controlan o silenciamento do cromosoma X. Suponse que o factor bloqueante hipotético se une a secuencias situadas dentro do centro de inactivación X. O XIC contén varios xenes que non son traducidos e que son responsables da transcrición de ARN implicados na inactivación. Estes xenes codifican varios ARN non codificantes longos, os cales son transcritos de máis de 200 nucleótidos con carapucha 5' e cola poliA 3' pero a diferenza do ARNm non codifican proteínas. Os principais ARN non codificantes longos do XIC son Xist, Tsix, Jpx e FTX. Ademais destes xenes contén tamén secuencias ás que se unen proteínas reguladoras.

Expresión de trastornos ligados ao X en femias heterocigotas
O efecto da heterocigosidade do X en femias manifestase nalgúns trazos localizados, como o padrón da pelame dos gatos calico. Porén, pode ser máis difícil comprender completamente a expresión de trazos non localizados nestas femias, como a expresión de enfermidades.
Como os machos só teñen unha copia do cromosoma X, todos os xenes do cromosoma X expresados (ou alelos, no caso de formas con múltiples variantes dun mesmo xene na poboación) están localizadas nesa copia do cromosoma. As femias, porén, expresarán principalmente os xenes ou alelos localizados na copia do cromosoma X que permanece activo. Considerando a situación dun xene ou múltiples xenes que causan diferenzas individuais nun determinado fenotipo (é dicir, causan variacións observadas na poboación para ese fenotipo), en femias homocigotas non importa cal das copias do cromosoma está inactivada, xa que os alelos de ambas as copias son o mesmo. Porén, en femias que son heterocigotas nos xenes causais, a inactivación dunha copia do cromosoma en vez doutra pode ter un impacto directo sobre o valor fenotípico. Debido a este fenómeno, observouse un incremento en variación fenotípica en femias que son heterocigotas no xene ou xenes implicados con respecto ás que son homocigotas.[24] Hai moitos xeitos diferentes polos cales se pode desenvolver unha variación fenotípica. En moitos casos, as femias heterocigotas poden ses asintomáticas ou presentar só síntomas menores dunha determinada desorde, como a adrenoleucodistrofia ligada ao X.[25]
A diferenciación do fenotipo en femias heterocigotas é impulsada pola presenza de inactivación X nesgada. Tipicamente, cada cromosoma X é silenciado na metade das células, pero este proceso está nesgado cando ocorre a inactivación preferencial dun cromosoma. Pénsase que o nesgo acontece por azar ou por unha característica física dun cromosoma que pode causar que sexa silenciado con maior ou menor frecuencia, como unha mutación desfavorable.[26][27]
Como media, cada cromosoma X é inactivado na metade das células, porén do 5 ao 20% de mulleres "aparentemente normais" mostran inactivación do X nesgada.[26] En casos nos que o nesgo está presente, pode darse unha ampla variedade de expresión de síntomas, o que ten como resultado que a expresión varíe de menor a grave dependendo da proporción de nesgo. Un caso extremo disto pode verse cando femias xemelgas monocigotas teñen unha variación extrema na expresión da enfermidade de Menkes (un trastorno ligado ao X), con resultado de morte dunha das xemelgas mentres que a outra permanece asintomática.[28]
Crese que o nesgo na inactivación X podería ser causada por efectos no mecanismo que causa a inactivación ou efectos sobre o propio cromosoma.[26][27] Porén, a ligazón entre fenotipo e nesgo aínda é moi cuestionada e debería ser examinada caso por caso. Un estudo que examinou femias sintomáticas e asintomáticas que eran heterocigotas para as distrofias musculares de Duchenne e Becker non encontrou unha ligazón aparente entre a expresión de transcritos e a inactivación X nesgada. O estudo suxire que ambos os mecanismos están regulados independentemente e hai outros factores descoñecidos en xogo.[29]
Compoñente cromosómico
O 'centro de inactivación X' (XIC) no cromosoma X é necesario e suficiente para causar a inactivación X. As translocacións cromosómicas que sitúan o centro de inactivación X nun autosoma causan a inactivación do autosoma e os cromosomas X carentes de centro de inactivación X non son inactivados.[30][31]
O XIC contén catro xenes de ARN que non se traducen: Xist, Tsix, Jpx e Ftx, que están implicados na inactivación X. O XIC tamén contén sitios de unión para proteínas regulatorias coñecidas e descoñecidas.[32]
ARNs Xist e Tsix


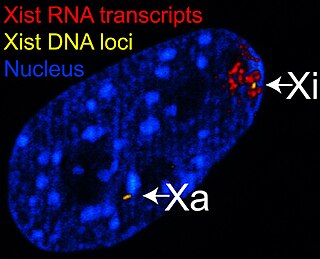
O xene do transcrito específico do X inactivo (Xist, do inglés X-inactive specific transcript) codifica un grande ARN non codificante que actúa como mediador do silenciamento específico do cromosoma X, do cal se transcribe.[33] O cromosoma X inactivo está cuberto polo ARN Xist,[34] mentres que o Xa non (ver figura da dereita). Os cromosomas X que carecen do xene Xist non poden ser inactivados.[35] Situando o xene Xist artificialmente e facendo que se exprese noutro cromosoma causa o silenciamento dese cromosoma.[30][36]
Antes da inactivación, ambos os cromosomas X expresan debilmente o ARN Xist a partir do xene Xist. Durante o proceso de inactivación, o futuro Xa deixa de expresar Xist, mentres que o futuro Xi incrementa drasticamente a produción o ARN Xist. No futuro Xi, o ARN Xist cobre progresivamente o cromosoma, espallándose desde o XIC;[36] o ARN Xist non se localiza sobre o Xa. O silenciamento de xenes ao longo do Xi ocorre pouco despois do recubrimento polo ARN Xist.
Igual que Xist, o xene Tsix codifica un ARN grande que se cre que non codifica unha proteína. O ARN Tsix é transcrito como antisentido con respecto ao Xist, significando que o xene Tsix se solapa ao xene Xist e é transcrito da febra oposta do ADN do xene Xist.[31] O Tsix é un regulador negativo de Xist; os cromosomas X que carecen de expresión de Tsix (polo que teñen altos niveis da transcrición de Xist) son inactivados moito máis frecuentemente que os cromosomas normais.
Como o Xist, antes da inactivación, ambos os cromosomas X expresan debilmente o ARN Tsix a partir do xene Tsix. Despois do comezo da inactivación X, o futuro Xi deixa de expresar o ARN Tsix (e incrementa a expresión de Xist), mentres que o Xa continúa expresando Tsix durante varios días.
Rep A é un ARN non codificante longo que funciona con outro ARN non codificante longo, o Xist, para a inactivación X. Rep A inhibe a función de Tsix, o antisentido de Xist, en conxunción coa eliminación da expresión de Xist. Promove a metilación da rexión Tsix ao atraer PRC2 e así inactivar un dos cromosomas X.[32]
Silenciamento
O cromosoma X inactivo non expresa a maioría dos seus xenes, a diferenza do cromosoma X activo. Isto débese ao silenciamento do Xi por heterocromatina represiva, que compacta o ADN do Xi e impide a expresión da maioría dos xenes.
Comparado co Xa, o Xi ten un alto nivel de metilación do ADN, baixos niveis de acetilación de histonas, baixos niveis de metilación da lisina-4 da histona H3 e altos niveis de metilación da lisina-9 da histona H3 e unha marca de metilación da lisina-27 da histona H3, a cal é situada polo complexo PRC2 recrutado por Xist, todo o cal están asociados co silenciamento de xenes.[37] O PRC2 regula a compactación da cromatina e a súa remodelación en varios procesos, como a resposta aos danos no ADN.[38] Adicionalmente, unha variante de histona chamada macroH2A (H2AFY) encóntrase exclusivamente nos nucleosomas xunto co Xi.[39][40]
Corpo de Barr
- Artigo principal: Corpo de Barr.
O empaquetamento do ADN en heterocromatina, como no Xi, é un estado máis condensado que o da eucromatina, como no Xa. O X inactivo forma un corpo discreto dentro do núcleo chamado corpo de Barr.[41] O corpo de Barr está xeralmente localizado na periferia do núcleo, e é replicado posteriormente no ciclo celular e, como contén o Xi, contén modificacións da heterocromatina e o ARN Xist.
Xenes expresados no cromosoma X inactivo
Unha fracción dos xenes do cromosoma X escapan á inactivación do Xi. O xene Xist é expresado a altos niveis no Xi e non se expresa no Xa.[42] Moitos outros xenes escapan á inactivación; algúns son expresados por igual no Xa e no Xi, e outros, aínda que tamén se expresan en ambos os cromosomas, son expresados predominantemente polo Xa.[43][44][45] Ata unha cuarta pate dos xenes do Xi humano poden escapar á inactivación.[43] Estudos feitos en ratos suxiren que en calquera tipo de célula, dun 3% a un 15% dos xenes escapan á inactivación, e que a identidade dos xenes que escapan varía entre tecidos.[44][45]
Moitos dos xenes que escapan á inactivación están presentes en rexións do cromosoma X que, a diferenza da maioría do cromosoma X, conteñen xenes que tamén están representados no cromosoma Y (os cromosomas X e Y son homólogos nesas porcións). Estas rexións denomínanse rexión pseudoautosómicas, xa que individuos dos dous sexos reciben dúas copias de cada xene destas rexións (como nun autosoma), a diferenza da maioría dos xenes dos cromosomas sexuais. Como os individuos de ambos os sexos reciben dúas copias de cada xene dunha rexión pseudoautosómica, non se necesita unha compensación de dose para as femias, polo que non se postula que nestas rexións do ADN evolucionasen mecanismos para escapar á inactivación X. Os xenes das rexións pseudoautosómicas do Xi non teñen as modificacións típicas do Xi e teñen poruco ARN Xist unido.
A existencia de xenes no X inactivo que non son silenciados explica os defectos observados en humanos con cantidades anormais de cromosomas X, como os que presentan síndrome de Turner (X0) ou síndrome de Klinefelter (XXY). Teoricamente, a inactivación X debería eliminar as diferenzas na dose de xenes entre individuos afectados e individuos co complemento cromosómico normal. Porén, en individuos afectados, a inactivación X é incompleta e a dose destes xenes non silenciados diferirá, xa que escapan da inactivación do X, o que é similar a unha aneuploidía autosómica.
Os mecanismos precisos que controlan o escape da inactivación X non se coñecen, mais as rexións sienciadas e que escapan teñen distintas marcas na cromatina.[44][46] Suxeriuse que o escape da inactivación do X podería estar mediada pola expresión dun ARN non codificante longo dentro dos dominios cromosómicos de escape.[2]
Usos en bioloxía experimental
Stanley Michael Gartler utilizou a inactivación do cromosoma X para demostrar a orixe clonal dos cancros. O exame de tecidos normais e tumores de femias heterocigotas para isoenzimas do xene ligado ao sexo da G6PD demostrou que as células tumorais deses individuos expresan só unha forma de G6PD, mentres que os tecidos normais están compostos dunha mestura case igual de células que expresan os dous fenotipos diferentes. Este padrón suxire que unha soa célula, e non unha poboación, crece orixinando un cancro.[47] Porén, este padrón demostrouse que estaba errado na maioría dos tipos de cancros, o que indica que algúns cancros poden ser de orixe policlonal.[48]
Ademais, medir o status de metilación (inactivación) dun receptor de andróxenos polimórfico humano (HUMARA) localizado no cromosoma X é considerado o método máis exacto de estimar a clonalidade en biopsias de cancros femininos.[49] Comprobouse unha gran variedade de tumores con este método, algúns, como o carcinoma celular renal,[50] eran monoclonais, mentres que outros (por exemplo, o mesotelioma[51]) eran policlonais.
Tamén se fixeron investigacións usando a inactivación do cromosoma X para silenciar a actividade de cromosomas autosómicos. Por exemplo, Jiang et al. inseriu unha copia do xene Xist nunha copia do cromosoma 21 en células nai derivadas dun individuo con trisomía 21 (síndrome de Down).[52] O xene Xist inserido induce a formación do corpo de Barr, desencadea modificacións estables da heterocromatina e silencia a maioría dos xenes na copia extra do cromosoma 21. Nestas células nai modificadas, o silenciamento de xenes mediado por Xist parece reverter algúns dos defectos asociados coa síndrome de Down.
Notas
Véxase tamén
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
