Bicarbonate de sodium
composé chimique De Wikipédia, l'encyclopédie libre
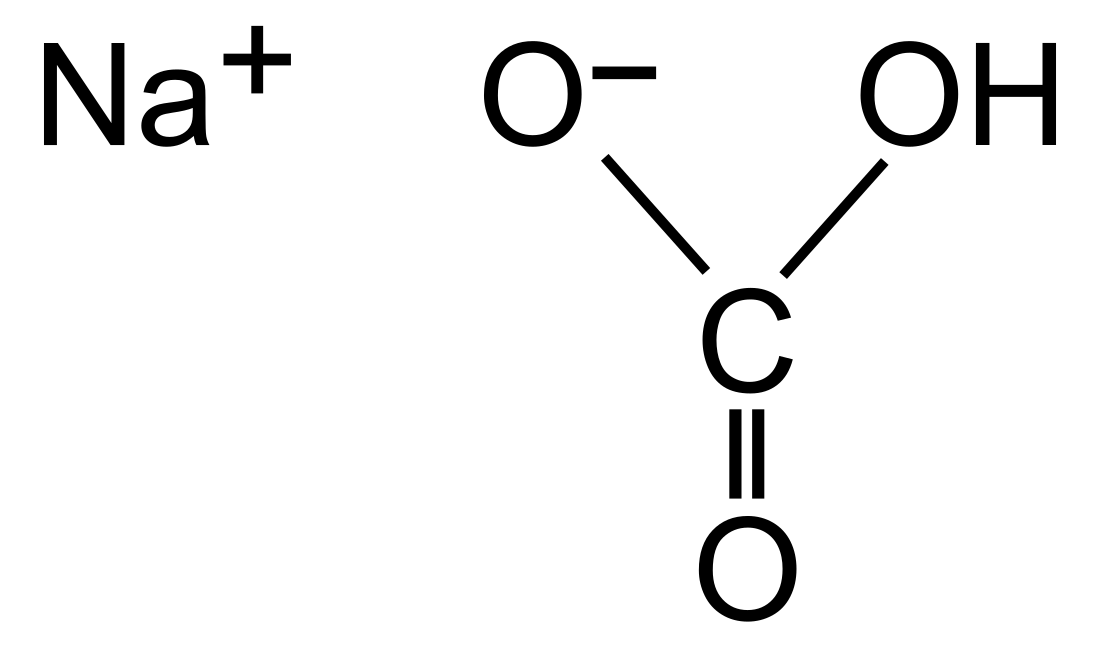
Le bicarbonate de sodium Écouter (ou carbonate monosodique ou carbonate acide de sodium, anciennement bicarbonate de soude[a]), l'hydrogénocarbonate de sodium en nomenclature moderne, est un composé inorganique décrit par la formule brute NaHCO3.
| Bicarbonate de sodium | ||
| ||
 | ||
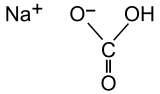
| Structure et poudre de bicarbonate de sodium | ||
| Identification | ||
|---|---|---|
| Nom UICPA | hydrogénocarbonate de sodium | |
| Synonymes |
bicarbonate de soude, carbonate acide de sodium (ancienne appellation en pharmacie) |
|
| No CAS | ||
| No ECHA | 100.005.122 | |
| No CE | 205-633-8 | |
| Code ATC | B05 B05 « QG04BQ01 » | |
| No E | E500(ii) | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc en prisme (pur), mais aussi en pratique de formes variables[1] | |
| Propriétés chimiques | ||
| Formule | NaHCO3 | |
| Masse molaire[2] | 84,006 6 ± 0,001 8 g/mol C 14,3 %, H 1,2 %, Na 27,37 %, O 57,14 %, 84,01 g/mol |
|
| pKa | pKa1=10,33, pKa2=6,33 (couples HCO3− / CO32− et CO2 dissous / HCO3−) | |
| Propriétés physiques | ||
| T° fusion | 270 °C (décomposition en NaOH par perte de CO2) mais bicarbonate avec traces d'acides se décompose lentement dès 50 °C en solide Na2CO3, gaz CO2 et vapeur d'eau[3] | |
| Solubilité | 87 g l−1 (eau, 20 °C)[1] |
|
| Masse volumique | 2,22 g cm−3 à 20 °C[4] | |
| Thermochimie | ||
| ΔfH0solide | −947 kJ mol−1(24,85 °C)[5] | |
| ΔfusH° | 136 J mol−1 K−1(24,85 °C) | |
| Cp | 87,7 kJ K−1 mol−1 (25 °C)[3] | |
| Cristallographie | ||
| Système cristallin | monoclinique | |
| Propriétés optiques | ||
| Indice de réfraction | 1,500 | |
| Précautions | ||
| SIMDUT[6] | ||
Produit non contrôlé |
||
| Considérations thérapeutiques | ||
| Classe thérapeutique | Antiacide | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
C'est un composé ionique blanc de l'anion hydrogénocarbonate et du cation sodium, qui se présente sous forme de poudre. La forme ultra pure, très rare, est constituée de cristaux prismatiques blancs.
Ce corps minéral anhydre, sous l'appellation minéralogique de nahcolite, apparaît néanmoins dans la nature sous la forme d'agrégats de cristaux prismatiques, le plus souvent en veines fibreuses ou en concrétions. Au laboratoire, l'hydrogénocarbonate de sodium apparaît sous la forme de fins cristaux blancs, solubles dans l'eau.
Historique
Résumé
Contexte
Les Égyptiens de l'Antiquité connaissaient déjà la poudre blanche appelée natron, se présentant comme des efflorescences se formant sur les bords des eaux saumâtres lors de l'évaporation de nombreux lacs africains (lacs salés à eau bicarbonatée). Ce natron est un minerai à base d'un sel décahydraté[7] de carbonate de sodium et composé de dépôts carbonatés et hydrocarbonatés, dont le bicarbonate de sodium.
Selon Hérodote, ce natron était utilisé par les Égyptiens lors des rituels de momification et pour de maints usages, comme se frotter les dents, pour l'hygiène ritualisée de leur corps ou pour purifier leur logis[8].
Le « bicarbonate de soude »[a] n'est pas considéré par les Anciens comme un alcali.

On le trouve souvent dans les eaux de sources chaudes ou sources thermales antiques[b]. Il est parfois dénommé sel Vichy exclusivement sous forme d'un monohydrate[c]. Lorsque les eaux chaudes des sources bicarbonatées se refroidissent, le bicarbonate de sodium se dépose facilement, sa solubilité à 20 °C et à pression ambiante n'est que 9,61 g pour 100 g d'eau.
Dans son Journal de voyage en Italie, Michel de Montaigne décrit des eaux à écume blanche qui se fixe, produit une croûte dure sur l'eau, s'incruste et reste aussi ferme que la glace[d]. Un ramassage à l'aide de toiles permet de recueillir le produit naturel, pilé en poudre mise en flacon et exportée au loin, en particulier pour nettoyer les dents. D'après cette description naturaliste, elle apparaît principalement à base de bicarbonate de sodium ou de sel Vichy.
En 1791, le chimiste français Nicolas Leblanc élabore par un procédé artificiel le carbonate de sodium, tel que nous le connaissons aujourd'hui. Mais le raffinage industriel du carbonate de sodium pour donner du bicarbonate de sodium à partir du trona, n'a été mis au point qu'en 1846 par deux boulangers new-yorkais : Austin Church et son gendre John Dwight. Ils créent, près de New-York, la société Church and Dwight.
Production et synthèse
Le bicarbonate de sodium peut être obtenu à partir de gisements naturels de natron ou de trona, donc en partant de carbonate de sodium hydraté, mais il est plus souvent recueilli à moindre frais en traitant les eaux saumâtres, par exemple celles des zones productrices de ces précédents minerais.
Le procédé Solvay mis en œuvre en 1863 à échelle industrielle par le chimiste belge Ernest Solvay, produit du carbonate de sodium Na2CO3 à partir de sel et de craie, mais en passant par le bicarbonate de sodium en voie humide, qui précipite. Mais, pour des raisons techniques ou de pureté, ce carbonate de sodium ou soude Solvay redonne du bicarbonate de sodium selon la réaction suivante (1) :
- Na2CO3 + H2O + CO2 → 2 NaHCO3.
Ce procédé est encore aujourd'hui le plus employé dans le monde, et le seul utilisé en Europe.
Propriétés physico-chimiques
Résumé
Contexte

L'hydrogénocarbonate de sodium montre une faible solubilité dans l'eau. C'est sa facile précipitation à froid qui est utilisée pendant la seconde étape du procédé Solvay, promouvant la voie humide par les saumures.
Dans 100 g d'eau, on peut dissoudre 6,9 g à 0 °C (eau froide), 8,15 g à 10 °C, 9,6 g à 20 °C, 11,1 g à 30 °C, 12,7 g à 40 °C, 14,45 g à 50 °C, 16,4 g à 60 °C (eau chaude)[9], et 19,7 g à 80 °C.
L'ion hydrogénocarbonate est amphotère, il participe à deux couples acido-basiques : HCO3− / CO32− de pKa 10,3 et CO2 dissous / HCO3− de pKa 6,33. En abaissant le pH, on obtient donc un dégagement d'acide carbonique dissous, voire une effervescence rapide caractéristique des anions carbonates ou des roches carbonatées en réaction à l'acide fort. Par augmentation du pH, c'est-à-dire en alcalinisant le milieu, on obtient de la soude ou carbonate de sodium en milieu aqueux.
Dissous dans l'eau, il évite la précipitation, d'ordinaire si facile, des ions Ca2+ en carbonate de calcium ou calcaire. Voilà l'origine de ses propriétés adoucissantes.
Le bicarbonate de sodium, solide et impur, perd du dioxyde de carbone, très faiblement à partir de 50 °C mais plus fortement à partir de 70 °C. Il s'agit de la réaction inverse de dégradation (1) de la soude Solvay :
- 2 NaHCO3 poudre chauffée → Na2CO3 solide + CO2 gaz + H2O gaz
Plus la température s'élève, plus un véritable dégazage de CO2 est constaté, notamment à 100 °C. Il est ainsi utilisé comme un agent chimique levant de pâtes farineuses et de divers gâteaux. La levure chimique comprend NaHCO3, mais aussi deux acides et un liant comme l'amidon. Le premier des deux acides est l'acide tartrique humide qui permet la naissance de cavités à faible température. Un second sel acide est nécessaire pour son action d'accroissement des cavités à température plus élevée[e].
Piégé dans le réseau élastique du gluten, protéine du blé permettant d'obtenir par exemple une pâte à pain plastique et malaxable mécaniquement, ce gaz en expansion, émis par l'action différenciée des deux acides, augmente le volume de la pâte avant d'être évacué en fin de cuisson. Le gâteau révèle finalement une texture plus moelleuse.
Il est converti en carbonate de sodium à 100 °C[3].
- 2 NaHCO3 poudresolide → Na2CO3 anhydre + H2O gaz + CO2 gaz
Le bicarbonate de sodium est biodégradable et n'est toxique ni pour l'environnement, ni pour la santé[10].
Appellations
Le bicarbonate de sodium peut être désigné de plusieurs façons selon le contexte ou l'époque : bicarbonate de soude, carbonate acide de sodium (ancien nom), sodium bicarbonate (médecine), NaHCO3, sodium hydrogen carbonate (chimie), carbonic acid monosodium salt, bicarbonate of soda, baking soda ou bread soda (anglo-saxon ; il est en effet traditionnellement fait du pain au bicarbonate de soude), etc.[11].
Types

Il existe trois types de bicarbonate de sodium :
- technique ;
- alimentaire ;
- médicinal ou officinal.
Même si l'appellation est la même, les critères de pureté sont différents : on doit veiller à n'utiliser la qualité « technique » que pour un usage ménager . La qualité médicinale ou officinale est la plus fine et la plus pure. La qualité alimentaire est indiquée avec le code FCC et peut être utilisée pour tout emploi[12].
Le bicarbonate de sodium (ou de soude) ne doit jamais être confondu avec les cristaux de soude (carbonate de sodium), ni avec la soude caustique (hydroxyde de sodium).
Utilisations
Résumé
Contexte
Les avantages notables du bicarbonate de sodium (NaHCO3) sur les produits chimiques habituels sont sa sécurité, sa disponibilité et son faible coût[13].
Le bicarbonate a de très nombreuses utilisations confirmées par les analyses scientifiques[14],[15].
On peut trouver des recettes de produits nettoyants fait maison qui préconisent un mélange de bicarbonate de sodium avec du vinaigre blanc. Ce mélange produit de l'acétate de sodium qui n'a aucune propriété nettoyante et un dégagement de dioxyde de carbone (forte effervescence). Ce mélange n'a aucune propriété réellement avérée.
Usage domestique
Hygiène et soins du corps

- Pour les soins du visage : en gommage ou exfoliant doux du visage, l'action étant assortie d'un assainissement de la peau.
- Comme dentifrice en complément avec le fluor[16],[17],[18], comme agent de blanchiment des dents[19],[20] et comme agent anti-bactérien[21],[22], contre le tartre et la plaque dentaire[23],[24] (il est même plus efficace que les dentifrices classiques[25],[26]) et pour ses propriétés anti-caries[27],[21] (avec une valeur RDA de 7 donc non-abrasif[28],[24] et inoffensif pour l'émail dentaire[29]) car il fonctionne comme un nettoyant mécanique sur les dents et les gencives[26]. Ses effets sont valables sur les dents naturelles comme sur les prothèses dentaires[30] ;
- « - seul ou mélangé à de l'argile en poudre ou ajouté au dentifrice classique sur une brosse à dents à poils souples[30],[26]. »
- En bain de bouche pour l'assainissement de la cavité buccale ou de ses plaies de muqueuses comme les aphtes[31],[23] (en tant qu'antiseptique)[32] ; il neutralise également l'acidité de la bouche, et agit là encore comme un antiseptique et anti-bactérien[22] pour aider à prévenir les infections buccales[32] et la plaque dentaire[23], et pour lutter contre la mauvaise haleine, l'halitose[10] ;
- « - une fois par jour, une petite cuillerée dans une tasse d'eau tiède[15]. »
- Pour certains gargarismes (voir ci-dessus).
- Pour l'hygiène des dreadlocks.
- En shampooing, avec rinçage à l'eau ou à l'eau légèrement vinaigrée. Il est notamment utilisé dans le mouvement no poo, comme alternative aux shampoings chimiques et industriels[33] ;
- « - saupoudrer le bicarbonate sur le crâne et la chevelure mouillée, masser le cuir chevelu et les cheveux, rincer. »
- Comme déodorant neutre sous les aisselles par son action antibactérienne[34] (bactéries du genre Corynebacterium responsables des odeurs de transpiration[35]) ;
- « - application en tapotements sous les aisselles à peine humides[15]. »
- « - une cuillerée de bicarbonate de sodium mélangée dans une tasse d’eau tiède puis appliquée avant et après rasage. »
Produit d'entretien à la maison

- Comme produit de nettoyage antibactérien, antimicrobien, antifongique, désinfectant, assainissant et antiviral (virucide) sur les surfaces de contact alimentaire, selon les études scientifiques[13],[36],[37],[f],[22],[38].
- De manière générale, pour nettoyer efficacement four, micro-ondes, carrelages, taches de graisse, taches sur le marbre, argent terni[15] ;
- « - disposer une pâte constituée de bicarbonate de sodium et d'eau sur la tache puis frotter ou bien frotter la tache avec une éponge humide et du bicarbonate. »
- Comme produit d'entretien de la maison et agent nettoyant de type poudre à récurer pour blanchir et désinfecter les émaux (baignoire, évier, lavabo, douche, WC, etc.)[39],[40] ;
- « - saupoudrer la surface à traiter et frotter ou mettre le bicarbonate sur une éponge humide et frotter. »
- Pour nettoyer les vitres intérieures de four, les casseroles brûlées, etc.[40] ;
- « - constituer une pâte avec du bicarbonate et un peu d'eau à laisser reposer 20 min sur les zones brûlées puis essuyer ou saupoudrer la casserole brûlée de bicarbonate, ajouter de l'eau et laisser reposer plusieurs heures. »
- Pour l'entretien du linge comme adoucissant, assainissant[g] et détachant avant ou pendant lavage, en tant qu'alcali[41],[42] ;
- « - ajouter une demi-tasse de NaHCO3 dans l'eau de lavage ou le compartiment à lessive de la machine à laver et alléger la dose de savon ou détergent habituel[15]. »
- Contre les mauvaises odeurs du réfrigérateur, le bicarbonate ne masque pas mais détruit les particules d'odeurs[43],[40] ;
- « - nettoyer un réfrigérateur puis placer au fond une tasse remplie de bicarbonate de sodium. »
- Contre les mauvaises odeurs de décomposition des déchets organiques de la poubelle ou d'une canalisation, le NaHCO3 en anéantit 70 %[44] ;
- « - saupoudrer 50 g de bicarbonate de sodium, répartis au fond d'un bac de déchets alimentaires de 8 litres. »
- Pour l'entretien de la fosse septique[45].
- Comme désodorisant et antifongique, antimycosique contre les odeurs de transpiration des baskets, chaussures, vêtements ou autres endroits[17] ;
- « - saupoudrer, laisser reposer quelques heures puis évacuer la poudre. »
- Comme désodorisant et antifongique sur les tapis et moquettes[38] ;
- « - saupoudrer d'une main légère, laisser reposer puis battre ou aspirer. »
- Comme désodorisant anti-moisissures, le NaHCO3 absorbe les odeurs de moisi des anciens placards et est une méthode fiable pour les vendeurs de livres d'occasion malodorants, assorti ensuite à une aération[46].
- En remplacement des désodorisants commerciaux pour la maison[15] ;
- « - dans un petit pot, 1/3 de bicarbonate de sodium à mélanger avec quelques gouttes d'huile essentielle au choix, à recouvrir d'un carré de tissu fin et à fixer avec un ruban ou un élastique ; secouer le pot quand le parfum semble disparaître[15]. »
- « - dilué dans de l'eau chaude. »
- Pour ôter la rouille de surface dans le cas de certaines oxydations[47].
- Comme agent actif pour déboucher des canalisations légèrement obturées[48].
- Comme adoucisseur d'eau pour réduire la dureté de l'eau (d'un bain ou d'une piscine, par exemple)[10].
- Pour lutter contre la croissance fongique[38], les parasites comme les acariens ou tuer les cafards ;
- « - saupoudrer la literie (laisser reposer quelques heures puis ôter la poudre), saupoudrer les plinthes et autres trajets des insectes. » Le bicarbonate de sodium est enregistré comme biopesticide par l'Environmental Protection Agency aux États-Unis[49].
Au garage
Source[10].
- Pour ôter les insectes, les gouttes de résine ou de sève sur la carrosserie ou les phares.
- « - une éponge imbibée de bicarbonate de sodium alimentaire suffit et ne raye pas »
- Pour ôter les mauvaises odeurs
- « - saupoudrer de NaHCO3 le cendrier, les sièges et les tapis (à ôter après quelques heures) »
- Pour nettoyer et prolonger la vie des bornes sulfatées d’une batterie d'automobile
- « - appliquer sur les bornes une pâte composée de 3/4 de bicarbonate et 1/4 d’eau, brosser, rincer, sécher puis enduire de vaseline »
- Pour faire disparaître une tache d’huile sur le béton
- « - saupoudrer la tache de bicarbonate de sodium. »
Au jardin
Il peut être notablement employé comme fongicide, notamment pour lutter contre l'oïdium et contre l'attaque de mildiou sur les tomates et d'autres végétaux. Le bicarbonate de soude permet d’atténuer l’acidité. Une méthode consiste à pulvériser sur les feuilles un mélange de 1 cm3 de bicarbonate de sodium et 1 cm3 de savon noir dans un litre d'eau ; la surface devient moins acide et limite la capacité des spores de champignons à se développer.
L'Institut scientifique de santé publique belge conseille précisément la pulvérisation de bicarbonate de sodium simplement dilué dans de l'eau (doses et fréquences indiquées en référence) pour lutter :
- contre la tavelure du pommier[50] ;
- contre l’oïdium de la vigne[50] ;
- contre le mildiou des plantes ornementales, de la betterave rouge, de la carotte, du panais, du raifort, du radis, de la scorsonère, de l'ail, de l'oignon, de l'échalote, de la tomate, du poivron, du piment, de l'aubergine, du pepino, du concombre, du cornichon, de la courgette, du pâtisson, du melon, du potiron, de différents types de choux (brocoli, chou-fleur, de Bruxelles, pommé, chinois, pakchoï, frisé, rave, du chou-navet), du rutabaga, du navet, de la laitue, de différents types d'endives dont la racine de witloof, de la mâche, de l'épinard, de la blette, du persil, du haricot vert, de différents types de pois, de la fève, de l'asperge, de différents types de céleri, du poireau, du fenouil, de la rhubarbe, du fraisier, du framboisier, de la ronce à mûres, de différents types de groseilliers, de l'airelle canneberge, de la myrtille, de l'airelle rouge[50] ;
- contre les maladies (Penicillium italicum et Penicillium digitatum) liées au stockage de la pomme après récolte, de la poire après récolte, du cerisier et griottier après récolte, de différents types de groseilliers après récolte, de l'airelle canneberge après récolte, de la myrtille et de l'airelle rouge après récolte[50].
Usage alimentaire

Le bicarbonate de soude technique ne doit pas être consommé car il peut avoir été stocké dans des contenants potentiellement toxiques. Des traces de polluants non favorables à la santé peuvent être retrouvées dans le bicarbonate de soude qui n'est pas commercialisé avec la mention « qualité alimentaire ». La qualité « bicarbonate de soude technique » est donc réservée aux usages d'entretien de la maison, au garage ou au jardin. Ainsi, seul le bicarbonate de qualité alimentaire dont le bicarbonate de qualité pharmaceutique peuvent être consommés et utilisés également pour l'hygiène et les soins du corps[51].
- Dans l'industrie alimentaire, c'est l'additif alimentaire numéro E500(ii)[52].
- Dans la fabrication des boissons et eaux gazeuses pour son rôle de générateur potentiel de gaz carbonique.
- Il est utilisé comme agent de levuration en tant que levure chimique pour un gâteau, comme anti-agglomérant ou comme régulateur de pH[53], ainsi que comme agent gonflant dans les pâtes à crêpe, le pain ou d'autres aliments cuits au four.
- « - une cuillère à café de bicarbonate pour 500 g de farine »
- Comme élément de panure pour qu'elle reste compacte, gonflée et éviter qu'elle n'explose durant la friture ;
- Dans la cuisine traditionnelle, il est l'ingrédient de plusieurs recettes. Il est, entre autres, utilisé pour conserver leurs propriétés et leur couleur à certains légumes et légumineuses lors de la cuisson, en raison de sa réaction avec la chlorophylle pour produire la chlorophylline[54] ;
- « - une pincée dans l'eau de cuisson »

- Pour faciliter le trempage des légumes secs comme pois, haricots, etc. et/ou pour les cuire[55] ;
- « - une pincée dans l'eau de trempage »
- L'ajout de bicarbonate de sodium permet également de monter facilement des blancs en neige ;
- « - une pincée dans les blancs crus »
- Pour nettoyer les fruits et les légumes des pesticides déposés sur leur peau, le bicarbonate de sodium s'avère plus efficace que d'autres produits[56] ;
- « - trempage dans une solution de bicarbonate de soude et d'eau pendant 12 à 15 minutes ôte presque tous les pesticides »
- Le bicarbonate de sodium, associé au chlorure de calcium, peut être employé dans les procédés de reminéralisation rapide des eaux trop faiblement minéralisées ou trop pures. Néanmoins, les teneurs en chlorure de calcium doivent être limitées à une valeur inférieure à 100 mg/l pour ne pas rendre corrosives les eaux et altérer leur goût[h] ;
- Le bicarbonate de sodium et les eaux minérales qui en contiennent facilitent la digestion (voir ci-après).
Usage médical

- En médecine, il est utilisé en soluté de perfusion par voie intraveineuse, servant à l'alcalinisation des patients, notamment en cas d'acidose métabolique[57] ou de l'hyperkaliémie[58]. Le bicarbonate de sodium, acteur principal de la régulation des milieux tampons de l'organisme, constitue l'essentiel de la réserve alcaline du plasma sanguin. Sa mobilisation, par exemple en réaction face à une acidose, permet de maintenir un pH constant[57]. Sa concentration standard dans le plasma et le sang total est situé entre 22 et 26 milliéquivalents par litre.
- Pour faciliter la digestion ou procurer un soulagement aux maux d'estomac dus aux acidités gastriques[59] en tant qu'antiacide et agent alcalinisant[60]. Partant, il est efficace contre les reflux gastriques dus au stress, à un excès alimentaire ou à une alimentation grasse ou pimentée[59]. Il peut également être utilisé dans le traitement des symptômes de la maladie de l'ulcère gastro-duodénal[61]. La pharmacopée a ainsi utilisé traditionnellement le bicarbonate de sodium contre les maux d'estomac et pour calmer l'hyperchlorhydrie gastrique. Son action se traduit par une augmentation du pH du contenu de l'estomac, fournissant ainsi un soulagement des symptômes de l'hyperacidité[62]. Il était prescrit aussi pour le traitement des dyspepsies. À la Belle Époque, il est aussi considéré comme un médicament digestif, anti-acide et diurétique. La libération de CO2, de bicarbonate et de carbonate antiacides peut toutefois causer des éructations menant parfois à des nausées, une distension abdominale et de la flatulence[63].
- « - une cuillerée à café dans un verre d'eau »
- Dans le traitement de la diarrhée sévère qui est souvent accompagnée d'une perte importante de bicarbonate[64].
- En tant qu'antiprurigineux sur les zones érythémateuses ou urticariales qui peuvent suivre les piqûres d'insectes[65],[66],[67] ou de méduses[68] ;
- « - sous forme de pâte humide ou d'une solution à appliquer sur la peau (humaine ou animale) »
- Contre les callosités et les plaques rugueuses (kératose, ichtyose) de la peau, le NaHCO3 aide à adoucir la peau et à ôter les callosités[69] ;
- « - trempage des callosités dans un bain de bicarbonate de soude »
- Dans un traitement antitussif en tant qu'agent mucolytique[66][citation nécessaire] ;
- Pour le traitement de la goutte (acide urique) comme adjuvant aux médicaments[70] ;
- Selon quelques études, comme traitement de choix contre l'intoxication rénale qui résulte de dommages chimiques à la suite de l'exposition à l'uranium[71]. Ces résultats sont toutefois contestés par l'OMS qui indique que si l'administration de bicarbonate de sodium est susceptible d'être temporairement suivie d'une augmentation de l'excrétion urinaire, il n'existe aucune preuve que ces traitements s'accompagnent d'une diminution marquée de l'uranium accumulé dans les reins ou les os[72].
- Des effets positifs ont été suggérés pour ralentir la progression de maladie d'insuffisance rénale chronique (IRC ou CKD) (étude ayant exclu les personnes souffrant d'obésité morbide associée, de troubles cognitifs, de septicémie chronique, d'insuffisance cardiaque manifeste ou d'hypertension non contrôlée)[73],[74],[75]. Toutefois, ces effets n'ont pas été prouvés et le risque d'effets secondaires non souhaités est réel en cas de fortes doses[76] ;
- « - aucune automédication en la matière ; consulter un médecin »
- Dans le traitement de certaines intoxications ou empoisonnements médicamenteux (notamment aux barbituriques[64]) ou toxicologiques (cocaïne, crack…) entraînant des complications cardiaques[77] ;
- Comme antidote efficace par voie intraveineuse dans le cas de bradycardie (troubles du rythme cardiaque) induites par ISRS[78] ;
- Pour augmenter les performances physiques ou sportives chez les athlètes d'endurance[79] notamment chez les cyclistes[80] ;
- « - voir posologie[79]. » À noter que le bicarbonate de sodium n'a pas d'effet sur la pression sanguine sur certains rats déjà hypertendus ; il n'est pas hypertenseur[81].
Le bicarbonate de sodium fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013), car il entre dans la compositions des solutés par voie orale ou parentérale, notamment des solutés de réhydratation orale. Cependant les solutés bicarbonatés manquent de stabilité en conditions tropicales, et les solutés citratés (citrate de sodium) sont préférables. Le bicarbonate de sodium n'est recommandé que lorsque la fabrication des solutés est faite pour utilisation immédiate[82].
Précautions
Le bicarbonate de sodium est généralement contre-indiqué chez certains patients souffrant d'oligurie/anurie (à cause notamment d'une insuffisance rénale), d'insuffisance cardiaque avancée décompensée, présentant une alcalose métabolique ou respiratoire, atteints d'hypocalcémie chez qui l'alcalose peut induire une tétanie[76]. Le bicarbonate de sodium ne doit pas non plus être utilisé par voie orale comme antidote dans le traitement de l'ingestion d'acides minéraux forts[83].
Il doit être utilisé avec une extrême prudence chez les patients souffrant d'une insuffisance cardiaque, d'une insuffisance rénale, chez des patients recevant des corticostéroïdes ou de la corticotropine[76]. La même prudence est recommandée pour la femme enceinte ou l'enfant de moins de deux ans[76].
Lutte contre les incendies
Le bicarbonate de soude est utilisé pour éteindre un feu lorsque l'usage de l'eau est déconseillé, par exemple pour certains petits feux de friture ou de graisse[84]. Cependant, il ne doit pas être appliqué aux incendies dans les friteuses ; la libération soudaine du gaz peut causer des éclaboussures de graisse bouillante[85]. Le bicarbonate de sodium, générateur potentiel de gaz carbonique CO2, est présent dans les extincteurs d'incendie de classe B, contre les feux gras d'hydrocarbures liquides y compris l'essence, mais aussi les alcools et dérivés carbonyliques[86]. L'action d'une substance inerte, comme la terre, le sable ou le gaz carbonique, empêche le comburant d'atteindre le carburant, par étouffement du feu. On le trouve dans les liquides extincteurs, les mousses chimiques, et les poudres sèches anti-incendie.
- La réaction d'une solution aqueuse d'acide sulfurique sur une solution aqueuse de bicarbonate de sodium explique le dégagement rapide du gaz CO2, dans le liquide extincteur.
- La mousse chimique est générée par la réaction avec le sulfate d'aluminium, nécessairement en présence d'émulsifiant(s), soit :
- Al2(SO4)3 + 6 NaHCO3 poudre solide → 3 Na2SO4 + 2 Al(OH)3 + 6 CO2 gaz
La pression de projection du gaz permet une détente adiabatique de celui-ci, à effet refroidissant.
- Les poudres sèches anti-incendie sont à base de bicarbonate de sodium ou de bicarbonate de potassium. La chaleur de l'incendie permet de décomposer les composés cités légèrement impurs, à traces acides, mais stables à température ordinaire. Il se produit un dégagement d'eau vapeur et de gaz carbonique au contact du foyer ou de ses abords chauds. Les poudres bien répandues génèrent un effet de souffle, contrant la propagation de l'incendie.
Autres utilisations
- Également utilisé dans la production agricole de la spiruline[87], par le développement de carbone.
- Anodisation de l'aluminium[88].
- Purification des fumées.
- Carburant propulsif pour fusée ludo-pédagogique lorsqu'il est mélangé avec du vinaigre.
- Agent de traitement anti-acariens.
- En modélisme, il est utilisé pour simuler de la neige en le mélangeant à de la colle PVA (colle à bois).
- Pour transformer la cocaïne en sa forme solide, le crack, elle est mélangée à du bicarbonate de sodium (baking soda) puis chauffée.
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.