Chikungunya
maladie infectieuse tropicale De Wikipédia, l'encyclopédie libre
Le chikungunya (en abrégé, le chik), est une maladie infectieuse tropicale provoquée par le virus du chikungunya (CHIKV), un arbovirus du genre Alphavirus, famille des Togaviridae. Elle est transmise par des moustiques du genre Aedes. Le nom est d'origine makondée[1] et signifie : « qui se recourbe, qui se recroqueville », à l'image des feuilles tombées des arbres qui se recourbent en séchant ; la traduction de chikungunya en français signifie « maladie qui brise les os » ou « maladie de l'homme courbé » car elle occasionne de très fortes douleurs articulaires associées à une raideur, ce qui donne aux patients infectés une attitude courbée très caractéristique.
Chikungunya
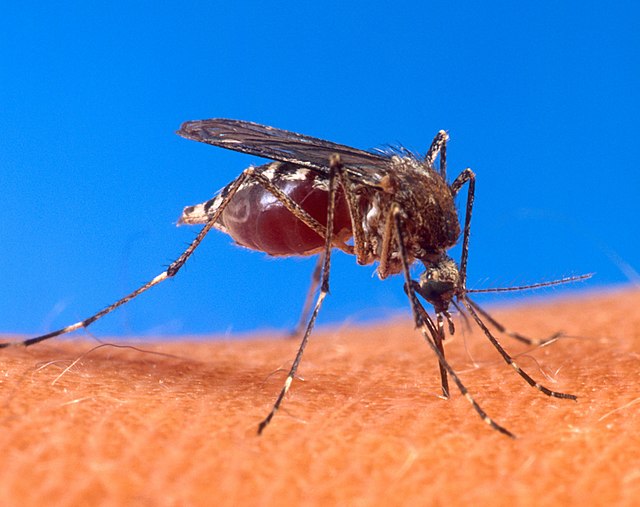
Moustique (Aedes aegypti) responsable de la propagation du chikungunya, piquant un individu.
| Causes | Chikungunya virus |
|---|---|
| Transmission | Transmission par les moustiques (d) |
| Incubation min | 3 j |
| Incubation max | 12 j |
| Symptômes | Fièvre, nausée, myalgie, exanthème, arthralgie, céphalée, fatigue, conjonctivite et trouble neurologique |
| Traitement | Soins de support (d) |
|---|---|
| Médicament | Anti-inflammatoire non stéroïdien |
| Spécialité | Infectiologie |
| CISP-2 | A78 |
|---|---|
| CIM-10 | A92.0 |
| CIM-9 | 065.4, 066.3 |
| DiseasesDB | 32213 |
| MeSH | D018354 |
La transmission du virus d'un humain malade à un moustique se fait par le sang aspiré lors de la piqûre. La contamination d'un homme sain est réalisée par la salive de moustiques qui ont été infectés quelques jours ou quelques semaines auparavant. Seuls les moustiques femelles piquent. Plusieurs espèces de moustiques sont susceptibles de transmettre le chikungunya, mais seules Aedes aegypti et Aedes albopictus ont été à ce jour identifiées comme vecteurs épidémiques, à cause de leur adaptation aux zones d'habitat humain. Ces mêmes espèces sont également impliquées dans la transmission d'autres arbovirus : virus de la dengue (incluant la fièvre dengue hémorragique - DHF), virus de la fièvre jaune, etc.
Un virus, des réservoirs, des vecteurs, des récepteurs humains
Résumé
Contexte
Le virus

Il s’agit d’un arbovirus (alphavirus à ARN thermosensible de la famille des Togaviridae). Il est proche du virus O'nyong-nyong et comprend deux types génétiques, un situé en Afrique occidentale, l'autre en Afrique orientale et du sud[2]. Il est possible que la mutation sur un gène codant une protéine de l'enveloppe virale puisse modifier le caractère infectant du moustique vecteur et expliquer, en partie, la grande dissémination au cours des années 2000[3]. Le génome du virus isolé à La Réunion a été séquencé, il contient 14 500 nucléotides et dérive de la souche africaine.
Après amplification sur cellules de moustique, qui le multiplient très efficacement en plusieurs dizaines de millions de particules virales par millilitre de surnageant de culture, le virus a été analysé par microscopie électronique, par la technique de coloration négative. Sa taille est de 70 nanomètres, il a une forme ronde, on peut distinguer sa capside entourée d'une enveloppe (Institut Pasteur Paris). Les virus à ARN possèdent des polymérases « peu fiables », elles commettent de nombreuses erreurs de transcription car elles sont dépourvues de système de correction[4]. Cela est à l’origine de nombreuses variations ou mutations, ce qui permet au virus de s'adapter et d'évoluer plus rapidement. In vitro, sa croissance est inhibée par la chloroquine[réf. nécessaire] dont les effets anti-viraux avaient déjà été démontrées sur le virus Sindbis[réf. nécessaire] dans les années 1980. Il est également sensible à la ribavirine et à l’interféron, mais dans une moindre mesure[réf. nécessaire].
Les alphavirus comprennent 28 virus, dont les virus Chikungunya, O’Nyong Nyong, Ross River, Sindbis, Mayaro. Tous les arbovirus connus appartiennent à cinq familles de virus. Il y a 537 arbovirus et apparentés recensés (1996, source Institut Pasteur), dont 168 en Afrique, 91 en Amérique du Nord et 137 en Amérique du Sud. Environ cent dix d’entre eux sont pathogènes pour l’homme et responsables d’autant d’arboviroses humaines. Une quarantaine d’entre eux est cause de maladies animales identifiées.
Le cycle du virus
Comme chez la majorité des espèces culicidiennes, seule la femelle est hématophage (c'est-à-dire qu'elle doit se nourrir de sang pour assurer le développement de ses ovaires et de ses œufs) et donc capable de transmettre le chikungunya. Cette capacité « vectorielle » de la femelle Aedes s’explique par une faculté à dupliquer le virus (et non pas par la quantité de sang absorbé, bien insuffisante). Et contrairement aux idées reçues, ce n’est pas en absorbant le sang mais juste avant, en injectant un peu de salive anticoagulante et anesthésiante dans un vaisseau sanguin de sa victime, que le moustique infecte l'hôte. Les mâles étant des suceurs de sève d'herbacées ou de nectars de fruit, ils sont donc démunis de pièces buccales capables de transpercer la peau des vertébrés.
Un moustique femelle s’infecte en piquant un humain ou un animal contaminé. Le sang traverse ensuite la frontière stomacale de l’animal. L'Aedes femelle ne sera alors infectante qu'après plusieurs jours de développement du virus dans son corps jusqu'à ce qu'il arrive aux glandes salivaires. La femelle devenue infectante le reste toute sa vie, soit environ un mois. Or, elle pique et pond tous les quatre jours environ. Sept à huit transmissions du virus par le moustique sont donc possibles avec contamination d'autant de personnes. Une femelle Aedes pond environ 300 œufs au cours de son existence.
Il existe une transmission verticale du virus de la femelle infectée à ses œufs, c’est-à-dire que les œufs pondus par une femelle infectée sont contaminés, cependant dans une très faible proportion (1 à 2 %), et donc sans répercussion réelle sur la transmission de la maladie.
La transmission directe du virus d'homme à homme n’a jamais été observée. La transmission est dite indirecte car elle nécessite la présence d'un moustique vecteur : Stegomyia albopicta ou St. aegypti essentiellement. Côtoyer des « chikungunyés » ne présente pas de risque direct, y compris si ceux-ci sont piqués par des Aedes qui se gorgent ainsi de leur sang riche en virus, car ceux-ci ne deviendront infectants que plusieurs jours après leur repas de sang. Il existe une transmission in utero du virus de la mère à l'enfant (une quarantaine de cas ont été décrits en 2005-2006 à La Réunion). Le chikungunya peut alors induire des lésions neurologiques graves chez le fœtus, pouvant entraîner son décès in utero au cours du second trimestre (3 cas à La Réunion). Mais le risque essentiel est constitué par l'accouchement en période virémique, c’est-à-dire pendant que la future maman est malade du chikungunya. Dans la moitié des cas, l'enfant est alors contaminé par le virus et fait une encéphalite dans 10 % des cas.
Le réservoir non-humain est constitué de primates et de petits mammifères[5].
Le réservoir
En Afrique et en Asie, il est principalement représenté par les singes et d’autres vertébrés. D’autres espèces peuvent être infectées, notamment l’humain.
Dans l’océan Indien, plusieurs réservoirs animaux ont été suspectés : singes macaques (île Maurice), lémuriens et chauves-souris (Mayotte, Madagascar) et sont en cours[Quand ?] d’investigation (programmes EntomoChik et AniChik). Deux campagnes de prélèvements biologiques ont été menées. Les premiers résultats ne montrent pas de présence virale (PCR) chez l’animal (l’étude a débuté après le pic épidémique), par contre toutes les espèces étudiées sauvages ou domestiques présentent dans plus de la moitié des cas, des anticorps spécifiques, témoignant d’un contact avec le virus.
En ce qui concerne le réservoir animal, citons P. Brémont[réf. nécessaire], de l’UR 892 Virologie immunologie moléculaire : « La question d’un potentiel réservoir animal pour le Chikungunya a été peu abordée et seules quelques hypothèses ont été avancées. La raison principale de cette méconnaissance est que jusqu’à aujourd’hui les études menées sur le Chikungunya ont été réalisées en condition épidémique, et donc en situation où homme et faune sauvage sont nécessairement séroconvertis. Les espèces animales pour lesquelles une analyse sérologique a établi la présence du vCHIK sont le singe Macaca Fascicularis aux Philippines[6] et en Malaisie[7]. À noter dans cette étude une prévalence du virus Getah (Alphavirus du même groupe que vCHIK) chez le porc domestique. Toujours chez le singe, prévalence du vCHIK dans l’espèce Cercopithecus Aethiop Pygerythrus en Afrique du Sud[8]. Les orang-outans à Bornéo semblent également constituer des porteurs sains du vCHIK ou même d’autres arboviroses[9]. Une étude basée sur des infections expérimentales de souris montre que les oiseaux tels que l’hirondelle Hirundo Rustica ou le moineau Passer domesticus peuvent constituer des réservoirs potentiels[10] via l’infestation par des ectoparasites nidicoles. Concernant les oiseaux migrateurs, une étude réalisée en Russie[11] montre qu’un grand nombre d’espèces sont séropositives pour les arboviroses, incluant le Chikungunya. Les espèces recensées sont Sterna Hirundo, Egretta garzetta, Larus malanocephalus, Streptopelia Turtus, Ardea cinerea, Ardeola ralloides, Larus ridibundus et Nycticorax nycticorus. Une étude menée au Sénégal[12] semble également confirmer le rôle important des oiseaux migrateurs comme vecteur potentiel des arboviroses, et en particulier pour le Chikungunya. Le cheval peut également constituer un potentiel réservoir pour le vCHIK mais aussi pour beaucoup d’autres arboviroses[13]. Une description de tiques de la famille des Ixodidae les propose comme potentiel réservoir pour le vCHIK[14]. C’est la seule description de ce type. Les tiques examinées étaient principalement Amblyomma variegatum, Boophilus et Rhipicephalus. Les données sont parcellaires, souvent obtenues en phase de crise épidémique et donc peu favorables à une analyse claire de la question des réservoirs animaux. De toute évidence, des recherches actives doivent être menées pour identifier de façon plus fiable l’existence d’un réservoir animal pour le Chikungunya, en dehors bien entendu de l’homme lui-même. »
Les vecteurs

Diverses espèces de moustiques, telles que Aedes (Diceromyia) furcifer, Aedes (Diceromyia) taylori, Aedes africanus, Aedes luteocephalus (en), Aedes (Stegomyia) albopictus et Aedes (Stegomyia) aegypti sont les vecteurs du virus du chikungunya. Quelques cas de contaminations sanguines existent toutefois dans la littérature médicale. Ils sont extrêmement rares et concernent du personnel soignant qui s’est involontairement inoculé le virus.
Stegomyia albopicta ne pond que dans l’eau stagnante, préférentiellement à l’ombre. L'œuf résiste à la dessiccation et survit en absence d'eau, n'éclosant qu'à la remise en eau de son lieu de ponte. En France, l'œuf de Stegomyia albopicta entre en diapause dans le courant de l'automne et n'éclora qu'au printemps.
Il ne faut pas limiter la lutte anti-moustiques au seul contrôle des adultes. Il est plus simple et efficace d'éliminer les gîtes larvaires, que de courir derrière autant de moustiques adultes et donc volants.
En septembre 2013, des chercheurs de l'IRD (Institut de Recherche pour le Développement) ont découvert à Mayotte une nouvelle espèce de moustique, Stegomyia pia, soupçonnée de transmettre également ces arbovirus[15].
Tableau clinique classique de l’adulte
Résumé
Contexte
Le chikungunya est une arbovirose classée algo-éruptive avec un syndrome similaire à celui de la dengue, classiquement décrite comme bénigne, d’évolution aiguë ou sub-aiguë.
Après une incubation de 4 à 7 jours en moyenne (mais qui pourrait être comprise entre 1 et 12 jours, selon la littérature[5]), apparaît brutalement une fièvre élevée accompagnée d’arthralgies qui peuvent être intenses touchant principalement les extrémités des membres (poignets, chevilles, phalanges), mais également le rachis et qui peuvent confiner le patient en position couchée paralytique pendant plusieurs heures. L'atteinte articulaire est, en général, bilatérale, atteignant plusieurs cibles : doigts, poignets, coudes, orteils, genoux… Les douleurs sont fréquemment décrites comme atroces et « poussant au suicide ». Surviennent également des myalgies (douleurs musculaires), des céphalées et une éruption maculo-papuleuse dans plus de la moitié des cas. Des hémorragies bénignes à type de gingivorragies sont observées, surtout chez les enfants. Enfin, il existe des infections asymptomatiques et l’immunité acquise paraît précoce et durable.
L’évolution clinique est variable. Elle peut être rapidement favorable, le malade répondant bien au traitement symptomatique, mais la maladie peut aussi évoluer vers une phase chronique marquée par des arthralgies persistantes, incapacitantes, erratiques, symétriques ou non, causes de dépression. Une phase matinale de dérouillage parfois longue (une demi-heure à une heure) est parfois nécessaire avant le démarrage des activités. D’autres signes sont décrits à La Réunion : agueusie, sensation de vives brûlures de la plante des pieds, gênant la marche…
Pendant la convalescence qui peut durer plusieurs semaines, le malade est en proie à une asthénie importante et souvent à des arthropathies (atteinte des articulations) douloureuses et invalidantes. Si la maladie est réputée bénigne et très souvent inapparente, ont été notées à La Réunion des formes plus graves non décrites dans la littérature médicale.
Les enfants ne présentent que rarement ces douleurs articulaires. Chez eux le chikungunya se traduit comme une simple grippe.
L'éruption est présente essentiellement sur le torse, les jambes et la face, de type maculo-papulaire (ressemblant à celle de la rougeole) mais d'autres formes sont possibles[16].
Des syndromes digestifs sont présents dans près de la moitié des cas[17] : douleurs abdominales, diarrhée…
Environ 10 % des cas sont asymptomatiques (ne présentant aucun signe et découverts uniquement sur des arguments biologiques)[18].
Complications chez l’adulte et le nouveau-né
Résumé
Contexte
Formes douloureuses persistantes et récurrentes
Des symptômes persistent chez plus de 80 % des personnes infectées à 3 mois, chez 57 % à 15 mois et chez 47 % à 24 mois[19].
Chez plus de la moitié des personnes infectées, les douleurs articulaires peuvent persister ou réapparaître pendant plusieurs mois, voire plus d'un an, notamment aux articulations fragilisées (anciennes entorses ou fractures chez des sportifs, rhumatisme ou arthrose préexistente par exemple), chez les personnes les plus âgées et celles dont les manifestations initiales ont été les plus importantes[20]. Cette prolongation des symptômes pourrait être secondaire à la persistance du virus et du syndrome inflammatoire[21]. De même, une fatigue peut se poursuivre au-delà d'un an[22].
Personnes fragilisées par d’autres maladies
Une attention particulière doit toutefois être portée aux personnes fragiles : les nourrissons dont les douleurs peuvent bloquer la mâchoire et rendre impossible toute alimentation, les personnes âgées aux défaillances d'organes particulièrement sensibles aux effets de la fièvre (accélération de la fréquence cardiaque, déshydratation). Sont particulièrement exposées à ces risques secondaires à toute fièvre les personnes atteintes de diabète, insuffisance cardiaque, rénale, respiratoire… Les alcooliques chroniques atteints de chikungunya ont présenté des risques accrus d'hépatite mortelle.
Les cas graves nécessitent d’être hospitalisés en service de réanimation[23],[24].
Atteintes neurologiques et cardiaques
Des cas d'encéphalites[25], des syndromes de Guillain-Barré[26], de paralysie[27] et des myocardites[28] ont été décrits.
Transmission materno-fœtale
La transmission materno-fœtale d'arbovirus est connue pour le virus West Nile[29]. Le virus de l’encéphalite équine est et nord-américaine (depuis 1953 et 1959) le virus Getah chez les mammifères. À La Réunion, une étude sur toutes les naissances depuis fin septembre 2005 recense 151 infections par le chikungunya de femmes enceintes, au-delà de 22 semaines d’aménorrhée, sur 3 192 grossesses (5 %), dont 33 infections per-partum. Dix-huit nouveau-nés ont été infectés sur ces 33 derniers cas (54 %). Les cas observés se situent lors de l’accouchement en période virémique avec transmission du virus au nouveau-né. Une cinquantaine de nouveau-nés ont été ainsi contaminés à La Réunion[30],[31], dont certains présentent des séquelles neurologiques[32]. L’infection est apparue de J3 à J7 après la naissance, avec des manifestations neurologiques, une thrombopénie, avec 70 % de PCR positive, 50 % de nouveau-nés symptomatiques et pas d’admission en réanimation pour méningo-encéphalites néonatales[33]. D’importantes lésions sont visualisées en IRM. Il n’a pas été observé à ce jour de malformations physiques. La césarienne ne semble pas avoir une action protectrice vis-à-vis de l’infection de l’enfant, sauf en cas de lésions bulleuses vulvaires chez la mère. Il s’agit d’une transmission per partum, les cellules placentaires étant infectées.
En matière d’allaitement maternel, et bien que les premières études n’aient pas permis de retrouver le virus dans le lait, il est préconisé par principe de précaution pendant la période de virémie, de tirer le lait et de le porter à ébullition ou de le jeter transitoirement.
Taux de mortalité
Le taux de mortalité moyen est, selon l'Agence de la santé publique du Canada, évalué à « 0,4 % (2,8 % chez les enfants et 1,6 % chez les personnes âgées) »[34]. La Haute Autorité de santé, dans un document de janvier 2013, mentionne que la « mortalité du chikungunya est estimée à 1 pour 1000 »[35].
Diagnostic et physiopathologie
Résumé
Contexte
Diagnostic différentiel
Les premiers symptômes peuvent faire penser à une crise de paludisme ou de grippe, ou de leptospirose, ou à une septicémie, une méningite, etc. Le chikungunya est une maladie qui présente des similitudes avec la dengue : douleurs musculaires et articulaires, forte fièvre, maux de tête, éruption sur la peau…
Biologie
La virémie, c’est-à-dire la période de présence du virus dans le sang et donc de transmission possible, s’étale pendant cette période pendant laquelle le génome viral peut être mis en évidence dans l'organisme par RT-PCR. Les anticorps immunoglobulines M (IgM) apparaissent vers le 5e jour de la maladie et persistent plusieurs mois. Les IgM sont assez peu spécifiques et des faux positifs sont dus à des mécanismes de stimulation polyclonale par d'autres maladies infectieuses. Puis, apparaissent les IgG à partir du 15e jour, qui durant plusieurs années, voire décennies, sont spécifiques du chikungunya (anticorps dirigés contre les protéines de la membrane du virus) et protecteurs. L’immunité est donc estimée acquise à vie, ce qui signifie en l'état actuel des connaissances qu'une personne ayant eu le chikungunya ne peut être atteinte une deuxième fois.
Physiopathologie
En 2013, a été mis en évidence un facteur cellulaire humain impliqué dans la réplication du virus qui rend compte de la spécificité d’espèce de ce virus[36]. Ainsi sont précisées les bases moléculaires de l’infection par le virus Chikungunya.
Précautions et traitement
Résumé
Contexte
Traitement préventif

La protection individuelle s'appuie sur le port de vêtements longs et clairs et l'usage de lotions répulsives tôt le matin et en fin de journée, mais celles-ci ont une durée d'efficacité limitée (4 à 8 heures selon les produits), la moustiquaire imprégnée de répulsifs, la pose de grillages sur les ouvertures des maisons. En raison de la très forte virémie pendant la maladie (jusqu'à 1012 copies de virus par millilitre de sang chez le malade pendant la première semaine de la maladie), il faut également insister sur la nécessité d'isoler les malades (confinement à domicile, répulsifs…), afin de limiter la propagation de la maladie via les moustiques. En effet, en période épidémique, c'est l'homme malade qui constitue le réservoir principal de virus et qui contribue donc au développement ultérieur de l'épidémie.
Outre la lutte individuelle contre les piqûres de moustique, la seule véritable prévention à ce jour[37] consiste donc à combattre la reproduction et la prolifération des moustiques par élimination des gîtes larvaires d'eau stagnante par exemple les vases des cimetières, les bâches des piscines, les récipients abandonnés, les gouttières, les pneus entreposés à l'extérieur, les déchets. Aedes albopictus, moustique vecteur du chikungunya est très lié aux activités humaines.
Le chikungunya fait partie de la liste des maladies à déclaration obligatoire en France métropolitaine, aux Antilles, dans le Pacifique français, et à la Réunion depuis le 19 décembre 2008[38]. Il ne suffit pas de se protéger soi-même, il faut aussi penser à la communauté. Il existe pour ce faire un dispositif de surveillance à l'INVS et un site consacré au signalement des moustiques tigres observés en métropole[39].
Vaccination
Un vaccin expérimental a été développé par le United States Army Medical Research Institute of Infectious Diseases (en)[40]. La souche vaccinale (souche thaïlandaise datant de 1962 atténuée par passages successifs sur cellule Vero de singes), a été cédée par l'Institut de recherche de l'armée des États-Unis à l'INSERM, mais n’a pu être requalifiée en raison de l’impossibilité de satisfaire aux exigences actuelles en matière de produits sanitaires en France[réf. nécessaire] et a donc été abandonnée[41]. Plusieurs équipes travaillent sur d’autres candidats vaccins :
- juin 2014 : candidat vaccin français développé par l’Institut Pasteur[42],[43] en utilisant le vaccin de la rougeole comme support. Un premier essai clinique sur l’homme, mené en 2013 sur 42 volontaires sains par la société autrichienne Themis Bioscience qui a acheté la licence, a démontré son innocuité et « sa capacité à induire une immunité sur le long terme », selon le Pr Philippe Desprès qui a participé à l'élaboration du vaccin mis au point par l'équipe de génomique virale et vaccination dirigée par Frédéric Tangy. Ce candidat vaccin va désormais devoir être testé en zone endémique. Les recherches portent également sur un vaccin pédiatrique qui pourrait être utilisée dès l'âge de 9 mois ;
- août 2014 : un candidat vaccin américain[44] à pseudo-particules virales (VLP) a été testé sur 25 volontaires sains ayant reçu trois injections du vaccin, dans le cadre d'un essai clinique de phase 1, c’est-à-dire destiné à tester l’innocuité du vaccin. Les volontaires ont pour la plupart d’entre eux développé une réponse immunitaire dès la première injection avec une bonne tolérance vaccinale. Après la seconde injection, tous ont développé d’importants niveaux d'anticorps. « Onze mois après la vaccination, les niveaux d’anticorps étaient comparables à ceux observés chez des personnes ayant récupéré après une infection par le chikungunya, ce qui semble indiquer que le vaccin VLP pourrait assurer une protection à long terme contre le virus[réf. souhaitée] », selon le Dr Julie Ledgerwood du National Institute of Health américain ;
- Scott C. Weaver, Université du Texas, et son équipe ont publié en janvier 2014, dans la revue Journal of Infectious Diseases, l'existence d'un vaccin efficace en une seule dose chez le macaque, qui avait été fabriqué à partir d'un virus du chikungunya génétiquement très atténué[45] ;
- les Suédois de l'Institut Karolinska, alliés à des chercheurs français, ont publié avec la même approche, un vaccin qui protège les souris dans la revue Journal of Virology[46] ;
- une équipe espagnole et une équipe néerlandaise ont fait état de résultats prometteurs chez la souris avec un vaccin composé de particules formées par des protéines du virus produites en masse[47],[48].
Premier vaccin commercialisé
En juillet 2021, la FDA américaine accorde le statut de « breakthrough therapy » au vaccin VLA1553 développé par le laboratoire franco-autrichien Valneva SE. Un mois plus tard, l'étude pivot de phase III annonce un taux d'efficacité de 98,9% pour ce candidat vaccin[49]. En novembre 2023, le vaccin est autorisé à la mise sur le marché par la Food and Drug Administration (FDA), et par l'European Medicines Agency (EMA) en juin 2024[50]. Commercialisé sous le nom de « Ixchiq », il s'agit du premier vaccin au monde. Ce vaccin est destiné aux personnes de 18 ans et plus qui ont un risque accru d'être exposées au virus[51].
Traitement curatif
Il n’existe pas de traitement anti-viral spécifique et le traitement reste donc purement symptomatique.
Ex vivo, la chloroquine (Nivaquine) s'est montrée efficace sur le virus mais pas in vivo chez l'être humain[52] lors des essais cliniques menés à La Réunion en fin d’épidémie de 2006 en population générale. Le traitement à la chloroquine sur l'humain a montré un effet paradoxal en augmentant l’infection au virus du chikungunya[53]. La chloroquine s’est également montrée inefficace sur le modèle animal (Macaca fascicularis) testé au CEA.
En 2014, le traitement reste donc uniquement symptomatique : antalgiques non salicylés, dont le paracétamol puis les anti-inflammatoires non stéroïdiens dans le respect des contre-indications (enfant de moins de trois mois, grossesse), corticoïdes à doses rapidement dégressives dans les formes chroniques invalidantes, avec parfois rebond en deçà d’un certain seuil. Les formes rhumatismales chroniques invalidantes répondent au traitement par méthotrexate ou aux anti-TNF alpha.
Traitement en milieu de réanimation pour les formes les plus graves : ventilation mécanique, épuration extra-rénale, amines pressives.
La ribavirine est un médicament anti-viral et semble réduire l'importance ou la durée des manifestations de l'infection[54]. L'interféron-alpha possède une activité antivirale in vitro[55] mais n'a pas été testé chez l'être humain.
Historique
Résumé
Contexte
Premiers cas identifiés en Afrique en 1952
Le chikungunya n’est pas une maladie nouvelle. Le virus a été isolé pour la première fois en 1952-1953 lors d'une épidémie de fièvre qui sévissait sur le plateau du Makonde dans la province de Newala au Tanganyika (actuelle Tanzanie)[56] mais il est possible que quelques épidémies de dengue soient en réalité conséquence du CHIKV[57]. La maladie est responsable d'affections sévissant sous forme endémique en zones rurales d'Afrique subtropicale, et sous forme épidémique dans des populations immunologiquement naïves, en particulier urbaines, aussi bien en Afrique qu'en Asie du sud (Inde, Viêt Nam).
Epidémies suspectées de chikungunya antérieures à 1952
Des épidémies de chikungunya antérieures à 1952 ont pu être identifiées rétrospectivement à la lumière des connaissances actuelles de la maladie. Ainsi, Carey a avancé que certaines épidémies attribuées au virus de la dengue, étaient en fait des épidémies de chikungunya : Le Caire et Batavia-Jakarta en 1779, Zanzibar en 1823 et 1870, l'Inde en 1823, 1824-1825 et 1871-1872, Hong Kong, la Birmanie (actuel Myanmar) et Madras en 1901-1902. La réattribution rétrospective de ces épidémies au virus chikungunya repose d'une part sur la coexistence des virus de la dengue et du chikungunya dans ces régions, et d'autre part sur les descriptions faisant état de douleurs articulaires et de complications à type d'arthrite plus compatibles avec une fièvre chikungunya qu'avec une dengue.
Le tableau clinique évocateur avait déjà été documenté, dominé par une fièvre élevée comme celle de la dengue (dengue et chikungunya ont souvent été confondues) associée à des douleurs articulaires invalidantes et parfois une éruption cutanée. Mais il y a des formes sévères ignorées jusque-là : des hépatites fulminantes, des attaques du muscle cardiaque, des méningo-encéphalites… De nombreux autres togavirus du genre alphavirus et appartenant au complexe de la Semliki Forest, comme Ross River, O'nyong-nyong, Sindbis et Mayaro sont associés à des symptômes similaires[58].
Foyers asiatiques et africains
Deux principaux foyers de chikungunya sont dénombrés : l’un asiatique, qui frappe régulièrement Java, l’Asie du sud-est (Thaïlande, Vietnam, Birmanie, Malaisie, Laos et Cambodge), et l'Inde (près de 1,3 million de personnes infectées[59]), l’autre africain. l’Institut de veille sanitaire (InVS), a publié un bilan épidémiologique mondial[60] sur le Chikungunya (Bilan à fin 2011-Mise à jour juin 2012). Ce bilan reprend notamment une synthèse sur les épidémies documentées en Afrique, dans l’océan indien et le sous-continent indien, et en Asie du sud-est.
Épidémie de chikungunya à La Réunion en 2005, puis en 2009 et 2010
Le Centre national de référence sur les arbovirus de l'Institut Pasteur a identifié dès le mois de mai 2005 le virus à La Réunion. Le premier cas y a été enregistré le . Fin novembre, 4 500 personnes étaient contaminées. En date d'avril 2006, le virus du chikungunya infectait plus de 244 000 personnes, soit un tiers de la population de l’île, avec 203 décès[61], avec près de 120 000 nouveaux cas rien que pour le début de l'année 2006. Le vecteur principal identifié est Aedes albopictus.
La Réunion n’a d’ailleurs pas été la seule île touchée dans cette région. Le chikungunya a fait son apparition aux Comores en juillet 2004. Le nord de Madagascar, Maurice, les Seychelles et Mayotte, avec plus de 5 000 cas officiellement déclarés, ne sont pas épargnés, même si les médias s'en font peu l'écho (si les chiffres annoncés à la Réunion sont proches de la réalité, de sérieux doutes peuvent être émis concernant les 4 autres régions précitées). Les maladies importées dépassent les 1 000 cas[62] entraînant un risque de dissémination s'il existe un insecte vecteur. En , trois nouveaux cas sont identifiés à Saint-Gilles-les-Bains sur l'île de la Réunion[63]. Par la suite, l’année 2010 a été marquée par la résurgence du chikungunya à La Réunion avec le premier foyer d’importance depuis 2006 (150 cas).
Épidémie dans les départements français d’Amérique en 2014
Le chikungunya s’est implanté dans les départements français d’Amérique, aux Antilles à la fin 2013, avec des cas autochtones[64]. Les premiers cas ont été identifiés à Saint-Martin, l’Institut de veille sanitaire (InVS) commence à éditer des bulletins hebdomadaires sur la situation épidémiologique du chikungunya dans les Antilles à partir du 11 décembre 2013 (les bulletins sont archivés sur le site de l’InVS[65]). L’InVS a placé successivement en phase épidémique Saint-Martin dès le 6 décembre 2013, puis la Martinique le 23 janvier 2014 et enfin la Guadeloupe le 19 avril 2014[66],[67],[68]. La Guyane a été placée en situation de circulation autochtone modérée le 19 février 2014. La répartition est la suivante selon un point de l’Institut de veille sanitaire (InVS) au 28 juillet 2014[69],[70] :
- Guyane : 881 cas probables ou confirmés depuis la mi-décembre 2013 et jusqu’au 13 juillet 2014 ; la situation épidémiologique correspond à la phase 2b du programme de surveillance d'alerte et de gestion des épidémies (Psage) : transmission autochtone modérée avec foyers épidémiques et chaînes de transmission localisées ;
- Guadeloupe : 69 740 cas cliniquement évocateurs depuis la mi-décembre 2013 et jusqu’au 13 juillet 2014, intensification de l’épidémie en Guadeloupe à partir de la fin du mois de mai. 7 décès ont été enregistrés parmi les cas biologiquement confirmés hospitalisés dont un seul classé comme directement lié au chikungunya. La Guadeloupe est en phase 3b du Psage : épidémie généralisée avec une tendance à la stabilité sur les dernières semaines.
- Martinique : 52 560 cas cliniquement évocateurs. 19 décès indirectement liés à l’infection ont été enregistrés parmi les patients hospitalisés avec une confirmation biologique. D’autre part, 16 certificats de décès avec mention chikungunya dans l’une des causes de décès ont été comptabilisés pour des personnes décédées à domicile ou en maison de retraite. La Martinique est en phase 3b du Psage : épidémie généralisée avec une tendance à la stabilité voire à la baisse qui reste à confirmer au cours des prochaines semaines.
- Saint-Martin : 3 760 cas cliniquement évocateurs, trois décès, tous indirectement liés au chikungunya. Saint-Martin est en phase 2 du Psage : transmission virale modérée ;
- Saint-Barthélémy : 800 cas cliniquement évocateurs. Saint Barthélemy est en phase 2 du Psage : transmission virale modérée ;
- Polynésie française : 1 cas importé déclaré le 29 mai 2014[71]. La Polynésie avait déjà connu une épidémie de dengue et de zika au cours des mois précédents. L'épidémie prend de l'ampleur et le bureau de veille sanitaire de Polynésie annonce le 14 novembre que plus de 5 000 cas sont déjà répertoriés et que l'épidémie ne fait que commencer[72]. Le 21 novembre, les autorités locales annoncent les deux premiers décès à la suite de l'épidémie[73]. L'épidémie s'étend très rapidement : le 1er décembre, l'autorité sanitaire polynésienne annonce que 18 352 cas ont été recensés[74].
Généralisation de l'épidémie à l’ensemble du continent américain

La situation épidémiologique dans les îles non françaises des caraïbes communiquée par la PAHO (Pan American Health Organization) et les autorités sanitaires locales pour la semaine 1430 (21 au 27 juillet 2014) fait apparaître une situation épidémique établie en Haïti, en République Dominicaine, ainsi qu’à la Dominique. Une situation épidémique émergente est suspectée à Porto Rico avec 241 cas autochtones recensés et une situation réelle probablement pire. La quasi-totalité des autres îles des petites et des grandes Antilles a connu des cas importés et redoute l'établissement d'une épidémie.
Le 22 juillet 2014, le premier cas autochtone a officiellement été déclaré aux États-Unis, avec déjà 79 cas confirmés en laboratoire en Floride, 302 sur l’ensemble du territoire des États-Unis, et de nombreux cas évocateurs. Les inquiétudes liées au développement d'une épidémie ont conduit les autorités à ajouter le chikungunya à la liste des maladies à déclaration obligatoire[75].
La situation épidémiologique en Amérique centrale, du nord et du sud communiquée par la PAHO et les autorités sanitaires locales pour la semaine 1430 (21 au 27 juillet 2014) plaçait la quasi-totalité des pays d'Amérique centrale et d'Amérique du Sud comme désormais concernés par des cas importés de chikungunya. La liste des pays avec des cas autochtones s’allonge : le Salvador compte déjà 1 969 cas locaux recensés[réf. nécessaire], après la Guyane, le Suriname, le Guyana, le Venezuela et même la Colombie[76] sont désormais concernés par des cas locaux. Présence de moustiques vecteurs (Aedes albopictus et Aedes aegypti), multiplication des cas importés et des cas locaux, tous les ingrédients sont là pour alimenter les craintes d'une épidémie s'étendant à tout l’ensemble du continent américain.
Présence du virus chikungunya en France en Europe
Le premier foyer européen est identifié durant l'été 2007. Le 30 août 2007, les autorités sanitaires italiennes informent leurs homologues européennes qu’une centaine de cas d’infection à virus chikungunya sont à déplorer dans le nord-est de l'Italie (district de Ravenne, région d'Émilie-Romagne), information relayée par le ministère français de la Santé[77],[78]. À ce stade, le nombre de nouveaux cas hebdomadaires décroît selon ces mêmes autorités.
Des cas de chikungunya autochtones, c’est-à-dire acquis sur place et non importés ont été pour la première fois détectée sur le territoire métropolitain français le 25 septembre 2010, dans le Var[79]. Un deuxième cas a été détecté, le lendemain, à Fréjus, toujours dans le Var[80].
Multiplication des cas importés, risque d’épidémie en France en 2014 à la suite de l'épidémie dans les départements français d'Amérique
Selon l’InVS, aucun cas autochtone n'a encore été confirmé en juillet 2014, mais le nombre important de cas importés de chikungunya en France métropolitaine représente un défi pour la surveillance et l’intervention. « Pendant l'été 2014, toutes les conditions sont réunies pour une transmission autochtone du virus du chikungunya » dans les 18 départements du sud de la France métropolitaine pour une transmission du virus du chikungunya et, dans une moindre mesure, du virus de la dengue : « un vecteur compétent, Aedes albopictus, et un grand nombre de voyageurs revenant des départements français d’Amérique où sévit une épidémie de chikungunya »[81]. La France est le pays le plus touché avec 475 cas importés entre le 1er novembre 2013 et juillet 2014, dont 126 biologiquement confirmés du 1er mai au 4 juillet 2014 dans les 18 départements de France métropolitaine colonisée par Ae. albopictus et placés en surveillance renforcée (2 avaient été biologiquement confirmés en 2011 et 6 en 2012 sur la même période). Un plan anti-dissémination du chikungunya et de la dengue en métropole a été mis en place le 29 avril 2014[82]. Pendant l’été 2014, période d’activité du moustique en métropole, un grand nombre de voyageurs en provenance des Antilles va venir en France métropolitaine. Certains de ces voyageurs pourraient être en phase virémique au moment de leur arrivée, augmentant la probabilité de survenue de cas autochtones de chikungunya dans les départements colonisés par Stegomyia albopicta et rendant ainsi réel le risque d’épidémie de chikungunya en France métropolitaine ». Les services de santé espèrent « éviter l'instauration d'un cycle de transmission autochtone du chikungunya en France métropolitaine et, au-delà, dans d'autres zones en Europe où des vecteurs compétents sont également présents ».
De nombreux cas de chikungunya importé en Europe en 2014
L’Espagne, l’Italie, la Suisse et l’Allemagne commencent pendant l’été à compter en dizaines le nombre de cas importés.
Coût d’une épidémie de chikungunya
L’épidémie réunionnaise a permis de mieux cerner le coût d’une épidémie[83]. La Caisse générale de Sécurité sociale de la Réunion a relevé une augmentation de 6,5 % des dépenses de l’Assurance Maladie en 2006 par rapport à 2005. Dans une étude parue en 2011, les coûts directs et indirects de l’épidémie de chikungunya de 2005-2006 sont estimés à 43,9 millions €, soit 117 € par patient externe et 2 000 € par patient hospitalisé (coût moyen : 1 370 €). Soixante pour cent des coûts sont directement attribués aux frais médicaux (consultations, hospitalisations, tests biologiques et médicaments). L’absentéisme attribué à l’épidémie a été évalué à 112 400 journées de travail de 12 800 sujets soit un coût de 17,4 millions €. Cependant, cette étude n’a pas pris en compte les dépenses liées aux manifestations tardives et chroniques de la maladie et les conséquences économiques indirectes de l’épidémie : fléchissement du tourisme, de la restauration et de l’hôtellerie, des activités… Néanmoins, cette étude permet d'éclairer sur le rapport coût-bénéfice des programmes de surveillance, de prévention et de contrôle des arboviroses.
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.