Acide rhodizonique
composé chimique De Wikipédia, l'encyclopédie libre
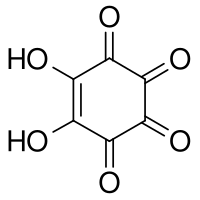
L'acide rhodizonique est un composé organique de formule brute C6H2O6 ou (CO)4(COH)2. il peut être vu comme le double énol du cyclohexène tétra cétone.
| Acide rhodizonique | |
| |
| Identification | |
|---|---|
| Nom UICPA | 5,6-dihydroxycyclohex-5-ène-1,2,3,4-tétrone |
| Synonymes |
dihydroxydiquinoyl |
| No CAS | |
| No ECHA | 100.003.888 |
| No CE | 204-276-5 |
| PubChem | 67050 |
| SMILES | |
| InChI | |
| Apparence | aiguilles cristallines orange foncé[1] |
| Propriétés chimiques | |
| Formule | C6H2O6 [Isomères] |
| Masse molaire[2] | 170,076 5 ± 0,006 7 g/mol C 42,37 %, H 1,19 %, O 56,44 %, |
| Propriétés physiques | |
| T° fusion | 248 °C (dihydrate,décomposition)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
L'acide rhodizonique est habituellement sous la forme d'un dihydrate, C6H2O6·2H2O de numéro CAS . En fait, ce dihydrate est la 2,3,5,5,6,6-hexahydroxycyclohex-2-ène-1,4-dione de masse molaire 206,107 ± 0,007 6 g·mol-1 (C 34,96 %, H 2,93 %, O 62,1 %) dans laquelle deux groupes cétone de l'acide sont remplacés par deux paires d'hydroxyles géminaux (précurseur de cétal). L'acide anhydre, orange à rouge foncé et très hygroscopique peut être obtenu par sublimation du dihydrate à basse pression[4],[5].
Comme beaucoup d'autres alcools énoliques, l'acide rhodizonique est acide et peut donc perdre des ions H+. Les constantes d'acidité de l'acide rhodizonique anhydre ne peuvent être mesurées mais sont évaluées à pKa1 < 2 et pKa2<4,72[4]. En solution dans l'eau, ces pKa sont pKa1 = 4,378 ± 0.009 et pKa2 = 4,652 ± 0.014 à 25 °C[6] formant l'anion hydrogénorhodizonate, C6HO6− et le dianion rhodizonate, C6O62−. Ce dernier est aromatique et symétrique, la double liaison et les deux charges négatives sont délocalisées sur les six unités CO.
L'acide rhodizonique a été utilisé pour des tests chimiques du baryum, du plomb et d'autres métaux[7]. En particulier, un test au rhodizonate de sodium peut être utilisé pour détecter les résidus de tir d'armes à feu (qui contiennent du plomb) sur les mains d'un sujet[8] et de distinguer des blessures de flèches de blessures par balle pour l'application la réglementation de la chasse[9].
Histoire
L'acide rhodizonique a été découvert par le chimiste autrichien Johann Heller (en) en 1837 en analysant les produits d'un mélange chauffé de carbonate de potassium, K2CO3 et de charbon, C[10]. Pendant un temps, la formule des rhodizonates a été considérée comme étant C7O7· Me3[11]. Le nom vient du grec ῥοδίζω, rhodizō, « teinter de rouge » en référence à la couleur de ses sels[12].
Sels
Résumé
Contexte
Les rhodizonates ont tendance à être de diverses nuances de rouge, du jaune au pourpre en lumière transmise, avec un lustre verdâtre en lumière réfléchie. En solution, les anions rhodizonate ne sont pas hydratés[6].
Le rhodizonate de potassium peut être préparé avec un bon rendement et une bonne pureté par oxydation d'inositol avec de l'acide nitrique et de traiter le résultat avec l'acétate de potassium en présence d'oxygène. Le rhodizonate cristallise de la solution en raison de sa relative insolubilité dans l'eau[13]. L'acide rhodizonique peut également être obtenu par trimérisation de glyoxal en présence de cyanures catalytiques[1].
Dans le rhodizonate de rubidium anhydre, Rb+2(C6O6)2−, les anions rhodizonates sont empilés en colonnes parallèles ainsi que les ions rubidium. Dans les plans perpendiculaires aux colonnes, Ils sont disposés en deux grilles hexagonales intercalées. Les anions sont plans[5]. Le rhodizonate de potassium anhydre, K+2(C6O6)2− a une structure distincte mais néanmoins similaire. Les anions et cations sont arrangés dans des plans alternés. Dans chaque plan, les anions sont arrangés en une grille hexagonale. Chaque ion K+ est agencé de sorte qu'il se connecte de façon symétrique à huit atomes d'oxygène de quatre anions, deux dans chaque plan adjacent. Les anions ont légèrement la forme "bateau" avec une déviation standard de 10,8 pm (0,108 Å) du plan moyen[14].
Le rhodizonate de sodium, Na+2(C6O6)2− est brun foncé et est stable quand il est sec[15], mais ses solutions aqueuses se décomposent en quelques jours même mises au réfrigérateur[7]. Ce sel a une structure identique au sel de potassium mais les anions rhodizonates sont un peu plus distordus (11,3 pm du plan moyen)[16].
le rhodizonate de lithium ainsi que ses sels de tétrahydroxybenzoquinone (THBQ) et de benzènehexol, ont été considérés comme possiblement utilisables dans des batteries électriques rechargeables[17].
Oxydation et décomposition
L'acide rhodizonique est un membre de la chaîne de produits d'oxydation : benzènehexol (COH)6, tétrahydroxybenzoquinone (THBQ) (COH)4(CO)2, acide rhodizonique (COH)2(CO)4 et cyclohexanehexone (CO)6[7].
L'anion monovalent C6O6− a été détecté dans des expériences de spectrométrie de masse[19].
L'acide rhodizonique et les anions rhodizonate peuvent perdre un groupement CO pour former de l'acide croconique, (CO)3(COH)2 ou respectivement des anions croconate, C5O52− par un mécanisme qui n'est pas encore parfaitement connu. En solution basique à pH > 10, l'acide rhodizonique se convertit rapidement en anion THBQ4−, (CO)64− en absence d'oxygène ou en croconate en sa présence. À pH 8,3 et exposition à la lumière, les solutions sont stables plusieurs jours en l'absence d'oxygène mais en sa présence, elles se décomposent en croconate et en d'autres produits (incluant possiblement la cyclohexanehexone ou le dodécahydroxycyclohexane)[20],[21].
Notes
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
