Loading AI tools
Un acide aminé non protéinogène est un acide aminé qui ne peut pas être incorporé dans les protéines lors de la traduction de l'ARN messager par les ribosomes. De tels acides aminés peuvent malgré tout être présents dans les protéines, mais dans ce cas ils se forment à partir de résidus d'acides aminés protéinogènes par modification post-traductionnelle ; ils peuvent également ne jamais se trouver dans des protéines et remplir d'autres fonctions physiologiques au sein des cellules. On connaît environ 500 acides aminés différents, définis simplement comme des acides carboxyliques portant également une fonction amine, tandis qu'on ne connaît que 22 acides aminés protéinogènes — 23 si l'on considère que la N-formylméthionine en fait partie — ce qui signifie que la grande majorité des acides aminés sont non protéinogènes.
On connaît environ 140 acides aminés différents constitutifs des protéines[1]. Ils résultent de modifications post-traductionnelles de résidus d'acides aminés protéinogènes incorporés dans les protéines par les ribosomes. En voici quelques exemples :
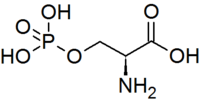
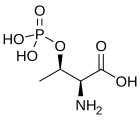
- La phosphorylation de la sérine, la thréonine et la tyrosine en O-phosphosérine, O-phosphothréonine et O-phosphotyrosine est un mécanisme courant de régulation de l'activité physiologique des protéines et des enzymes.
- La carboxylation du glutamate en γ-carboxyglutamate intervient dans les protéines impliquées dans la coagulation sanguine en favorisant les interactions avec les cations de calcium Ca2+. La carboxylation de la lysine donne l'acide diaminopimélique, indispensable à la paroi bactérienne comme constituant du peptidoglycane.
- L'hydroxylation de la proline et de la lysine en hydroxyproline et hydroxylysine intervient dans le collagène. L'hydroxyproline est présente également dans la paroi cellulaire des oomycètes. D'autres hydroxyprolines existent également, comme la 3,4-dihydroxyproline présente dans la paroi cellulaire des diatomées[2], chez lesquelles elle pourrait jouer un rôle dans la formation de dépôts de silice. L'aspartate peut également être hydroxylé, pour donner du 3-hydroxyaspartate.
- L'acétylation de la lysine en N-ε-acétyllysine intervient sur les histones pour en moduler la liaison à l'ADN dans les nucléosomes, ce qui a d'importantes implications en épigénétique, c'est-à-dire dans la modulation de l'expression génétique.
- La méthylation de la lysine en différentes méthyllysines est un autre mécanisme épigénétique, semblable et complémentaire à celui de l'acétylation.
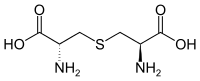
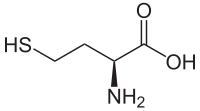
- La réduction de deux molécules de cystéine donne une molécule de cystine ; cela se traduit, dans les protéines, par la formation de ponts disulfure, qui renforcent et stabilisent la structure tridimensionnelle de certaines protéines.
- La déshydratation d'une molécule de sérine donne la déshydroalanine, présente dans certains peptides courts de micro-organismes et qui peut également s'observer dans la caséine après chauffage ou traitement alcalin à l'hydroxyde de sodium (soude caustique).
- L'addition d'une molécule de cystéine et d'une molécule de déshydroalanine donne la lanthionine, présente dans certaines parois bactériennes.
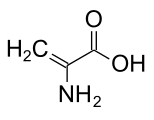
- Déshydroalanine
(acide 2-aminoacrylique)
Un grand nombre d'acides aminés assurent des fonctions métaboliques et physiologiques variées. Ils peuvent ainsi intervenir comme :
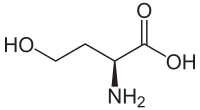
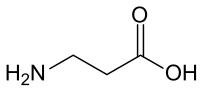
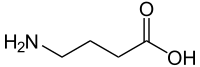
- Intermédiaires du métabolisme : ornithine, citrulline, argininosuccinate, homosérine, homocystéine, acide cystéine-sulfinique, acide 2-aminomuconique, acide δ-aminolévulinique, β-alanine, acide para-aminobenzoïque, cystathionine, etc.
- Hormones : hormones thyroïdiennes
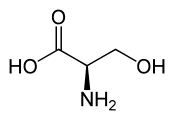
- Neurotransmetteurs : γ-aminobutyrate, DOPA (précurseur de la dopamine, de l'adrénaline et de la noradrénaline), 5-hydroxytryptophane (précurseur de la sérotonine), D-sérine (neuromodulateur).
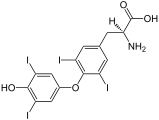
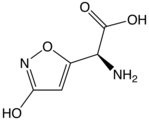
- Toxines : acide iboténique, acide azétidine-2-carboxylique, acide domoïque, acide djenkolique, etc.
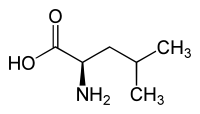
- Peptides non ribosomiques : α-aminobutyrate, 2-aminoisobutyrate, D-leucine, D-valine, dont peptidoglycane : acide diaminopimélique, D-alanine, D-glutamate.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.