Loading AI tools
ac/fa De Wikipédia, l'encyclopédie libre
La fibrillation atriale, anciennement appelée fibrillation auriculaire (fréquemment abrégée en « FA ») est le plus fréquent des troubles du rythme cardiaque. Elle fait partie des troubles du rythme supra-ventriculaires.
| Symptômes | ES PC DE Angor |
|---|---|
| Complications | IC AVC |
| Risques | HA Valvulopathie Coronaropathie CMO CMNO congénital Tabac SAS |
| Différentiel | Arythmie autre |
|---|---|
| Traitement | Contrôle Fréquence ou rythme |
| Médicament | Métoprolol, Coumaphène, disopyramide, dofetilide (en), diltiazem, procaïnamide, ibutilide, digoxine, deslanoside (en), quinidine, digitoxine, aténolol, sotalol, (RS)-propafenone, vérapamil, Fondaparinux, atenolol/chlorthalidone (en), clopidogrel, dabigatran, édoxaban, étexilate de Dabigatran (d), amiodarone, dronédarone, bisoprolol / hydrochlorothiazide (d), rivaroxaban, carvedilol, apixaban, flécaïnide, acide acétylsalicylique, hydrochlorure de vanoxérine (d) et indobufen sodium (d) |
| Spécialité | Cardiologie |
| Fréquence | ~2,5% pays "développés" |
|---|
| CISP-2 | K78 |
|---|---|
| CIM-10 | I48 |
| CIM-9 | 427.31 |
| DiseasesDB | 1065 |
| MedlinePlus | 000184 |
| eMedicine |
151066 emerg/46 |
| MeSH | D001281 |
| Patient UK | Atrial-fibrillation-pro |
Elle correspond à une action non coordonnée des cellules myocardiques auriculaires, entraînant une contraction rapide et irrégulière des oreillettes cardiaques.
Le terme de fibrillation auriculaire est d'usage fréquent, mais depuis 1998 la dénomination académique est « fibrillation atriale », les oreillettes cardiaques ayant été renommées « atria » dans la nouvelle nomenclature anatomique[1]. D'autres appellations sont également rencontrées : arythmie complète par fibrillation auriculaire (AC/FA ou ACFA) et parfois tachy-arythmie complète par fibrillation auriculaire (TAC/FA).
La fibrillation atriale est parfois dénommée par abus de langage « arythmie » ; cependant ce terme est synonyme de « trouble du rythme », notion plus large, qui inclut en conséquence la fibrillation atriale.
En raison de son développement rapide, lié au vieillissement de la population (pour sa forme non valvulaire), elle est parfois considérée comme l'une des grandes épidémies du troisième âge et du nouveau millénaire (avec par exemple plus de 660 000 personnes concernées en France)[2],[3]. Cette arythmie est devenue la plus courante rencontrée en pratique clinique. Son incidence et sa prévalence n'ont cessé d'augmenter depuis quelques décennies, parallèlement à l'obésité (aussi vite et similaire en fréquence), et en partie pour des raisons encore en 2020 mal comprises. Souvent peu symptomatique chez les personnes âgées et peut-être sous-détectée[4], elle est source d'un « poids croissant sur la morbidité et la mortalité cardiovasculaires »[5].
La fibrillation auriculaire a été décrite pour la première fois chez l'homme en 1906, à la suite de l'observation d'un syndrome analogue chez l'animal[6], et cela sans utilisation de l'électrocardiogramme, outil de diagnostic encore inexistant. Willem Einthoven, l'inventeur de l'électrocardiogramme, publie le premier tracé de fibrillation la même année[7]. Le caractère commun des syndromes initialement observés est reconnu dès 1909[8].
On parle de fibrillation atriale[9] :
On distingue également les fibrillations atriales valvulaires des personnes ayant une valvulopathie de celles qui en sont indemnes.
La fibrillation atriale subclinique est une forme dépistée par des enregistreurs électrocardiographiques de longue durée (moniteur cardiaque implantable ou stimulateur cardiaque), avec des durées variables et le plus souvent asymptomatique[10].
C'est le trouble du rythme cardiaque le plus fréquent, en particulier chez l'adulte âgé.
L'incidence et la prévalence de la FA augmentent considérablement avec l'âge[11],[12] :
Plusieurs pathologies cardiaques peuvent être associées à la survenue de la fibrillation auriculaire :
En dehors des pathologies cardiaques, on recherchera systématiquement les circonstances pathologiques, aiguës ou chronique, favorisant la survenue du syndrome : l'hyperthyroïdie, l'embolie pulmonaire, la consommation d'alcool aiguë ou chronique, l'apnée du sommeil, une infection aiguë (sepsis), anomalies ioniques, etc.[14],[15].
La prise de certains stupéfiants (cocaïne et crack), de certains médicaments (tous les neuro-excitants, sympathomimétiques), la prise de traitements contre le rhume, la prise de théophylline (pour l'asthme) ou d'acide zolédronique (traitement adjuvant de certains cancers ou encore de l'ostéoporose).
On sait également que la présence d'un bloc auriculo-ventriculaire du premier degré multiplie par quatre le risque de survenue d'une fibrillation auriculaire[16].
Il existe enfin des facteurs génétiques prédisposant à la fibrillation atriale[17]. Plusieurs gènes, indépendamment de ceux qui sont directement facteurs de pathologies cardiaques, ont été identifiés comme étant des facteurs indépendants de risque de fibrillation atriale : mutation sur le gène du peptide natriurétique auriculaire[18], gène SCN5A[19], gène KCNH2[20], gène MYL4[21] ou mutation sur un locus du chromosome 4q25[22],[23].
Le rôle du tabagisme est discuté, l'augmentation du risque de fibrillation atriale semblant faible[24].
Les cardiologues du sport connaissent enfin par ailleurs l'existence d'épisodes de FA paroxystique associés à un habitus d'entraînement intense et très régulier en endurance (cyclistes, marathoniens, skieurs de fond…). Ce contexte particulier multiplierait le risque de FA spontanée par deux ou trois :
La contraction cardiaque normale procède d'une dépolarisation (inversion de la polarité électrique de la membrane cellulaire) cyclique d'un groupe de cellules situé au niveau de la partie haute de l'oreillette droite et constituant le nœud sinusal (ou nœud sino-atrial - NSA). Cette dépolarisation se propage très rapidement (en moins d'un dixième de seconde), de haut en bas et de proche en proche, à l'ensemble des cellules des deux oreillettes, déclenchant leur contraction quasi synchrone, ainsi qu'en direction du nœud atrioventriculaire (NAV). L'activation du NAV par les potentiels d'action issus de l'oreillette déclenchera à son tour la contraction des deux ventricules, mais de façon légèrement retardée relativement à celle des oreillettes. Pour mémoire, la contraction des oreillettes permet un surcroît de remplissage des ventricules (de l'ordre de 20 à 30 % selon l'âge du sujet), juste avant la systole : c'est la phase dite de remplissage actif.
Lors de la phase d'initiation de la fibrillation auriculaire (FA), des rétro-boucles du courant de dépolarisation (circuits dit de réentrée) apparaissent, lesquelles vont venir réexciter de façon précoce des fibres musculaires sortant juste de leur période réfractaire, générant alors une activation électrique inappropriée et désynchronisée de ces fibres. La généralisation de ce mécanisme à l'ensemble du tissu auriculaire conduira alors à la fibrillation des oreillettes. L'activation du NAV par des trains de potentiels d'action désynchronisés se fera alors de façon anarchique, le NAV transmettant alors aux ventricules une onde de dépolarisation (via le faisceau de His) de fréquence très irrégulière et le plus souvent anormalement rapide (mais pas toujours) : c'est le classique phénomène de tachyarythmie. Dans ce phénomène d'initiation de la FA, on incrimine également l'intervention de foyers dits ectopiques, centres d'hyperexcitabilité à fréquence de décharge très rapide. Ces foyers ectopiques peuvent se localiser à de nombreux endroits différents des oreillettes, mais principalement au niveau des orifices des veines pulmonaires dans l'oreillette gauche. Ces deux types de mécanismes pourraient agir de façon plus ou moins synergique dans le phénomène déclenchant la fibrillation. Enfin, une anomalie primitive ou secondaire — c.-à-d. à une affection aiguë ou chronique par exemple — des fibres des oreillettes, caractérisées alors par un raccourcissement pathologique de leur période réfractaire, va encore accentuer le mécanisme de réentrée décrit précédemment. À cet égard il a été montré par de nombreux auteurs que, en cas de fibrillation auriculaire permanente, la période réfractaire des fibres auriculaires a « naturellement » tendance à se raccourcir progressivement, remodelage tissulaire permanent qui va contribuer par lui-même à pérenniser l'état de fibrillation. La vocation naturelle de la FA est donc de s'autorenforcer dans une sorte de « cercle vicieux ». On dit que « la FA entraîne la FA », de sorte que si le traitement médical ne réussit pas rapidement à réduire l'état de fibrillation (par traitement médicamenteux), passé un certain délai la cardioversion devient difficilement réalisable, quels que seront alors les moyens électriques ou pharmacologiques mis en œuvre[28].
Cette disparition de la synchronisation de contraction des fibres musculaires auriculaires a deux types de conséquences ou risques :
| Conduction | ||
Rythme sinusal  |
Fibrillation auriculaire 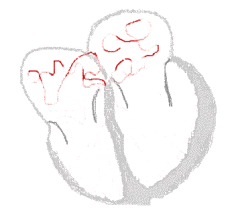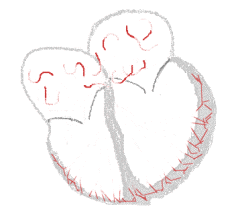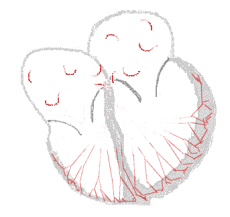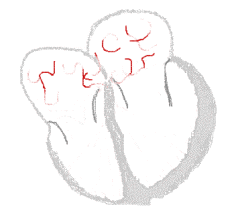 | |
La survenue d'un état de fibrillation atriale est globalement favorisée :
Lors d'une fibrillation auriculaire, la fréquence auriculaire peut atteindre les 300 battements par minute. Du fait de la présence du nœud atrioventriculaire, l'intégralité du signal électrique auriculaire se voit filtrée, entraînant ainsi une limitation marquée de la fréquence cardiaque ventriculaire de base. Le ventricule bat alors à une fréquence bien moindre que les oreillettes, même s'il reste assez rapide, permettant ainsi le plus souvent, grâce au traitement médicamenteux associé, une bonne tolérance de la pathologie par le patient (au repos notamment).
Le patient peut être totalement asymptomatique et la fibrillation découverte au cours d'un électrocardiogramme systématique ou réalisé pour une tout autre raison.

Cet examen est nécessaire pour poser le diagnostic. On note l'absence d'activité auriculaire organisée avec disparition des ondes P au profit d'une trémulation de la ligne iso-électrique. La fréquence ventriculaire (QRS) est irrégulière. Les QRS sont fins (sauf bloc de branche préexistant). L'électrocardiogramme permet également dans certains cas d'orienter vers certaines causes.
Le diagnostic est parfois moins aisé puisqu'une étude de 2007 montre que les logiciels d'interprétation automatisée de l'ECG ignorent ce diagnostic dans près de 20 % des cas[29].
Le diagnostic peut être fait également sur un enregistrement électrocardiographique prolongé (holter cardiaque).
L'aspect peut parfois être confondu avec celui d'une flutter atrial ou d'une tachycardie atriale, surtout si la conduction auriculo-ventriculaire est irrégulière. Si l'arythmie est rapide et régulière, la ligne iso-électrique n'est pas visible et un diagnostic de tachycardie jonctionnelle peut-être donc être avancé de façon erronée. Il est important alors d'avoir un tracé de durée suffisante afin de démasquer les irrégularités signant la fibrillation. Dans les rares cas litigieux, une injection d'adénosine triphosphate permet de bloquer transitoirement le nœud auriculo-ventriculaire, permettant ainsi de démasquer les oscillations irrégulières de la ligne de base, signant la fibrillation auriculaire.
L'échocardiographie permet de visualiser le cœur et ses cavités par technique ultrasonore. Elle permet ainsi de rechercher la cause d'une arythmie et d'en évaluer le retentissement sur le muscle cardiaque :
Au minimum :
Examens supplémentaires à faire au besoin :
La fibrillation auriculaire est généralement contrôlée par un traitement adapté. Cependant, sa tendance « naturelle » est d'évoluer vers la chronicité : de paroxystique devenant progressivement persistante, puis permanente. Cet état chronique est potentiellement à la source de multiples complications possibles, entraînant un taux de mortalité plus élevé[4].
Le pronostic des formes paroxystiques et des formes non paroxystiques reste discuté : les recommandations américaines stipulent que le risque thromboembolique est identique dans les deux formes[31] mais certaines données montrent le caractère plus péjoratif des formes non paroxystiques[32].
Elle a fait l'objet de plusieurs publications de recommandations : la dernière version européenne date de 2024[33] et celle américaine, de 2023[34].
L'éviction de certains excitants (alcool et caféine) peut assez souvent contribuer à espacer les crises paroxystiques. Le régime méditerranéen associé à une supplémentation en huile d'olive pourrait réduire le risque de survenue de ce trouble rythmique[35]. Le traitement médical repose sur plusieurs points :
Elle consiste en un retour à un rythme normal dit sinusal. Elle est également appelée cardioversion.
Elle peut être obtenue par l'administration de médicaments ou par choc électrique externe. En cas de fibrillation auriculaire de moins de 48 h, elle peut être tentée d'emblée, sans précaution particulière[36]. Si la date de début est inconnue ou plus ancienne, elle doit être précédée d'une mise sous traitement anticoagulant efficace pendant au minimum 3 semaines, ou après échographie transœsophagienne de contrôle destinée à vérifier l'absence de thrombus constitué dans les oreillettes.
La cardioversion apparaît d'autant plus rentable sur le plan médical que la fibrillation est récente, datant de moins de six mois[37]. Le risque de récidive à court terme de la FA apparaît en effet d'autant plus limité que l'état de fibrillation a été très court et contrôlé d'emblée, qu'il n'y a pas eu préalablement de tentatives répétées et infructueuses de réduction et bien sûr qu'il n'y a aucune notion d'un état cardiaque pathologique déjà ancien.
La réduction médicamenteuse peut être réalisée par l'administration d'anti-arythmiques de type amiodarone ou flécaïnide, par voie orale ou par voie intraveineuse. Dans certains cas, cette réduction peut être faite par le patient lui-même en ambulatoire (sans hospitalisation), par la prise orale d'une dose unique d'un anti-arythmique dès l'apparition des symptômes[38] (pill-in-the-pocket approach).
La réduction électrique (défibrillation) se fait sous anesthésie générale brève, par délivrance d'un choc électrique de courte durée au niveau de la poitrine du patient. Il ne doit pas y avoir de surdosage en digitaliques éventuellement prescrits lors de la réalisation du choc.
Après réduction, il s'effectue par la prescription de médicaments anti-arythmiques par voie orale (exemples de molécules utilisables : amiodarone, dronédarone[39], propafénone, disopyramide, sotalol (bêta-bloqueur à effet stabilisant de membrane - ASM), flécaïnide et quinidine). Le taux de récidives reste cependant élevé.
La prescription d'un traitement médicamenteux anti-arythmique n'est pas obligatoire s'il s'agit d'une première crise, de résolution rapide, avec une tolérance correcte et l'absence de maladie cardiaque sous-jacente.
La perte de poids (chez l'obèse) permet de diminuer substantiellement le risque de récidive[40]. De même, l'exercice physique contribue à stabiliser le rythme[41].
Lorsque les tentatives de réduction se sont soldées par un échec, ou qu'il y a une contre-indication à la réduction, on se contentera de ralentir le rythme cardiaque afin d'éviter l'apparition de symptômes invalidants et d'une mauvaise tolérance cardiaque. Se contenter du ralentissement de l'arythmie, serait plus efficace, en termes de durées d'hospitalisations et de mortalité, que d'essayer de régulariser le rythme ou d'empêcher la récidive du trouble rythmique[42]. De même, en cas d'insuffisance cardiaque, une attitude agressive visant à réduire la fibrillation et à maintenir le rythme sinusal par des moyens médicamenteux ne semblait pas supérieure en termes de morbi-mortalité et d'évolution dans le temps au regard d'une attitude se contentant de ralentir et contrôler la fréquence cardiaque[43]. Pourtant en 2020, l'étude Européenne EAST de P. Kirchhof et al NEJM (1er septembre 2020) apporte un nouvel éclairage. Elle démontre que l'attitude agressive visant à réduire la fibrillation et à maintenir le rythme sinusal par des moyens médicamenteux réduit de manière significative les causes de morbi-mortalité avec une réduction de 21% des évènements cardiaques graves avec baisse de 28 % de la mortalité cardiovasculaire et de 35% de survenance d’un accident vasculaire cérébral[44].
Des médicaments tels que les bêta-bloquants, les inhibiteurs calciques bradycardisants (diltiazem et vérapamil), ainsi que la digoxine — et dans une moindre mesure l’amiodarone, en raison de ses multiples effets secondaires à long terme — peuvent être utilisés.
L'objectif est de maintenir la fréquence cardiaque de repos à moins de 80 battements par minute, mais un contrôle moins strict (fréquence de repos inférieure à 110/min) semble tout aussi efficace[45].
En cas d'échec, il est possible de réaliser une « déconnexion » entre les oreillettes et les ventricules cardiaques par une technique de radio-fréquence qui va détruire le faisceau de His. Cette méthode nécessite la mise en place d'un stimulateur cardiaque définitif.
L'un des risques de la fibrillation atriale est la formation d'un caillot dans l'atrium gauche, avec le risque de migration et d'accident embolique. Le but du traitement anticoagulant oral est de diminuer ce risque.
Lorsque le traitement anticoagulant est instauré dans le cadre de la prévention des accidents thrombo-emboliques cérébraux, il n'est pas nécessaire d'organiser un relais avec une héparine (héparine non fractionnée), à la différence du traitement de la maladie thromboembolique veineuse (phlébite ou embolie pulmonaire)[46].
En règle générale, le traitement anticoagulant est poursuivi au moins un mois après la réduction puis arrêté si l'arythmie a disparu, qu'il existe une forte probabilité pour qu'elle ne récidive pas et que le score de risque embolique est faible. Si l'arythmie persiste ou si le maintien en rythme sinusal semble aléatoire (fibrillation auriculaire paroxystique), le maintien de l'anticoagulation doit être discuté selon le risque estimé de complication thrombo-embolique. En 2001 a été créé dans ce but le score CHADS2[47], initiales de « Cardiac insufficiency » (insuffisance cardiaque), « Hypertension », « Âge » (supérieur à 75 ans), « Diabète » et « Stroke » (antécédent d'accident vasculaire-cérébral). La présence de chaque item compte pour un point, sauf pour le dernier (accident neurologique), comptant pour deux points (expliquant le « 2 » du nom du score). Ce score est corrélé avec le risque de complications thrombotiques. Ce score a été complété en 2010, appelé CHA2DS2-VASc, comportant en plus d'autres critères : le sexe féminin, la présence d'une maladie vasculaire et un âge intermédiaire (entre 65-75 ans)[48]. En pratique, un score à 1 ou à 0 indique un score faible et l'absence de nécessité d'un traitement anticoagulant[9]. En cas, de valvulopathie mitrale significative (rétrécissement mitral ou insuffisance mitrale), le risque thrombotique est élevé, quel que soit le score CHADS2 et le traitement anticoagulant est indiqué. Le risque varie également en fonction du type de fibrillation : il est plus important si cette dernière est permanente ou persistante que si elle est seulement paroxystique[49],[50]. De même, il n'est pas clair si le risque se majore au-delà d'un seuil (« charge en fibrillation atriale ») ou si cette augmentation du risque est continue avec la durée de l'arythmie[51]. En deçà de 24 h de durée de l'arythmie, la prise d'un anticoagulant oral semble plus délétère (risque hémorragique sans bénéfice sur les accidents cardio-vasculaires, dont les accidents vasculaires cérébraux)[52].
Dans certains cas, le risque du traitement anticoagulant apparaît plus élevé que le bénéfice attendu ; on préfère alors utiliser les antiagrégants plaquettaires : essentiellement l'aspirine. Cette dernière molécule a démontré une certaine efficacité dans la prévention des accidents emboliques, mais à un degré sensiblement moindre que le traitement anticoagulant[53]. L'ajout de clopidogrel diminue significativement le risque vasculaire mais majore le risque hémorragique[54]. Le dabigatran, a une efficacité au moins comparable aux antivitamines K et un risque de saignement moindre[55]. D'autres molécules, de la classe des inhibiteurs du facteur Xa comme le rivaroxaban[56] et l'apixaban[57] ont des résultats équivalents ou supérieurs. Ces médicaments présentent l'avantage de ne pas nécessiter de surveillance régulière de l'INR par prélèvements sanguin répétés. Leurs inconvénients sont l'absence d'antidote (mais ils sont cours d'élaboration) en cas de saignement (mais la demi-vie courte des molécules considérées limite en principe ce risque) ainsi que leur coût non négligeable.
Historiquement les Antagoniste de la vitamine K étaient les médicaments de choix. Ils nécessitent une surveillance régulière de leur dosage par des prises de sang et imposent certaines mesures diététiques. Ils tendent à être remplacés par les Anticoagulants oraux directs. Le dabigatran, a une efficacité au moins comparable aux antivitamines K et un risque de saignement moindre[55]. D'autres molécules, de la classe des inhibiteurs du facteur Xa comme le rivaroxaban[56] et l'apixaban[57] ont des résultats équivalents ou supérieurs. Ces médicaments présentent l'avantage de ne pas nécessiter de surveillance régulière de l'INR par prélèvements sanguin répétés. Leurs inconvénients sont l'absence d'antidote (mais ils sont cours d'élaboration) en cas de saignement (mais la demi-vie courte des molécules considérées limite en principe ce risque) ainsi que leur coût non négligeable.
L'un des problèmes essentiels de ce type de traitement, quel qu'il soit, est l'estimation empirique du risque hémorragique. Il peut être aidé par le calcul d'un score HAS-BLED[58] reposant sur plusieurs critères : hypertension artérielle non contrôlée (1), insuffisance rénale (1) ou hépatique (1), antécédent d'accident vasculaire cérébral (1), antécédent de saignement(1), INR instable(1), âge supérieur à 65 ans, consommation de médicaments(1) ou d'alcool(1). Ce score est 9. C'est un acronyme de l'anglais « Hypertension, Abnormal renal or hepatic fonction, Stroke, Bleeding, Labile INR, Eldery, Drugs or alcohol ». On note toutefois que certains critères de risque hémorragiques sont les mêmes que ceux de risque d'accident embolique. Un score HAS-BLED élevé ne contre-indique pas la prescription d'AVK, tout dépend de la balance bénéfice risque. Les patients avec un score HAS-BLED élevé doivent être surveillés de manière plus rapprochée s'ils sont traités.
Une alternative, en cas de contre-indication aux anticoagulants, est la fermeture de l'auricule gauche, petite poche en cul-de-sac de l'oreillette gauche où se constituent le plus fréquemment les thrombus[59]. Cette technique est réalisée par cathétérisme transeptal (passage dans l'oreillette gauche en traversant le septum interauriculaire), sous scopie et contrôle par échographie transœsophagienne chez un patient sous anesthésie générale. Elle conduit à la mise en place d'un dispositif permettant d'occlure l'auricule. Elle donne des résultats équivalents aux antivitamines K[60].
Si une cause a été déterminée, le traitement de cette dernière, lorsqu'elle est possible, est souvent le moyen le plus simple de traiter l'arythmie de manière définitive : traitement d'une hyperthyroïdie, chirurgie valvulaire…
La plupart des fibrillations auriculaires proviennent de foyers d'activation situés au niveau de l'arrivée des veines pulmonaires dans l'oreillette gauche[61] : l'isolement électrique des veines pulmonaires par voie endocavitaire (ablation par radio-fréquence) permet de diminuer très sensiblement le risque de récidive par rapport au traitement anti-arythmique classique[62] et est pratiqué dès la fin des années 1990[63]. Il s'agit cependant d'une technique longue et complexe (nécessitant de passer un cathéter spécial dans l'oreillette gauche en passant à travers le septum inter-auriculaire : cathétérisme trans-septal), avec un risque de complications d'un peu plus de 5 %[63] avec, essentiellement, des rétrécissements des veines pulmonaires et des épanchements péricardiques compressifs (tamponnade). Le risque embolique reste controversé après la procédure et il est généralement recommandé la poursuite des anticoagulants pendant quelques mois[64]. Enfin, la récidive de l'arythmie est une éventualité fréquente, même à long terme, pouvant conduire à une nouvelle intervention. Il n'est donc pas possible, dans ces conditions, de parler de « guérison »[65].
Ces techniques, sont pour l'instant, essentiellement utilisées en cas de fibrillation auriculaire récidivante et mal tolérée malgré un traitement anti-arythmique optimal[66]. Elles peuvent cependant être discutées en 1re intention dans certains cas (AC/FA paroxystique sur cœur sain, notamment chez le sujet sportif, ou cardiomyopathie rythmique[9]). Son utilisation en cas d'insuffisance cardiaque semble se révéler plus intéressante pour le confort des patients concernés[67].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.