Le sulfure de sodium, ou monosulfure de disodium, est un composé chimique de formule Na2S. On appelle aussi parfois « sulfure de sodium » son nonahydrate Na2S · 9 H2O, plus courant. Hydraté ou pas, le sulfure de sodium se présente sous la forme d'un solide ionique blanc, soluble dans l'eau et dont les solutions sont fortement basiques. Exposé à l'air humide, il dégage du sulfure d'hydrogène H2S, ce qui lui donne une odeur d'œuf pourri.
| Sulfure de sodium | |||
| |||
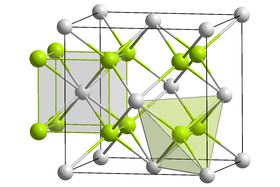
| Structure cristalline du sulfure de sodium avec en vert les ions Na+ et en gris les ions S2− |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Sulfure de sodium | ||
| No CAS | (anhydre) (pentahydrate) (nonahydrate) (hydrate) |
||
| No ECHA | 100.013.829 | ||
| No CE | 215-211-5 | ||
| Apparence | cristaux blancs à jaunes hygroscopiques, d'odeur caractéristique. (anhydre)[1] | ||
| Propriétés chimiques | |||
| Formule | Na2S [Isomères] |
||
| Masse molaire[2] | 78,045 ± 0,005 g/mol Na 58,91 %, S 41,09 %, nonahydrate: 240.182 g/mol |
||
| Propriétés physiques | |||
| T° fusion | (décomposition) : 920 à 950 °C (anhydre)[1] | ||
| Solubilité | soluble dans l'eau | ||
| Masse volumique | 1,86 g·cm-3 (anhydre)[1] | ||
| T° d'auto-inflammation | > 480 °C (anhydre)[1] | ||
| Précautions | |||
| SGH[3] | |||
| H314, H400 et EUH031 |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Structure
Le sulfure de sodium adopte une structure cristalline antifluorine. Le sel se dissocie en solution aqueuse mais comme l'ion S2− est une base trop forte, il réagit avec l'eau pour donner l'ion HS−. La réaction de dissolution, accompagnée de la protonation de l'anion sulfure, peut ainsi se résumer par : Na2S(s) + H2O → 2 Na+(aq) + HS−(aq) + OH−(aq)
Production
On le produit industriellement à partir de sulfate de sodium et de carbone contenu dans la houille suivant la réaction[4] : Na2SO4 + 4 C → Na2S + 4 CO
Il est aussi possible de l'obtenir industriellement à partir de hydrogénosulfure de sodium par réaction acide-base avec de la soude : NaHS + NaOH → Na2S + H2O
En laboratoire, le sel anhydre est préparé par réaction de soufre avec du sodium dans de l'ammoniac liquide anhydre. La réaction peut également être menée dans du tétrahydrofurane (THF) en présence de traces catalytique de naphtalène. Le bilan est alors[5]: 2 Na + S → Na2S
Sécurité
Le sulfure de sodium est dangereux et ne doit être manipulé que par des experts. Il est très alcalin, fortement corrosif et peut brûler la peau. Il réagit rapidement avec les acides en produisant du sulfure d'hydrogène, gaz toxique.
Notes et références
Voir aussi
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.



