Loading AI tools
composé chimique De Wikipédia, l'encyclopédie libre
Le menthol est un composé organique covalent obtenu soit par synthèse, soit par extraction à partir de l'huile essentielle de menthe poivrée ou d'autres huiles essentielles de menthe. Le stéréoisomère le plus courant du menthol est le (–)-menthol, de configuration (1R,2S,5R). Il appartient à la famille des monoterpénols. À température ambiante (20 à 25 °C), il se trouve sous forme de cristaux, d'une couleur blanc cireux. Il fond si l'on augmente légèrement la température. Le menthol a des propriétés anti-inflammatoires[6],[7] et antivirales[8]. Il est d'ailleurs utilisé pour soulager les irritations mineures de la gorge. C'est également un anesthésique local.
| Menthol | |
  |
|
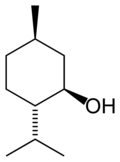
| Structure du menthol | |
| Identification | |
|---|---|
| Nom UICPA | (1R,2S,5R)-5-méthyl-2-(propan-2-yl)cyclohexanol |
| Synonymes |
5-méthyl-2-(1-méthyléthyl)-cyclohexan-1-ol |
| No CAS | , racémique , (−)-isomère , (+)-isomère |
| No ECHA | 100.016.992 |
| No CE | 201-939-0, racémique 218-690-9, (−)-isomère |
| PubChem | |
| FEMA | 2665 |
| SMILES | |
| InChI | |
| Apparence | solide cristallin blanc ou incolore |
| Propriétés chimiques | |
| Formule | C10H20O [Isomères] |
| Masse molaire[1] | 156,265 2 ± 0,009 7 g/mol C 76,86 %, H 12,9 %, O 10,24 %, |
| Propriétés physiques | |
| T° fusion | 36 à 38 °C, racémique 42 à 45 °C, (−)-forme (α) 31 à 35 °C, (−)-isomère[réf. souhaitée] |
| T° ébullition | 212 °C[réf. souhaitée] |
| Solubilité | légèrement soluble dans l'eau |
| Masse volumique | 0,903 g cm−3 (L, 15 °C)[2] |
| Point d’éclair | 93 °C[réf. souhaitée] |
| Point critique | 694,0 K[3] |
| Précautions | |
| SGH[4] | |
| H315, P264, P280, P302, P313, P352 et P362 |
|
| SIMDUT[5] | |
 D2B, |
|
| Écotoxicologie | |
| DL50 | 3 300 mg.kg-1 (rat, oral)
15 800 mg.kg-1 (lapin, peau)[réf. souhaitée] |
| Composés apparentés | |
| Isomère(s) | Citronellol, Dihydrolinalol |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le menthol a été isolé pour la première fois en 1771 par Gaubius. Le (–)-menthol (aussi appelé L-menthol ou (1R,2S,5R)-menthol) se trouve naturellement dans l'huile essentielle de menthe poivrée (Mentha × piperita)[9]. Le menthol japonais contient également un léger pourcentage de (+)-néomenthol[10].
Le menthol existe à l'état natif sous la forme d'un seul énantiomère : (1R,2S,5R), en bas à gauche du schéma.

Dans les composés naturels, le groupe isopropyle est orienté trans par rapport aux deux groupes, méthyle et alcool, en position cis. Ainsi il peut être dessiné de l'une ou l'autre des façons ci-dessous :
Dans l'état fondamental, chacun des trois substituants est en position équatoriale, faisant du (–)-menthol et de son énantiomère (1S,2R,5S) les isomères les plus stables. Il existe deux formes cristallines pour le menthol racémique. L'une a des points de fusion de 28 °C et l'autre de 38 °C. Pur, le menthol a quatre formes solides, dont la plus stable est la forme α.


Le menthol est inclus dans nombre de produits différents pour plusieurs raisons comme :
Le menthol a une toxicité relativement basse : DL50 de 3 300 mg·kg-1 pour le rat, oral ; DL50 de 15 800 mg kg−1 pour le lapin, peau.
En chimie organique, le menthol est utilisé comme auxiliaire chiral dans la synthèse de centres asymétriques.
Comme beaucoup de produits naturels employés couramment, la demande de menthol excède considérablement l'approvisionnement des sources naturelles. Le menthol est fabriqué comme énantiomère simple par Takasago International Cie sur une échelle de 400 tonnes par an. Le processus implique une synthèse énantiosélective développée par une équipe menée par Ryōji Noyori, prix Nobel de chimie en 2001 :
Le processus commence en formant une amine allylique du myrcène, qui subit l'isomérisation asymétrique en présence d'un complexe de rhodium de BINAP pour donner (après hydrolyse) le R-citronellal énantiomériquement pur. Le résultat est traité au bromure de zinc pour obtenir l'isopulégol qui est alors hydrogéné pour donner du (1R, 2S, 5R)-menthol pur. Le menthol racémique peut être préparé simplement par l'hydrogénation du thymol, et le menthol est également constitué par l'hydrogénation de la pulégone.
Le menthol réagit souvent de la même façon qu'un alcool secondaire normal. Il est oxydé en menthone en réduisant des agents tels que l'acide chromique, bien que dans certaines conditions, l'oxydation puisse aller plus loin et casser le cycle. Le menthol est facilement déshydraté pour donner principalement le 3-menthène, par l'action de 2 % d'acide sulfurique. Le traitement au pentachlorure de phosphore (PCl5) donne du chlorure de menthyle.
La capacité du menthol de déclencher chimiquement les récepteurs sensibles au froid dans la peau est responsable de la sensation de refroidissement bien connue qu'elle provoque une fois absorbée. Dans ce sens, elle est semblable à la capsaïcine, l'espèce chimique responsable de la sensation épicée des piments.
Des chercheurs du Centre médical de l'université de Georgetown aux États-Unis ont montré que le menthol, utilisé dans certaines cigarettes comme additif, désensibilise les récepteurs nicotiniques, permettant aux fumeurs de ne pas être irrités par la fumée et donc d'inhaler plus en profondeur[12].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.