Top Qs
Chronologie
Chat
Contexte
Chlorure de chrome(II)
composé chimique De Wikipédia, l'encyclopédie libre
Remove ads
Le terme chlorure de chrome(II) décrit des composés inorganiques de formule CrCl2(H2O)n. Le solide anhydre est blanc à l'état pur, cependant les échantillons commerciaux sont souvent gris ou verts ; il est hygroscopique et se dissout rapidement dans l'eau pour donner des solutions bleu-vif sensibles à l'air de tétrahydrate Cr(H2O)4Cl2. Le chlorure de chrome(II) n'a pas d'applications commerciales mais il est utilisé à l'échelle des laboratoires pour la synthèse d'autres complexes de chrome.
Remove ads
Synthèse
CrCl2 est produit en réduisant le chlorure de chrome(III) soit avec l'hydrogène à 500 °C :
- 2 CrCl3 + H2 → 2 CrCl2 + 2 HCl
ou par électrolyse[7].
Les préparations en faible quantité peuvent utiliser LiAlH4, le zinc ou des réactifs apparentés, pour réduire CrCl3 :
- 4 CrCl3 + LiAlH4 → 4 CrCl2 + LiCl + AlCl3 + 2 H2
- 2 CrCl3 + Zn → 2 CrCl2 + ZnCl2
CrCl2 peut aussi être préparé en traitant une solution d'acétate de chrome(II) avec du chlorure d'hydrogène[8] :
- Cr2(OAc)4 + 4 HCl → 2 CrCl2 + 4 AcOH
Remove ads
Structure et propriétés
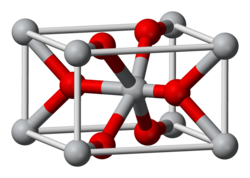
CrCl2 anhydre est blanc[8], cependant les échantillons commerciaux sont souvent gris ou verts. Il cristallise dans le groupe d'espace Pnnm, qui est une variante distordue de la structure rutile orthorhombique, ce qui le rend isostructurel au chlorure de calcium. Les centres Cr sont octaédriques, étant distordus par l'effet Jahn-Teller[9].
Le dérivé hydraté, CrCl2(H2O)4, forme des cristaux monocliniques de groupe d'espace P21/c. La géométrie moléculaire est approximativement plane carrée avec des distances Cr—O de 2,078 Å et les deux distances Cr—Cl valant 2,758 Å[3].
Remove ads
Réactions
Le potentiel d'oxydoréduction pour Cr3+ + e− ⇄ Cr2+ est de −0.41. Puisque le potentiel d'oxydoréduction de H+ à H2 en conditions acides est de +0.00, l'ion chromeux a un potentiel suffisant pour réduire les acides en hydrogène, bien que cette réaction ne se produise pas sans catalyseur.
Chimie organique
Le chlorure de chrome(II) est utilisé comme précurseur d'autres complexes de chrome inorganiques et organométalliques. Les halogénures d'alkyles et les nitroaromatiques sont réduits par CrCl2. L'électronégativité modérée du chrome et la variété de substrats que CrCl2 peut accepter rendent les réactifs organochromiques très versatiles en synthèse[10]. C'est le réactif de la réaction de Nozaki-Hiyama-Kishi, une méthode utile pour la préparation de cycles de taille moyenne[11]. Il est également utilisé dans l'oléfination de Takai pour former des iodures de vinyle à partir d'aldéhydes en présence d'iodoforme[12].
Références
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads