AMPA-reseptori
From Wikipedia, the free encyclopedia
Remove ads
AMPA-reseptorit (AMPAR) ovat tetrameerisiä ionikanaviin kuuluvia eli ionotrooppisia glutamaattireseptoreita (iGluR), jotka läpäisevät yhdenarvoisia kationeja kuten K+ ja Na+, ja jotkin myös Ca2+-kationeja. AMPAR:ien luonnollinen aktivoiva eli agonistinen välittäjäaine on L-glutamaatti. iGluR-ryhmään kuuluvat NMDAR:ät, kainaattireseptorit,[1][2] ja delta-reseptorit.[3]

Ampakiinit ovat AMPAR:ien toimintaa tehostavia positiivisia allosteerisia säätelijöitä.
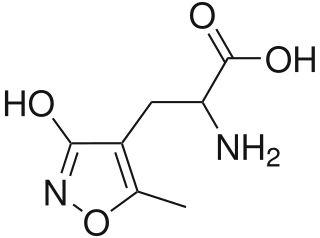
1970-luvun lopulla löydettyjä AMPAR:iä kutsuttiin aluksi kviskualaattireseptoreiksi, sillä ne havaittiin omaksi iGluR-ryhmäkseen kviskuaalihapon (eng. quisqualic acid) avulla. Happo on valikoiva AMPAR-agonisti,[4] ja sen hermostovaikutukset havaittiin ensi kerran 1974.[5] 1980-luvulla reseptorit nimettiin jälleen happoakin valikoivamman AMPA:n mukaan,[4] jonka aktiivinen enantiomeeri on (S)-AMPA.[6] Aine kehitettiin rasemaattina ensi kerran 1981 iboteenihaposta. AMPA:n lyhenne tulee sen englanninkielisestä nimestä: α-Amino-3-hydroxy-5-Methyl-4-isoxazolePropionic Acid[7] – suomeksi tämä on α-amino-3-hydroksi-5-metyyli-isoksatsoli-4-propionihappo.
Remove ads
Rakenne
AMPAR:ät ovat tetrameerejä eli ne koostuvat 4:stä proteiinialayksiköstä. Yksiköt yhtyvät solulimakalvostossa ensin dimeereiksi ja sitten tetrameereiksi. AMPAR:ien alayksikköjä on nisäkkäillä 4 (vanhentuneet nimet suluissa):[8]
- GluA1 (GluR1, GluRA)
- GluA2 (GluR2, GluRB)
- GluA3 (GluR3, GluRC)
- GluA4 (GluR4, GluRD)
Näitä koodaavat vastaavasti ihmisillä geenit GRIA1, GRIA2, GRIA3 ja GRIA4, jotka ovat vastaavasti kromosomien kohdissa 5q31.1, 4q32-q33, Xq25-q26 ja 11q22.[8]

Kukin AMPAR:än muodostava alayksikkö jaetaan 4:ään osaan:[8]
- Solun ulkoinen aminoterminaalidomeeni eli ATD (eng. amino terminal domain). Simpukkamainen LBD jaetaan vielä R1- ja R2-puolikkaisiin.
- Solun ulkoinen ligandia sitova domeeni eli LBD (eng. ligand binding domain). Simpukkamainen LBD jaetaan vielä S1- ja S2-puolikkaisiin, joiden väliin L-glutamaatti (tai jokin muu ligandi) kiinnittyy. Myös nimiä D1 ja D2 käytetään.
- Solukalvon läpäisevä domeeni eli TMD (eng. transmembrane domain). TMD jaetaan vielä osiin M1, M2, M3 ja M4. M2:t ovat kääntyneet kanavan sisään ja voivat vuorovaikuttaa sen läpi kulkevien ionien kanssa.
- Solun sisäinen karboksiterminaalidomeeni eli CTD (eng. carboxy terminal domain).
Alayksikköyhdistelmät
GluA2 on aikuisilla ihmisillä yleisin yksikkö. Valtaosa AMPAR:istä on heteromeerisiä eli niissä on keskenään erilaisia alayksikkötyyppejä. Hermoston yleisin heteromeeri on GluA1/2-AMPAR, jossa on 2 kpl GluA1-yksikköjä ja 2 kpl GluA2-yksikköjä. Eri yksikköyhdistelmien ilmeneminen vaihtelee riippuen solutyypistä ja eliön elämänvaiheesta.[9]
mRNA
Ihmisillä kaikkien AMPAR-alayksikköjen mRNA:n vaihtoehtoinen silmukointi voi tuottaa kustakin flip- tai flop-muodon. Näissä on eriävä 38. aminohapon pätkä TMD:n M4-osan jälkeen solun ulkopuolella. Suurin toiminnallinen ero on se, että flip-yksiköt reagoivat glutamaattiin hitaammin ja heikommin kuin flopit.[10]
Vaihtoehtoinen silmukointi CTD:n sekvenssialueelta mRNA:ssa voi ihmisillä tuottaa GluA2- ja GluA4-yksiköistä pitkän (eng. long) tai lyhyen (eng. short) muodon. Lyhyitä muotoja kutsutaan vastaavasti nimin GluA2C ja GluA4C.[10]
GluA2:ien mRNA:t voivat ihmisillä läpikäydä tumassa ADAR2-entsyymin toimesta Q/R-muutoksen, joka ilmenee TMD:n M2-osassa. Adenosiini muuntuu entsyymillä oksidatiivisella deaminaatiolla inosiiniksi, joka lukeutuu translaatiossa väärin guanosiinina.[11] Muutos riippuu vain GluA2-mRNA:issa olevasta 10 komplementaarisesta nukleotidisekvenssistä, jonka geneettinen puutos on kuolettavaa. Muutoksessa koodattu glutamiini (Q) muuntuu arginiiniksi (R). Q/R-muutos on mm. aikuisten ihmisten aivosoluissa hyvin yleinen.[10]
Ihmisillä on flip/flop-pätkän lähellä R/G-kohta. ADAR2 voi muuntaa mRNA:ta siten että muodostuvan proteiiniyksikön 764. argiiniini (R) onkin glysiini (G). Muutos voi tapahtua kaikille paitsi GluA1-yksiköille. Mekanismi on sama kuin Q/R-muutoksessa.[11] G-alayksikköiset AMPAR:ät turtuvat ärsykkeille herkemmin, mutta myös palaavat nopeammin ärsykeherkiksi.[10]
Post-translaatio
Translaation jälkeen alayksikköproteiinit voivat läpikäydä väliaikaisempia rakennemuutoksia. Yksikköjen C-terminaalialueiden tietyt seriini-, treoniini- ja tyrosiinitähteet voivat fosforyloitua. GluA1:n S831 voi fosforyloitua proteiinikinaasi C- ja CaMKII-välitteisesti. S845 voi fosforyloitua proteiinikinaasi A:n toimesta. Fosforylaation vaikutukset vaihtelevat.[9] Esimerkiksi NMDAR:ät pystyvät tehostamaan tai heikentämään AMPAR:ien toimintaa pitkäaikaisesti. Viime kädessä ionivirran lisäys tapahtuu mm. GluA1:n S831 fosforylaation kautta, ja heikennys reseptorin solun sisään ottoon johtavan GluA1:n S845 defosfosrylaation kautta.[2]
Kaikkien ihmisten alayksiköiden M2- ja M4-osien solunsisäisillä alueilla on konservoituneet kysteiinitähteet, joihin voi liittyä palmitaatti. M2:n palmitylaation saa aikaan GODZ-entsyymi (eng. Golgi-associated palmitoyl transferase). Kaikissa alayksiköissä on 4–6 solun ulkoista aluetta, joissa olevat aminohapot voivat N-glykosyloitua. Alueet ovat solun ulkopuolella LBD:n S1-alueella ja ATD:ssä.[9]
Remove ads
Aktivointi ja säätely
AMPAR:ien luonnollinen agonisti on L-glutamaatti, jonka sitoutumisherkkyys näihin on pienempi kuin esimerkiksi NMDAR:iin. AMPAR:ät aktivoivat ja turtuvat nopeasti agonistien ärsykkeille suhteessa muihin iGluR:iin. Aktivoituessaan AMPAR päästää lävitseen Na+- ja K+-ioneita aiheuttaen depolarisaation. Usein nämä ionit virtaavat vastaavasti sisään ja ulos solusta. Synapsien depolarisaatio kasvaa huippuunsa muutamassa mikrosekunnissa, ja palaa perustilaan millisekunneissa.[2] Kanavat läpäisevät muitakin yksiarvoisia kationeja. Esim. GluA1:n läpäisyherkkyys on K+ ≈ Rb+ > Cs+ > Na+ ≈ Li+.[8]
GluA2-yksiköt määräävät pitkälti AMPAR:än ominaisuudet. Niitä sisältävät AMPAR:ät eivät mm. läpäise Ca2+-ioneita ja niiden kanavavirtaus on suoraan verrannollinen solukalvon jännitteeseen. Taas GluA2-yksikköjä sisältämätön AMPAR läpäisee Ca2+-ioneita – tällaisen kanavan ionivirtaus heikkenee ylitettäessä tietty kalvojännite, sillä tietyt sisäsyntyiset polyamiinit salpaavat kanavaa jänniteriippuvaisesti.[2] pH-arvon kasvu vähentää AMPAR:ien ärsykeherkkyyttä – vaikutus on suurin flop-GluA1-yksiköiden kohdalla.[8]
AMPAR:ien kanssa vuorovaikuttavat eri proteiinit, mutta eivät välttämättä suoraan aktivaatiossa. AMPAR:ien säätelyyn osallistuvat monet PDZ-motiivin sisältävät proteiinit kuten GRIP (glutamate receptor interacting protein) ja PICK1 (protein interacting with C-kinase-1). Muita proteiineja ovat mm. NSF (N-ethylamide-sensitive fusion protein), AP2 (adaptor protein 2), SAP97 (synapse-associated protein 97), NARP (neuronal activity-regulated pentraxin) ja TARP:it (transmembrane AMPA receptor regulatory proteins).[12]
Remove ads
Sijainti ja roolit
AMPAR:ät ovat mm. nisäkkäiden aivoissa välttämättömiä ja pääasiallisia nopeiden solutoimintaa kiihdyttävien hermoviestien välittäjiä. AMPAR:iä löytyy kaikista tunnetuista hermosoluista ja hermotukisoluista, joista ensiksi mainituissa AMPAR:illä on monia postsynaptisia rooleja. Taas presynaptisesti AMPAR:ät mm. säätelevät GABA:n vapautumista korisolujen terminaaleista pikkuaivojen Purkinjen soluille. Hermotukisoluissa AMPAR:ät osallistuvat mm. astrosyyttien glutamaatin välityksen säätelyyn, solun sisäisten kalsiumpitoisuuserojen luomiseen, hermotukisolujen muotoutuvuuteen ja solun ulkoisten ionikoostumuksien säätelyyn.[13]
GluA1:n poisto poistogeenisillä (knockout) hiirillä johtaa niiden työmuistin ja oppimiskyvyn heikkenemiseen, muttei vaikuta niiden elinikään. GLuA2:n poisto aiheuttaa homotsygooteilla hiirillä mm. vajaakasvuisuutta, fyysistä heikkoutta, koordinaatiokyvyn heikkoutta ja varhaisen kuoleman. GluA3:ien poiston vaikutukset ovat vähäiset. GluA2:ien Q/R-muutoskyvyn poistavat mutaatiot aiheuttavat hiirillä epilepsiaa ja kuoleman alle 3:ssa viikossa.[14]
Ligandit
Kilpailevia agonisteja (vaikutuskohteet suluissa):
- (S)-5-Fluorowillardiini (AMPAR/KAR)[8]
- (S)-AMPA (AMPAR/KAR)[15]
- Domoiinihappo (AMPAR/KAR)[16]
- L-glutamiinihappo (AMPAR/KAR/NMDAR)[8]
- Kaiinihappo (AMPAR/KAR)[8]
- L-Kviskuaalihappo (AMPAR/KAR)[15]
Kilpailevia antagonisteja (vaikutuskohteet suluissa):
- CNQX (AMPAR/KAR/NMDAR:n glysiiniä sitova alue)[17]
- DNQX (AMPAR/KAR/NMDAR:n glysiiniä sitova alue)[17]
- NBQX (AMPAR/KAR)[17]
Ei-kilpailevia antagonisteja (vaikutuskohteet suluissa):
- Argiotoksiinit (salpaavat monia polyamiinien säätelemiä reseptoreja: AMPAR/KAR/α7-nACh ym., salpaavat vain AMPAR:iä, joissa ei ole GluA2:ia)[18]
- Filantotoksiini (salpaa monia polyamiinien säätelemiä reseptoreja: AMPAR/KAR/α7-nACh ym., salpaa vain AMPAR:iä, joissa ei ole GluA2:ia)[15][19]
- GYKI53655 (AMPAR/KAR)[20]
- Jorotoksiini (salpaa monia polyamiinien säätelemiä reseptoreja: AMPAR/KAR/α7-nACh ym., salpaa vain AMPAR:iä, joissa ei ole GluA2:ia)[15]
- SYM2206 (AMPAR)[15]
Positiivisia allosteerisia säätelijöitä ovat ampakiinit.
Remove ads
Lähteet
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
