Metal alkalino
Taula periodikoko 1 taldeko elementuetako bakoitza: litioa (Li), sodioa (Na), potasioa (K), rubidioa (Rb), zesioa (Cs) eta frantzioa (Fr). From Wikipedia, the free encyclopedia
Remove ads
Metal alkalinoak edo alkaliak taula periodikoko talde bat, 1. taldea deritzona, osatzen duten metalak dira. Multzo horretan daude litioa (Li), sodioa (Na), potasioa (K), rubidioa (Rb), zesioa (Cs) eta frantzioa (Fr), eta serie kimiko bat osatzen dute. [1]Metal alkalinoen geruza elektroiak s orbital batean aurkitzen dira; horregatik, taula periodikoaren s-blokean daude kokatuta. Beraz, metal alkalinoek s-blokeko beste elementuen propietate antzekoak izango dituzte.[2]
| Taldea → ↓ Periodoa |
1 |
| 2 | 3 Li |
| 3 | 11 Na |
| 4 | 19 K |
| 5 | 37 Rb |
| 6 | 55 Cs |
| 7 | 87 Fr |

Metal alkalino guztiak, distiratsuak eta leunak dira. Gainera, tenperatura eta presio estandarretan oso erreaktiboak dira, eta ondorioz euren azken geruzako elektroia oso azkar galtzen dute, +1 kargako katioiak eratuz. Euren leuntasunaren eraginez, labana batekin oso erraz moztu daitezke, duten geruza distiratsu mehea airearekin (oxigenoa gehienetan, litio eta nitrogenoa batzuetan) erraz oxidatzen delako. Oso erreaktiboak direnez gero, oliotan gorde behar izaten dira airearekin erreakzioa egin dezaten saihesteko, eta modu naturalean gatzetan soilik aurkitzen da, inoiz ez elementu aske modura. Zesioa, bosgarren metal alkalinoa, elementu erreaktiboena da. IUPACen nomenklatura berriaren arabera, metal alkalinoek elementuen lehen tardean sartzen dira, Hidrogenoa kanpoan geratzen delarik, normalean ez delako metal alkalino kontsideratzen, haiekin konparatuta duen portaera desberdinaren ondorioz. Metal alkalino guztiek urarekin erreakzionatzen dute, eta astunagoek arinagoek baino erreakzio bortitzagoa dute.
Naturan, alkali guztiak konposatuak osatuta aurkitzen dira. Metal alkalino ugariena sodioa da, eta ondoren potasioa, litioa, rubidioa, zesioa eta, azkenik, frantzioa. Azken hori oso bakana da, erradioaktibitate handikoa baita, eta desintegrazio kate naturalaren adar arraro batzuetan alboko urrats modura besterik ez da agertzen. Ununenioaren (Uue), alkalinoen taldeko hurrengo elementua, sintesirako hainbat esperimentu saiatu dira, baina ez dira emaitzarik lortu. Hala ere, esan beharra dago, Ununenioa ez litzatekeela guztiz metal alkalino kontsideratu behar, euren propietate fisiko eta kimikoen artean desberdintasunak daudelako.[3]
Metal alkalino gehienek hainbat aplikazio dituzte eguneroko bizitzan. Forma puruen aplikazio ezagunenetako bat zesioa eta rubidioak erloju atomikoetan duten erabilera da. Zesiozko erloju atomikoa denbora zehaztasun eta prezisio handienarekin ematen duena da. Sodio konposatuen erabilera arruntenetako bat sodio lurruneko lanparak dira, Sodioak argia oso modu eraginkorrean emititzen bait.. Sodio kloruroa etxean gehien erabiltzen den gatz arrunta da. Sodioa eta potasioa, ere, funtsezko mantenugaiak dira bizitzarako, eta zeregin biologiko garrantzitsua dute elektrolito modura. Nahiz eta gainerako metal alkalinoak funtsezkoak ez izan, izaki bizidunetan eragin handiak dituzte; bai onuragarriak, bai kaltegarriak.[4]
Remove ads
Historia

Sodio konposatuak antzinatik ezagutzen dira; Gatza (sodio kloruroa) giza-ekintzetan produktu garrantzitsua izan da, ingelesezko salario (soldata) hitzak dioen bezala, erromatar soldaduei ordaindutako dirua da gatza erostearen truke.[5] Potasa antzinatik erabilia izan da, eta ez da ulertu bere historiaren zati garrantzitsu bat gatz mineralekin zerikusia ez duen substantzia bat denik. Georg Ernst Stahl-ek sodio- eta potasio-gatzen arteko desberdintasuna aurkitu zuen 1702. urtean,[6]eta Henri-Louis Duhamel du Monceau-ek demostratu zuen diferentzia hau 1736.urtean.[7] Sodio eta potasio konposatuen konposizio kimiko zehatza, eta haien egoera kimikoa ez ziren garai horretan ezagutzen, ondorioz Antoine Lavoisier-ek ez zituen bere elementu kimikoen zerrendan sartu 1789.urtean.[8] [9]
Potasioa lehen aldiz isolatu zen 1807.urtean Ingalaterran. Isolamendua Sir Humphry Davy-k egin zuen, zeinek potasa kaustikarra deribatu zuen (KOH, potasio hidroxidoa) gatzaren elektrolisia pilara voltaikoarekin erabiliz, azken hau asmatu berria. Gatz akuosoaren elektrolisiak aurretik egiten saiatu ziren baina honek ez zuen inolako emaitza onik eman, izan ere, potasioaren erreaktibotasun handiak zailtasunak sortzen zituen.[10] Potasioa izan zen elektrolisiaren bidez isolatu zen lehenengo metala.[11] Beranduago, urte berean, Davy-k lortu zuen sodioa NaOH-tik (lixiba) erauztea antzeko teknika bat erabiliz, era honetan, elementuak eta hortaz, gatzak, desberdinak zirela demostratuz.[8][9][12][13]
LiAlSi4O10 1800.urtean aurkitu zuen José Bonifacio de Andrada kimikariak, Suediako Utö uhartean.[14] [15] [16]Hala ere, Johan August Arfwedson-ek, Jöns Jacob Berzelius kimika laborategian, petalita minerala analizatzean elementu berri bat detektatu zuen 1817.urtean.[17] [18]Elementu berri honek sodio eta potasioaren antzeko konposatuak sortzen zituela ikusi zuen, nahiz eta bere karbonatoak eta hidroxidoak gutxiago disolbatzen ziren uretan eta beste metal alkalinoak baino alkalinoagoak ziren. [19] Berzelius-ek "lithion / lithina" izena eman zion material ezezagunari, grekotik λιθoς (lithos, harria), era honetan bere aurkikuntzan mineral solidoa islatzeko, potasio eta sodioa ez bezala, izan ere, potasioa landare errautsetan aurkitu zen eta sodio animali odolean. Metalari Litio izena eman zion. [20] [15][18] Litioa, sodioa eta potasioa periodizitatearen aurkikuntzaren zati bat izan ziren, izan ere, 1850.urtean Wolfgang Döbereiner-ek propietate berdintsuak izateagatik talde berdinean kokatu zituen.[21]

Rubidioa eta zesioa izan ziren aurkitu ziren lehenengo elementuak espektroskopioa erabiliz, azken hau Robert Bunsen y Gustav Kirchhoff-ek asmatu zuen 1859.urtean.[22] Hurrengo urtean, Alemaniako Bad Dürkheim ur-mineralean zesioa aurkitu zuten. Urte bat beranduago rubidioa aurkitu zuten Alemanian berriro ere, Heidelbergen, eta lepidolita mineralean aurkitua izan zen.[23] Rubidio eta zesio izenak beraien emisio espektroetan agertzen diren lerroen ondorioak dira: lerro gorri eta distiratsu bat rubidioarentzat (latinetik, rubidus, gorri ilun edo distiratsua), eta zeruak duen urdin koloreko lerroa zesioarentzat (latinetik caesius).[24][25]
1865.urtean, John Newlandsek elementuak zenbakitu zituen, pisu atomikoak, propietate fisikoak eta propietate kimikoak handiak lehenengoak ezarriz, zortzinaka. Periodizitatea musikako zortzikoekin alderatu zuen, non zortziko batekin bereizten diren notek propietate antzekoak dituzten.[26][27] Bere bertsioak, jada ezagutzen ziren metal alkalinoak elkarrekin jarri zituen talde berdinean, hala nola, litioa, zesioa, kobrea, zilarra eta talioa (+1 oxidazio-egoera erakusten dute denek).[21]
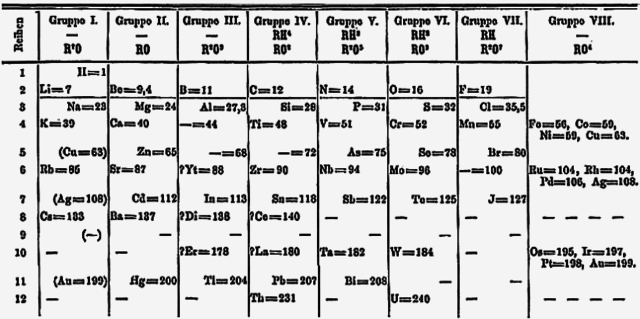
1869.urtea pasa ondoren, Dmitri Mendeleevek bere taula periodikoa proposatu zuen litioa talde baten goialdean ezarriz sodioarekin, potasioarekin, rubidioarekin, zesioarekin eta talioarekin batera.[28] (Bi urte beranduago, Mendeleevek hidrogenoa lehenengo taldean kokatu zuen, litioaren gainean eta talioa boroaren taldera mugitu zuen. Bertsio honetan (1871), kobrea, zilarra eta urrea bi aldiz kokatu ziren, behin IB.taldeko kide bezala eta beste behin VIII taldeko kide bezala, gaur egun 8 eta 11.taldeak dira.[29] Taulan 18 talde ezarri zirenean, IB.taldeko elementuak bere ohiko posiziora mugitu zuren, d blokera. Metal alkalinoak aldiz, IA taldean utzi ziren. Beranduago, taldearen izena aldatu zen, 1.taldea deituz, 1988.urtean.[30] 1.taldeko elementuen hidroxidoak alkali sendoak dira uretan disolbatzean eta horregatik jarri zieten metal alkaliko izena.[31]
Gutxienez, oker eta osatugabeko lau aurkikuntza zeuden[32][33][34][35], Pariseko Curie Institutuko Marguerite Pereyk frantzioa aurkitu zuen arte 1939an. Honen aurkikuntza aktinio-227 lagin bat purifikatuz izan zen, zeina 220 keV-ko desintegrazio energia zuen. Hala ere, Pereyk deskonposatutako partikulak nabaritu zituen 80 keV baino baxuagoko energiarekin. Berak pentsatu zuen deskonposaketa honen kausa aurretik identifikatu gabeko produktu batena izan zitekeela, hau da, purifikazio bidez banandutako produktu bat, baina berriro ere aktinio-227 purutik birsortu zena. Askotariko probek ezeztatu zuten torioa, radioa, beruna, bismutoa edo talioa elementu ezezaguna izateko aukera. Produktu berriak metal alkalinoaren propietate kimikoak zituen (hala nola, koprezipitazioa zesio gatzekin), beraz, Pereyk identifikatu zuen 87. elementua zela, aktinio-227 alfa desintegrazioaren kausa izanik.[36] Ondoren, Pereyk beta-desintegraziotik alfa-desintegraziora zegoen proportzioa determinatu nahi izan zuen. Bere lehenengo frogan alfak % 0,6ko adarkadura lortu zuen, baina gerora, %1an bihurtu zen.[37]

Frantzioaren ondorengo elementua (Mendeleeve-n taula periodikoaren arabera), Ununennio (Uue) da, 119. elementua.[38]Ununennioaren sintesia lehen aldiz 1985. urtean egin zen, Berkeley-n (California), superHILAC azeleragailuan. Horretarako, Einsteinio-254-ko itu bat bonbardatu zuten Kaltzio-48 ioiekin. 300 nb-ko mugatik behera, ez ziren atomoak identifikatzeko gai izan.[39][40]

Zoritxarrez, [39]oso zaila izango da Ununenniozko atomoak sortzea etorkizun batean. Izan ere, Einsteinio-254 nahikoa lortzea oso zaila da. Esperimentua hobetzeko Einstenio-254 gehiago duen itua beharko litzateke. Baina, hau oso zaila da, elementu oso astuna delako, 270 eguneko iraupena duelako eta mikrogramotan [41]bakarrik lortu daitekeelako. Einstenioa ez da naturan aurkitzen, beraz laborategian sortu behar da. Eta aipatutako arrazioengatik oso kantitate txikietan ekoitzi daiteke. Hala ere, Ununennioa-ren sintesia lortzeko beste erreakzioak aurkituko dituzte etorkizunean. Esate baterako, Japonen[42] jada lanean ari dira. Ununennio-a 8.periodoko lehenengo elementua da, eta kontuan izan behar da, periodo honeko elementuak ez direla aurkitu oraindik, fisikoki aurkitzea ezinezkoa izango dela ziurrenik.[43][44] Gainera, ez dira metal alkalino astunentzako sintesi saiakuntzak egin hainbat arrazoiengatik; euren zenbaki atomiko altuagatik, batez ere. Hauen sintesia egiteko, metodo indartsuagoak eta teknologia hobegoa behar dira.[38]
Remove ads
Agerpenak
Eguzki sisteman

Oddo-Harkins arauak dio, zenbaki atomiko pare duten elemtuak ugariagoak direla, zenbaki atomikoa inparea duten elementuak baino, Hidrogenoa salbu. Arau honek azaltzen duen moduan, zenbatki atomiko inpareko elementuek protoi desparekatu bat dutenez beste bat harrapatzeko erreztasuna dute euren zenbaki atomikoa igoz. Zenbaki atomiko paredun elementuetan, protoiak parekatuak daude, eta bakoitza bere pararekin spin-a deuseztatzen du, elementua egonkortuz. Metal alkalino guztiak zenbaki atomiko inparekoak dira, eta beraz, ez dira berain ondoan aurkitzen diren zenbaki atomiko paredun elementuak (gas nobleak eta lurrazaleko metal alkalinoak) bezain ugariak eguzki sisteman. Metal alkalino astunenak, ere, arinak baino gutxiago aurkitzen dira. Adibidez, rubidioa, supernoban bakarrik sintetizatu daiteke, eta ez nukleosintesi gorenean. Litioa, ere, sodio eta potasioa baino askoz ere urriago da, eta kantitate txikitan sintetizatu zen Big Bangean emandako izarreko nukleosintesian. Big Bang-ak litio, berilio, eta boro kantitate txikiak ekoizteko gai izan zen bakarrik, 5 eta 8 nukleoizko nuklekoak dituztelako elementu hauek. Nukleosintesi gorenak hau egiteko gai da, alfa hirukoitzaren prozesuaren bitartez, hiru helio atomo eta karbono atomo bat fusionatuz, eta hiru elementu hauek alde batera utziz.[45]
Lurrean

Lurra eta eguzkia materia-hodei berdinetik sortu ziren, baina eguzki sistemaren sorrerak eta garapenak planetek konposizio desberdina izatea eragin zuten. Lurraren historia naturalak, planetako leku desberdinetan elementuen kontzentrazio desberdinak aurkitzea eragin du. Lurraren masa 5,98x1024 kg da, gutxi gorabehera. Bere konposizioa honako hau da: burdina (32,1 %), oxigenoa (30,1 %), silizioa (15,1 %), magnesioa (13,9 %), sufrea (2,9 %), nikela (1,8 %), kaltzioa (1,5 %) eta aluminioa (1,4 %); soberan dagoen 1,2 % beste elementuek osatzen dute. Lurraren nukleoko gunea gehien bat burdinez (88,8 %) osatuta dagoela uste da, nikel (5,8 %) kantitate txikiagoekin, sufrea (4,5 %) eta 1% baino gutxiago beste elementu batzuekin.[46][47][48][49]
Metal alkalinoek duten erreaktibitate handiaren ondorioz, ez dira modu puruan sortzen naturan. Litofiloak dira, eta lurraren gainazalaean oxigenoarekin konbinatuz, oso modu indartsuan elkartzen dira silizioarekin, lurraren nukleoan gelditzen ez diren dentsitate nahiko txikiko mineralak eratuz. Potasioa, rubidioa eta zesioa ere ezin dira gai hau egiteko, euren erradio-ioniko handiaren ondorioz.[50]
Sodioa eta potasioa oso ugariak dira lurrean, biak lurrazaleko hamar elementu ugarienen artean aurkitzen dira.[51] [52]Sodioak, lurrazaleko 2,6 % osatzen du pisutan. Seigarren elementu ugariena da lurrazalean, eta metal alkalinoen artean ugariena. [53]Potasioak, ordea, lurrazaleko 1,5 % osatzen du pisutan, eta zazpigarren elementu ugariena da lurrazalean. [53]Sodioa mineral desberdinetan aurkitu daiteke, ezagunena gatz arrunta izanik (Sodio kloruroa), itsasoko uretan kantitate oso handitan disolbatuta aurkitzen dena. Sodioaren beste biltegi solidu batzuk hauek dira: halita, anfibola, kriolita, nitratina eta zeolita. [53]Biltegi solido hauek, gehien bat, antzinako itsasoen ebaporazioaren ondorioz sortu dira. Fenomeno hau, hainbat lekutan gertatu zen; adibidez, Utah-ko Ur Gaziko Laku Handian edota Itsaso Hilan. [10] Lurrazaleko ugaritasunari dagokionez, bi elementu hauek nahiko parekatuak daude. Baina, ozeanoetan sodioa askoz ere ugariagoa da potasioa baino. Honen arrazoiak hauek dira: potasioak oso tamaina handia du, eta ondorioz, eratzen dituen gatzak ez dira uretan hain ondo disolbatuko; gainera, potasioa egoera solidoan dagoenean silikatoarekin elkartzen da, eta potasioak filtratzen duena askoz ere errazago absorbatzen du landareriak sodioarena baino.[10]
Nahiz eta kimikoki oso antzekoak izan, litioa ez da normalean sodio eta potasioarekin agertzen, honen tamaina txikiagatik. [10]Litioak oso erreaktibitate txikia dauka; baina, hala ere, itsasoko uretan kantitate handitan aurkitu daiteke, 0,14-tik 0,25-ppm-tara edo 25 mikromolar hain zuzen ere.[54][55] [56]Magnesioarekin duen erlazio diagonalak, ferromagnesioano mineraletan magnesioa bera ordezkatzea eragiten du kasu askotan, honen lurrazaleko kontzentrazioa 18 ppm izanik, galio eta niobia-ren kontzentrazioekin konparagarria dena. Komertzialki garrantzi handiena duen litio minerala espodumena da, mundu osoan zehar biltegi askotan aurkitu daitekeena.[10]
Rubidioa, zinka bezain ugaria da, eta biak kuprea baino ugariagoak. Mineral hauetan aurkitu daiteke naturalki: leuzita, poluzita, karnalita, zinwaldita eta lepidolita.[57] Esan beharra dago, mineral hauek ez dutela bakarrik rubidioa, beste konposatu batzuk eduki ditzakete.[10] Zesioa antimonio, kadmio, eztainu, eta tungsteno bezalako elementu ezagunak baino ugariago da; baina, rubidioa baino urriagoa.[58]
Frantzio-223, naturalki sortu daitekeen frantzioaren isotopo bakarra[59][60], aktinio-227-ren alfa ahultzeraren produktua da, uranioaren mineraletan kantitate oso txikitan aurkitu daitekeena. [61]Uraniozko lagun batean, 1018 uranio atomoko bakarrik frantzio atomo bat dagoela uste da.[62][63] Kalkuluen arabera, lurrazalean 30 g frantzio bakarrik daude, honen bizitza laburraren ondorioz, 22 minutu.[64][65]
Remove ads
Argazki galeria
- Litioa.
- Sodioa.
- Potasioa.
- Rubidioa.
- Zesioa.
Erreferentziak
Ikus, gainera
Kanpo estekak
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads





