Cisteína
compuesto químico De Wikipedia, la enciclopedia libre
La cisteína (abreviada como Cys o C) es un α-aminoácido con la fórmula química HS-CH2-CHNH2-COOH. Se trata de un aminoácido no esencial, lo que significa que puede ser sintetizado por los humanos. Los codones que codifican la cisteína son UGU y UGC (UraciloGuaninaUracilo y UraciloGuaninaCitosina). La cisteína contiene un grupo tiol (-SH) en su cadena lateral, que hace que este aminoácido, en su totalidad, sea considerado como polar e hidrófilo. La parte tiol de la cadena suele participar en reacciones enzimáticas, actuando como nucleófilo.
| Cisteína | ||
|---|---|---|
  | ||
| Nombre IUPAC | ||
| Ácido 2-amino-3-sulfanilpropanoico | ||
| General | ||
| Símbolo químico | Cys, C | |
| Fórmula estructural |
 | |
| Fórmula molecular | C3H7NO2S | |
| Identificadores | ||
| Número CAS | 52-90-4[1] | |
| ChEBI | 35235 17561, 35235 | |
| ChEMBL | CHEMBL863 | |
| ChemSpider | 5653 | |
| DrugBank | DB00151 | |
| PubChem | 5862 | |
| UNII | K848JZ4886 | |
| KEGG | C00097 D00026, C00097 | |
|
SCC(N)C(=O)O
| ||
| Propiedades físicas | ||
| Masa molar | 121,16 g/mol | |
| Punto de fusión | 513,15 K (240 °C) | |
| Propiedades químicas | ||
| Acidez | 1,91; 8,14; 10,28 pKa | |
| Solubilidad en agua | 280 g/l | |
| Familia | Aminoácido | |
| Esencial | No | |
| Codón | UGU, UGC | |
| Punto isoeléctrico (pH) | 5,07 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
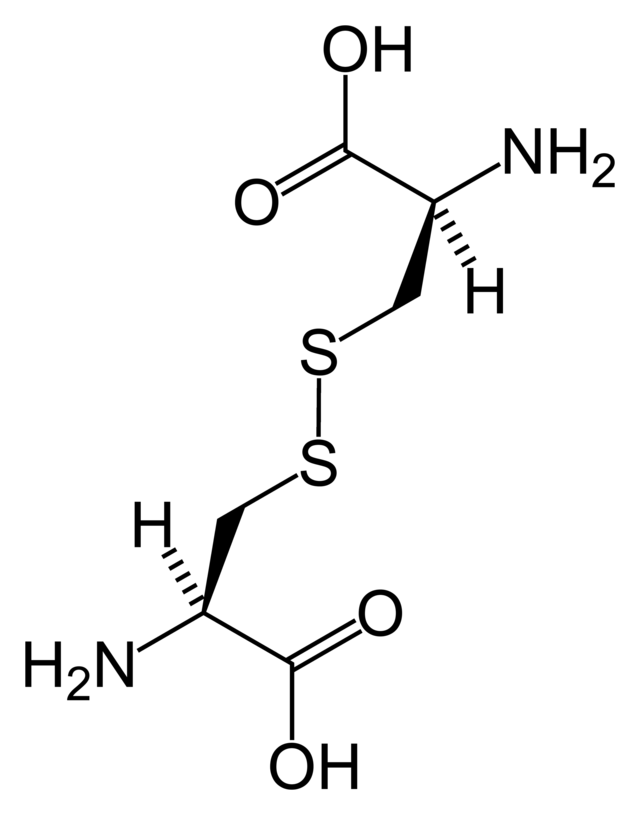
El tiol es susceptible a la oxidación para dar lugar a puentes disulfuros derivados de las cisteínas, que tienen un importante papel estructural en muchas proteínas. La cisteína también es llamada cistina, pero esta última se trata de un dímero de dos cisteínas unidas mediante un puente disulfuro.
Historia
El primer aislamiento de la proteína lo logró el químico sueco Count Morner en 1899.[2] Anteriormente, el profesor Eugen Baumann mediante la reducción de cistina también tuvo éxito.[3]
Fuentes
Resumir
Contexto
Fuente alimentaria que nos provee la L-cisteína
A pesar de que está clasificada como aminoácido no esencial, en algunos casos, la cisteína podría ser esencial para bebes, ancianos y personas con ciertas enfermedades metabólicas o que sufren de síndromes de malabsorción. La cisteína normalmente es sintetizada por el cuerpo humano dentro de condiciones fisiológicas normales, siempre que haya metionina suficiente. La cisteína es potencialmente tóxica y es catabolizada en el aparato digestivo y en el plasma de la sangre. La cisteína viaja de forma segura a través del aparato digestivo y del plasma y es reducida rápidamente a las dos moléculas de cisteína que entran en la célula.
La cisteína se encuentra la mayoría de los alimentos con alto contenido proteico, como son:
- Carne cruda: se encuentra en carne cruda, ya que la cisteina es termolabil o sea que se degrada al calor.
- Huevos: tienen que ser de gallina de rancho y no de los que encontramos comúnmente en el supermercado.
- Leche bronca: obviamente no tiene que ser de la que encontramos en los supermercados, sino de vaca pastada.
- Leche materna: es lo que nos ayudara al transcurso de nuestra vida.
- Vegetales: los vegetales tienen que ser por ejemplo brocoli o espárragos.
Como otros aminoácidos la cisteína tiene un carácter anfotérico.

Síntesis de la cisteína: La cisteína beta sintetasa cataliza la reacción superior y la cistationina gamma-liasa cataliza la reacción inferior. En animales, la biosíntesis comienza con el aminoácido serina. El azufre se deriva de la metionina que es convertida en homocisteína mediante el intermedio S-adenosilmetionina.Tras esto la Cistationina beta-sintetasa combina homocisteína y serina para formar el tioéter asimétrico cistationina. La enzima cistationina gamma-liasa convierte la cistationina en cisteína y alpha-ketobutirato. En plantas y bacterias la biosíntesis de la cisteína empieza también a partir de la serina que pasa a convertirse en O-acetilserina por actuación de la enzima serina acetiltransferasa (EC 2.3.1.30). La enzima O-acetilserina (tiol)-liasa ((OAS-TL; EC 2.5.1.47), usando azufre en forma de ácido sulfhídrico, convierte este éster en cisteína por desplazamiento del acetato...
Funciones biológicas
Resumir
Contexto
El grupo tiol de la cisteína es nucleofílico y fácilmente oxidable. La reactividad aumenta cuando el tiol es ionizado y los residuos de cisteína en proteínas tienen valores de pH cercanos a la neutralidad, por lo que a menudo se encuentran tioles en forma reactiva en la célula. Debido a su alta reactividad, el grupo tiol de la cisteína tiene numerosas funciones biológicas.
Precursor de glutatión antioxidante
Debido a la habilidad de los tioles de sufrir reacciones redox, la cisteína tiene propiedades antioxidantes. Estas propiedades antioxidantes de la cisteína son mayoritariamente expresadas en glutationes tripéptidos que se producen tanto en humanos como en otros organismos. La disponibilidad sistemática de glutatión oral (GSH) es insignificante, por esto ha de ser biosintetizado a partir de los aminoácidos que lo constituyen como son la cisteína, la glicina y el ácido glutámico. El ácido glutámico y la glicina se encuentran abundantemente en la mayoría de las dietas occidentales, así que la disponibilidad de cisteína puede ser el substrato limitante.
Puentes disulfuro
Los puentes disulfuro tienen un papel importante en el ensamblaje y la estabilidad de algunas proteínas, normalmente las proteínas secretadas al medio extracelular. Desde que la mayoría de los compartimentos celulares son medios reducidos, los puentes disulfuros son generalmente inestables en el citosol, excepto algunas excepciones que vemos a continuación.
Los puentes disulfuros en proteínas se forman por la oxidación de grupos tioles de residuos de cisteína. Los otros aminoácidos que también contienen azufre, como la metionina no pueden formar puentes disulfuro. Oxidantes muy agresivos convierten la cisteína en los correspondientes ácido sulfánico y ácido sulfónico. Los residuos de cisteína tienen un papel de gran valor en proteínas reticuladas, ya que incrementa la rigidez de las proteínas y también confiere resistencia proteolítica. Dentro de la célula, los puentes disulfuros entre residuos de cisteína actúan de soporte en la estructura secundaria de polipéptidos. La insulina es un ejemplo de proteínas con cisteínas reticuladas, en donde dos cadenas separadas de péptidos son conectadas por un par de puentes disulfuros.Las proteínas disulfuro isomerasas catalizan la propia formación de puentes disulfuros; la célula transfiere ácido deshidroascórbico al retículo endoplasmático. En la naturaleza, las cisteínas se encuentran, en general, oxidadas a cistinas siendo su única función la nucleofílica.
Precursores de grupos hierro-sulfuro
Cisteína es una importante fuente de azufre en el metabolismo humano. El azufre de los grupos hierro-sulfuro y de las nitrogenasas es extraído de la cisteína y pasa a convertirse en alanina durante el proceso.
Unión al ion metálico
Aparte de las hierro-sulfuro-proteínas, muchos otros cofactores metálicos en enzimas son uniones para el sustituyente del tiol de los residuos de cisteína. Ejemplos de esto son el zinc en los dedos de zinc y el alcohol desidrogenasa; el cobre en las proteínas azules cuprosas, el hierro en el citocromo P450; y el níquel en las [NiFe]-hidrogenasa. El grupo tiol también tiene gran afinidad con los metales pesados, por lo que proteínas que contienen cisteína como la metalotionina que unirá metales como el mercurio, plomo y cadmio fuerte.
Modificaciones postraduccional
Aparte de su oxidación a cistina, la cisteína participa en numerosas modificaciones postraduccionales. El grupo tiol nucleofílico permite a la cisteína conjugar otros grupos, como por ejemplo en la prenilación, las ligasas de la ubiquitina transfieren ubiquitina a sus colgantes, proteínas y a las caspasas que participan en la proteólisis en el ciclo apoptótico. Las inteínas (intrones de proteínas) normalmente actúan como ayuda para la cisteína catalítica. Estos papeles de la cisteína son típicos limitados al medio intracelular, donde el medio está reducido y la cisteína no se encuentra oxidada en cistina.
Otros metabolitos
Resumir
Contexto
El producto de descarboxilación de la cisteína es la cisteamina, una amina biógena que es componente fundamental de la coenzima A. El producto de la transaminación de la cisteína es el mercaptopiruvato, el cual puede degradarse a piruvato o reducirse a mercaptolactato por diversas rutas posibles, dependiendo del organismo. Muchos microorganismos y plantas fijan aniones cianuro por sustitución nucleófila con el sulfhidrilo para dar como producto cianoalanina, la cual se puede hidrolizar a aspartato. El azufre de la cisteína puede metilarse para obtener un homólogo de la metionina llamado S-metilcisteína.[4][5]

Enzimas:
- EC 1.8.1.6 Cystina Reductasa
- EC 1.1.1.27 L-lactato deshidrogenasa
- EC 2.1.1.63 Cisteína S- Metiltransferasa
- EC 2.3.1.30 Serina O-acetiltransferasa
- EC 2.5.1.47 Cisteína sintasa (O-acetil-L-serina sulfhidrilasa)
- EC 2.6.1.3 Cisteína transaminasa
- EC 2.8.1.2 3-Mercaptopiruvato azufre transferasa
- EC 4.2.1.65 3-Cianoalanina hidratasa
- EC 4.4.1.8 Cistationina β-liasa
- EC 4.4.1.9 L-3-cianoalanina sintasa
- EC 4.4.1.15 D-cisteína desulfhidrasa
Hay un grupo de metabolitos que provienen de la oxidación del átomo de azufre de la cisteína. Dos ejemplos de estos metabolitos son la taurina y el ácido cisteico.

Enzimas:
- EC 1.8.1.3 Hipotaurina deshidrogenasa (HP-DH)
- EC 1.13.11.19 Cisteamina dioxigenasa (CYA-DO)
- EC 1.13.11.20 Cisteína dioxigenasa (Cys-DO)
- EC 4.1.1.29 Sulfoalanina descarboxilasa (SAlaD)
- EC 4.4.1.10 Cisteína liasa (CysL)
La cisteína puede conjugarse con un grupo alilo (de origen biosintético aún no reportado), para así dar la S-alilcisteína, la cual al oxidarse en el átomo de azufre genera la aliina, el precursor de los alil disulfuros y alilsulfóxidos que dan aroma a la cebolla y al ajo.[6]
Aplicaciones
La cisteína, principalmente como enantiómero L, es un precursor utilizado en la industria alimenticia, en la industria farmacéutica y en la industria del cuidado personal. Una de sus mayores aplicaciones es la producción de sabores.[7] Por ejemplo, la reacción de cisteína con azúcares en la reacción de Maillard produce sabores de la carne. En el campo de productos para el cuidado personal, la cisteína es usada como permanente predominantemente en Asia, ya que la cisteína es usada para romper los puentes disulfuros que se encuentran en la queratina del cabello. La cisteína es un objetivo muy popular en laboratorios a la hora de investigar estructuras biomoleculares. En 1994, en estudios en cinco de las principales compañías tabaqueras se observa que la cisteína es uno de los 599 aditivos de los cigarros. Como muchos aditivos del tabaco, su uso a propósito es desconocido.
Oveja
Las ovejas necesitan la cisteína para producir la lana. Para ellas es un aminoácido esencial que ha de ser ingerido comiendo hierba. Como consecuencia, durante etapas de sequía, las ovejas paran de producir lana. Sin embargo, han sido desarrolladas ovejas transgénicas que pueden producir su propia cisteína.
Reducción de los efectos tóxicos del alcohol
Resumir
Contexto
La cisteína ha sido propuesta como preventiva o antídoto para alguno de los efectos negativos del alcohol, incluyendo daños en el hígado o la resaca. La cisteína contrarresta los efectos dañinos del acetaldehído que es el mayor producto del metabolismo del alcohol y es responsable de la mayoría de los efectos tardíos del alcohol y de los daños de larga duración asociados con el uso de alcohol (pero no referidos a efectos inmediatos como la embriaguez). La cisteína supone el siguiente paso en el metabolismo, que significa convertir el acetilaldehído en el relativamente dañino ácido acético. En estudios a roedores, los animales testados recibieron dosis de LD50 de aldehído ( la cantidad que normalmente mata a la mitad de todos los animales).[8] Estos que recibieron cisteína tuvieron una cifra del 80 % de supervivencia, mientras que a los que se les añadió tiamina, sobrevivieron en su totalidad. Todavía no existe ninguna clara evidencia en contra de su efectividad en humanos que consumen alcohol en niveles normales.
N-acetilcisteína (NAC)
La N-acetil-L-cisteína (NAC) es un derivado de la cisteína en la que el grupo acetilo está unido al átomo de nitrógeno. Este compuesto puede ser considerado como un suplemento dietético, a pesar de que esta no es una vía ideal, ya que se cataboliza en el intestino. El NAC suele ser utilizado como medicina para la tos, ya que rompe los puentes disulfuros en la mucosa licuando esta, haciendo más sencilla su expulsión. También esta acción de romper los puentes disulfuros hace que el NAC sea muy útil a la hora de disminuir las anomalías en el grosor de la mucosa en pacientes que padecen fibrosis quística. El NAC también es usado como antídoto específico en casos de sobredosis de paracetamol.
Véase también
Referencias
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
