Loading AI tools
compuesto químico De Wikipedia, la enciclopedia libre
El nitrato de amonio o nitrato amónico es una sal formada por iones nitrato y amonio. Su fórmula es NH4NO3. Se trata de un compuesto incoloro e higroscópico, altamente soluble en agua. El nitrato de amonio es un compuesto inestable y suele ser utilizado como fertilizante. Se estima que la producción global fue de 21,6 millones de toneladas en 2017.[3]
| Nitrato de amonio | ||
|---|---|---|
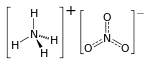 Estructura química. | ||
 Estructura tridimensional. | ||
 Sales de nitrato de amonio | ||
| Nombre IUPAC | ||
| Trioxidonitrato de amonio | ||
| General | ||
| Otros nombres |
Nitrato de amonio Nitrato amónico | |
| Fórmula estructural | Ver imagen | |
| Fórmula molecular | NH4NO3 | |
| Identificadores | ||
| Número CAS | 6484-52-2[1] | |
| Número RTECS | BR9050000 | |
| ChEBI | 63038 | |
| ChEMBL | CHEMBL1500032 | |
| ChemSpider | 21511 | |
| PubChem | 22985 | |
| UNII | T8YA51M7Y6 | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1720 kg/m³; 1,72 g/cm³ | |
| Masa molar | 80,043 g/mol | |
| Punto de fusión | 442 K (169 °C) | |
| Punto de ebullición | 483 K (210 °C) | |
| Punto de descomposición | 483 K (210 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua |
118 g/100 ml (0 °C) 150 g/100 ml (20 °C) 297 g/100 ml (40 °C) 410 g/100 ml (60 °C) 576 g/100 ml (80 °C) 1024 g/100 ml (100 °C)[2] | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0líquido | -359,6 kJ/mol | |
| ΔfH0sólido | -366 kJ/mol | |
| S0sólido | 151 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
2
3
OX
| |
| Riesgos | ||
| Ingestión | Peligroso en grandes cantidades. | |
| Inhalación | Muy peligroso, puede ser fatal. | |
| Piel | Puede causar irritación. | |
| Ojos | Puede causar irritación. | |
| LD50 | 2085–5300 mg/kg (oral en ratas) | |
| Más información | Hazardous Chemical Database (En inglés) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El nitrato de amonio se obtiene por neutralización de ácido nítrico con hidróxido de amonio tras la evaporación del agua:
En el laboratorio se puede obtener por doble descomposición entre sulfato de amonio (NH4)2SO4 y nitrato de estroncio [Sr(NO3)2], en disolución. Tras precipitar el sulfato de estroncio y filtrar la disolución que luego se evapora, se obtiene el nitrato de amonio en cristales o polvo blanco.
El nitrato de amonio se utiliza sobre todo como fertilizante por su buen contenido en nitrógeno. El nitrato es aprovechado directamente por las plantas mientras que el amonio es oxidado por los microorganismos presentes en el suelo a nitrito (nitrosomonas) o nitrato (nitrobacter) y sirve de abono de más larga duración.
Una parte de la producción se dedica a la producción del óxido nitroso (N2O) mediante la termólisis controlada:
Esta reacción es exotérmica y puede ser explosiva si se lleva a cabo en un contenedor cerrado o calentado demasiado rápido. En el año 2000 se realizó por parte de EFMA, un compendio de ocho volúmenes que presentaban los "Mejores procedimientos industriales disponibles para la prevención de la producción y el control en la industria de fertilizantes europea", en respuesta a las normativas europeas[4] y españolas.[5]
En la actualidad, existen en Europa, según EFMA, en torno a diez métodos diferentes para la producción industrial del nitrato de amonio en sus diferentes riquezas, no existe un único procedimiento que pueda ser considerado como el más ventajoso respecto al resto, debido fundamentalmente a dos razones:
Por ello se incidirá en primer lugar de manera general sobre cada uno de los pasos del proceso, estableciendo a continuación las mejores soluciones que existen para resolver los problemas planteados.
En México, es un producto regulado por la Secretaría de la Defensa Nacional (SEDENA) con medidas claras y rigurosas bajo la "Ley Federal de Armas de Fuego y Explosivos"[6] así como su Reglamento.[7]
El nitrato de amonio es un importante fertilizante etiquetado con el código NPK 34-0-0 (34% en nitrógeno).[8] Está menos concentrado que la urea (46-0-0), dando al nitrato de amonio una pequeña desventaja en el transporte. Como ventaja el nitrato amónico es más estable que la urea y no pierde rápidamente el nitrógeno en la atmósfera. Se sirve en gránulos compactos cuando se usa como fertilizante, lo cual mejora su estabilidad. La mayor parte de la producción se destina a este fin. La sal resultante del nitrato amónico al disolverse en agua puede ser absorbida con facilidad por las plantas.
El nitrato de amonio es un ingrediente en ciertos explosivos. Ejemplos de explosivos conteniendo nitrato amónico incluyen:
En estado puro es también un explosivo, aunque bastante insensible hasta que alcanza temperaturas elevadas. El aluminio en polvo mezclado le aporta energía a la onda de choque, pero con cierta disminución de la onda explosiva.
ANFO es un explosivo resultado de mezclar un 94% de nitrato amónico ("AN") y 6% de fuel oil ("FO") ampliamente usado como explosivo industrial.[9] Es utilizado en minería de carbón, minería a cielo abierto, minería de metal y obra civil donde las ventajas del bajo coste del ANFO y facilidad del uso superan a los beneficios ofrecidos por explosivos industriales convencionales, como son la resistencia al agua, el balance de oxígeno, la velocidad de detonación y su capacidad de trabajo en pequeños diámetros.[9]
El nitrato de amonio es también utilizado en:
El nitrato amónico es usado en algunos packs de frío instantáneo ya que diluido en agua es altamente endotérmico. También es usado, en combinación con explosivos "fuels" como el nitrato de guanidina[10][11] como un barato (pero menos estable) alternativa a la aminotetrazola-5, un inflador para airbags producido por la Corporación Takata. Posteriormente se descubrió que era inseguro al matar a 14 personas.[12]
Una solución de nitrato amónico con ácido nítrico conocida como Cavea-b se convirtió en una mezcla prometedora para ser usada como combustible para cohetes, al ser más energética que la hidracina. Después de algunos ensayos realizados en los años 1960 la sustancia no fue adoptada por la NASA.
La reacción entre el amoníaco y el ácido nítrico es irreversible, completa, instantánea, exotérmica y admite cualquier termodinámica o discusión cinética. El calor de reacción depende de la concentración de ácido nítrico usado y de la solución producida de nitrato de amonio, pues la disolución cuanto más concentrada está, mayor es el calor de reacción. Dicho calor de reacción se puede utilizar para producir la evaporación del agua de la solución de nitrato de amonio y además para producir vapor.
El nitrato de amonio puro sufre una descomposición endotérmica a 169 °C y tiene un punto de ebullición de 230 °C. La concentración del ácido nítrico usado normalmente es de 55 a 65 %, mientras su punto de ebullición a presión atmosférica es de 120 °C, más bajo por tanto que la solución producida de nitrato de amonio, soluciones altamente concentradas manifiestan altos puntos de ebullición y de congelación. Lo primero puede causar altas temperaturas y por tanto operaciones peligrosas y lo segundo bloqueo de las tuberías.
El nitrato de amonio conservado a 100 °C por un largo periodo de tiempo sufre una descomposición termal hacia amoníaco y ácido nítrico, descomposición que a más de 185 °C puede producir una explosión peligrosa. La solubilidad de amoníaco en agua decrece rápidamente cuando aumenta la temperatura y la alta volatilidad de los componentes y la descomposición de la sal producida conduce fácilmente a pérdidas ambientales y problemas de corrosión. El control de las variables de la reacción (temperatura, presión, calor utilizado y concentraciones de ácido nítrico y nitrato de amonio) y los detalles de construcción, logran la utilización del máximo calor, generándose una mezcla fundida sin adición de calor externo que al mismo tiempo asegura unas condiciones, todo con el mismo equipo y consumo de energía, en las que se consigue la mayor producción posible y una alta calidad del producto.
El proceso de obtención de nitrato de amonio básicamente consta de los siguientes pasos:
Es una reacción instantánea y altamente exotérmica, como se ha visto anteriormente, con un producto de reacción inestable pero podemos obtener una buena realización industrial cuando se dan las siguientes condiciones:
La temperatura de reacción se controla por medio de la debida regulación de la adición de los reactivos, por extracción del calor generado y en casos extremos, añadiendo agua (condensados) al contenido del neutralizador. Si bien pueden eliminarse prácticamente las pérdidas del ácido solo por medio del control de la temperatura de reacción, no ocurre lo mismo con las pérdidas de amoníaco, debido a su mayor volatilidad. Por esto, es necesario tomar medidas adicionales. En algunos procesos se añade, para este propósito un ligero exceso de ácido sobre la cantidad estequiométricamente requerida. En otros, el neutralizador funciona totalmente lleno de líquido, lo cual hace factible, mantener en él una presión de varias atmósferas, muy por encima de la presión de vapor de la solución.
En la práctica los procesos comerciales difieren en dos puntos principales, en la mezcla y en le control de la temperatura, siendo ésta la característica más importante. Los parámetros de la reacción y la construcción adoptada en la neutralización definen toda una línea de producción: ácido precalentado, evaporación de amoníaco y evaporación del agua restante (parcial o totalmente) puede ser realizados mediante el calor recuperado en la neutralización.
Se dividen los neutralizadores en tres grupos de acuerdo con la temperatura de la zona de reacción, los cuales pueden trabajar:
Neutralizadores que trabajan por debajo del punto de ebullición atmosférico, son métodos de baja temperatura y presentan ventajas tales como:
También tienen algunos inconvenientes, como:
Neutralizadores que trabajan en el punto de ebullición atmosférico, no utilizan recirculación de la solución de nitrato de amonio, por lo tanto la reacción estará menos controlada al ser muy exotérmica y brusca, si se recircula la solución esta absorbe parte del calor y se controla esta brusquedad, evitándose las pérdidas de nitrógeno que podrían originarse. Aunque su temperatura es mayor que la de los neutralizadores anteriores, en torno a 150 y 200 °C, presenta ventajas como:
El inconveniente principal es la contaminación del vapor de proceso con amoníaco y ácido nítrico, con lo que se necesitan equipos de acero inoxidable. Los neutralizadores sobre el punto de ebullición atmosférico son los más adecuados para un buen proceso de producción.
Los neutralizadores que trabajan sobre el punto de ebullición atmosférico, la característica común de todo diseño en este grupo es que la presión aplicada generalmente entre 2 y 6 bar se emplea para levantar la temperatura en el neutralizador hasta 180 °C aproximadamente. A presiones y temperaturas más elevadas se causan mayores pérdidas y más corrosión, siendo necesarios equipos especiales.
Se distinguen los siguientes tipos de neutralizadores:
Los dos primeros casos no se usan en plantas modernas, es decir, por lo menos una parte de los vapores producidos son utilizados en procesos de la misma planta.
Como el factor determinante en la recuperación de calor es el neutralizador, las condiciones de operación del neutralizador definirán la presión de los vapores en el mismo y por tanto su temperatura de condensación, que es el parámetro usado en la anterior clasificación. Por lo tanto parece más apropiado agrupar los procesos de acuerdo con la presión de los vapores producidos en el neutralizador, así existirán:
En este tipo de neutralizadores, cuando el amoníaco y el ácido nítrico reaccionan, el calor de reacción comienza a aumentar incrementando la temperatura de la mezcla hacia su punto de ebullición, donde comenzará la evaporación y la temperatura seguirá su incremento hasta el punto donde el agua presente, se evapore consumiendo el calor de la reacción sobrante del calentamiento de la mezcla.
Para trabajar en torno a este punto, todos los procesos utilizan sistemas de recirculación, donde una parte del nitrato de amonio producido se enfría y es recirculado al neutralizador, provocando así un control más fino de la temperatura en el neutralizador. Dicho enfriamiento y la relación de recirculación definirán la temperatura en el neutralizador. Este tipo de neutralizadores mantiene la temperatura en torno a 100 y 120 °C, pero se hace necesario utilizar el calor de la reacción para evaporar una parte del agua contenida en el producto, es decir, se obtienen concentraciones bajas de productos. Este tipo de neutralizadores suelen ser del tipo neutralizadores vacuum flash o a vacío, pudiéndose llevar a cabo en una o varias etapas, así se pueden distinguir:
Estos equipos son más simples que los anteriores, trabajan a mayores temperaturas (en torno a los 150 y 200 °C) producirán una corriente de vapor que contendrá la mayor parte del agua introducida por el ácido nítrico, que se utilizará para el precalentamiento de las materias primas.
Con concentraciones de ácido nítrico en torno al 60% w se pueden lograr concentraciones en torno al 98% w de nitrato de amonio, aunque se suele utilizar un pequeño evaporador posteriormente al neutralizador. Para lograr un mejor control de pH se usan dos neutralizadores en serie, siendo el segundo más pequeño que el primero, para lograr un ajuste más fino.
Se pueden distinguir dos tipos de procesos a sobrepresión:
Se suelen llevar a cabo entre 4 y 6 atm, dependiendo del proceso industrial. La presión sirve para aumentar la temperatura en el mismo alrededor de los 200 °C. Dentro de este grupo se pueden mostrar los procesos Fauser y Stengel.
Los distintos procedimientos difieren el contenido en agua de los reactivos (por lo tanto de la concentración de nitrato de amonio que salga de la sección de neutralización), de la cantidad de agua requerida en los siguientes procesos de solidificación del producto final y del control de las temperaturas.
En los métodos utilizados hasta 1945, la solución neutralizada de nitrato de amonio sufría una evaporación hasta una concentración elevada, seguida de un enfriamiento consecutivo y la formación del producto. Otros métodos realizaban la evaporación hasta una menor concentración y completaban la misma mediante cristalización o evaporación continua en aparatos diseñados a tal efecto, dicha evaporación también se hacía mediante evaporadores de película (wiped film) que tenían la ventaja de contener pesos muy bajos de materia en tratamiento.
Después de 1965, eficaces evaporadores que operan al vacío se han utilizado en nuevas fábricas, estas modernas unidades tienen una mayor eficiencia térmica y pueden controlarse con precisión. La parte de la unidad donde la concentración es mayor al 99% w de nitrato de amonio, es diseñada para retener únicamente pequeñas cantidades de solución concentrada por cuestiones de seguridad. Estas precauciones son necesarias parra evitar la contaminación de la solución por materias orgánicas y su posible explosión.
Las soluciones de nitrato de amonio pueden variar entre el 78 y 98% w, y los procesos de solidificación pueden trabajar con melazas desde el 5% w de agua (en los granuladores de tambor) hasta de 0,3 a 0,5% w de agua (en torres prilling), por ello que en la industria existan cientos de evaporadores, cada uno ajustado lo más posible a las necesidades impuestas por el producto requerido.
El 12 de agosto de 2015 ocurrió una explosión en un almacén del puerto de la ciudad de Tianjin.[15] La explosión dejó 173 muertos, 28 desaparecidos y 797 heridos. Las autoridades chinas determinaron que la explosión ocurrió por el incendio de materiales peligrosos, entre los cuales se incluía el nitrato de amonio.[16]

El 4 de agosto de 2020 ocurrió una explosión en un almacén que contenía 2750 toneladas de nitrato de amonio que habían sido confiscadas por el gobierno y almacenadas en el Puerto de Beirut.[17][18] Se han confirmado al menos 158 muertos, 6000 heridos y varios desaparecidos.[19] La explosión tuvo una equivalencia a unos cientos de toneladas de TNT.[20]
En 1995 en la ciudad de Oklahoma un estadounidense llamado Timothy McVeigh llenó un camión con dos toneladas de nitrato de amonio y lo hizo explotar frente a un edificio gubernamental de la ciudad provocando 168 muertos y 600 heridos.[21]
En 2011 Anders Breivik, también hizo explotar nitrato amónico en Oslo, el mismo día que cometió los atentados de la isla de Utoya.[22]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.