Kalia ditionito aŭ K2S2O4 estas neorganika salo de kalio, sulfuro kaj oksigeno, flavecaj kristaloj kun malforta sulfurodoro, stabila substanco en normalaj kondiĉoj kiu malkomponiĝas en varma akvo kaj acidaj solvaĵoj.
| Kalia ditionito |
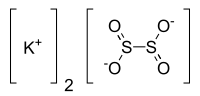 |
Plata kemia strukturo de la
Kalia ditionito |
 |
Tridimensia kemia strukturo de la
Kalia ditionito |
| Alternativa(j) nomo(j) |
- Dutionito de kalio
- Kalia salo de ditionita acido
- Hidrosulfito de kalio* Kalia hidrosulfito
- Hiposulfito de kalio* Kalia hiposulfito
|
| Kemia formulo | K2S2O4 |
| CAS-numero-kodo | 14293-73-3 |
| ChemSpider kodo | 55625 |
| PubChem-kodo | 61726 |
| Fizikaj proprecoj |
| Aspekto | klarflava pulvoro |
| Molmaso | 206313 g·mol−1 |
| Denseco | 2,5g cm−3 |
| Bolpunkto | 300 °C (malkomponiĝas) |
| Ekflama temperaturo | 100 °C |
| Memsparka temperaturo | 190 °C[1] |
| Solvebleco | Akvo:50 g/L [2] |
| Mortiga dozo (LD50) | 100 mg/kg (buŝe) |
| Sekurecaj Indikoj |
| Riskoj | R7 R22 R31 |
| Sekureco | S7/8 S26 S28 S43 |
| Pridanĝeraj indikoj |
| Danĝero
|
| GHS Damaĝo Piktogramo |
|
| GHS Signalvorto | Damaĝa substanco |
| GHS Deklaroj pri damaĝoj | H251, H302, H411 |
| GHS Deklaroj pri antaŭgardoj | P235+410, P264, P270, P273, P280, P301+312, P330, P391, P407, P410, P420, P501 |
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo
(25 °C kaj 100 kPa) |
Kelkfoje ĉi-varmo sufiĉas por bruligi la ĉirkaŭantajn oksidivajn materialojn. Ĝi estas akvosolvebla, kaj sub longedaŭra ekspozicio al fajro aŭ apudeco al varmaj enhavaĵoj, ĉi-materialo povas subite rompiĝi. Ĝi same uzatas en tinkturoj kaj blankigo de ligna pulpo.
Sintezo 1
 |
|
Sintezo 2
 |
|
Sintezo 3
 |
|
Sintezo 4
 |
|
Sintezo 5
  |
|
Sintezo 6
 |
|
Sintezo 7
- Poste, la zinka ditionito reakcias kun kalia hidroksido por estigi la kalian ditioniton.
 |
|
Reakcio 1
- Ĝi malkomponiĝas kiam hejtata:
 |
|
Reakcio 2
- La kristala salo estiĝas per hejtado de etanola solvaĵo:
 |
|
Reakcio 3
- Per hejtata akvo ĝi suferas disproporcion:
 |
|
Reakcio 4
- Ĝi malkomponiĝas en la ĉeesto de acido, malvarme:
 |
|
Reakcio 5
 |
|
Reakcio 6
- Ĝi spontanee oksidiĝas per la atmosfera oksigeno:
 |
|
Reakcio 7
 |
|
Reakcio 8
- Ĝi restarigas la metalojn malpli aktivajn:
 |
|

