Remove ads
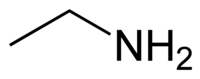
Η αιθαναμίνη ή αιθυλαμίνη[1] (αγγλικά: ethanamine, ΜΕΑ: MonoEthylAmine) είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και άζωτο, με μοριακό τύπο C2H7N, αν και συχνά γράφεται με τις πιο αναλυτικές (ημισυντακτικές) μορφές C2H5NH2, CH3CH2NH2 ή και συντομογραφικά EtNH2. Η χημικά καθαρή αιθαναμίνη, στις «συνηθισμένες συνθήκες», δηλαδή θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο αέριο με έντονη οσμή, που μοιάζει μ' αυτήν της αμμωνίας. Αν υγροποιηθεί, γίνεται ένα ανοιχτοκίτρινο υγρό. Είναι αναμείξιμη με σχεδόν όλους τους διαλύτες και συμπεριφέρεται ως ασθενής βάση, αφού είναι μια πρωτοταγής αμίνη, με pKa (της πρωτονιομένης μορφής της) περίπου ίσο με 10,7[2]. Η αιθαναμίνη χρησιμοποιείται ευρύτατα στη χημική βιομηχανία και στην οργανική σύνθεση. Η αιθαναμίνη έχει βρεθεί ως ένα συστατικό των αερίων του διαστρικού μέσου[3].
| Αιθαναμίνη | |||
|---|---|---|---|
 | |||
 | |||
 | |||
 | |||
| Γενικά | |||
| Όνομα IUPAC | Αιθαναμίνη | ||
| Άλλες ονομασίες | Αιθυλαμίνη Μονοαιθυλαμίνη Αμινοαιθάνιο 1-αζαπροπάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H7N | ||
| Μοριακή μάζα | 45,08 amu | ||
| Σύντομος συντακτικός τύπος | CH3CH2NH2 | ||
| Συντομογραφίες | EtNH2 MEA | ||
| Αριθμός CAS | 75-04-7 | ||
| SMILES | CCN | ||
| InChI | 1/C2H7N/c1-2-3/h2-3H2,1H3 | ||
| Αριθμός EINECS | 200-834-7 | ||
| Αριθμός RTECS | KH2100000 | ||
| PubChem CID | 6341 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 Διμεθυλαμίνη | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -81 °C | ||
| Σημείο βρασμού | 16,6 °C | ||
| Πυκνότητα | 689 kg/ m³ | ||
| Διαλυτότητα στο νερό | Αναμίξιμη | ||
| Τάση ατμών | 121 kPa (20 °C) | ||
| Εμφάνιση | Ανοιχτοκίτρινο υγρό (Κ.Σ.) | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης | -178 °C | ||
| Σημείο αυτανάφλεξης | 385 °C | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | R12, R20, R22, R34, R36 R37, R38 | ||
| Φράσεις ασφαλείας | S16, S26, S29 | ||
| Κίνδυνοι κατά NFPA 704 | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Remove ads
Η ονομασία «αιθαναμίνη» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «αιθ-» δηλώνει την παρουσία δύο (2) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-αμίνη» φανερώνει ότι περιέχει μια αμινομάδα ως κύρια χαρακτηριστική ομάδα.
Η ονομασία «αμινοαιθάνιο» θεωρεί ότι η ένωση είναι υποκατεστημένο αιθάνιο, δηλαδή αιθάνιο, ένα άτομο υδρογόνου του οποίου, έχει αντικατασταθεί από μια αμινομάδα (-NH2).
Η ονομασία «1-αζαπροπάνιο» είναι «ονομασία αντικατάστασης», δηλαδή ότι η ένωση είναι προπάνιο του οποίου το #1 άτομο άνθρακα αντικαταστάθηκε από άτομο αζώτου[4].
Έχει ένα ισομερές θέσης, τη διμεθυλαμίνη [(CH3)2NH], μια δευτεροταγή αμίνη.m³
Remove ads
Η δομή της μπορεί να βρεθεί αν αντικατασταθεί ένα άτομο υδρογόνου από ένα μόριο αμμωνίας με αιθύλιο ή αντιστοίχως αν αντικατασταθεί ένα άτομο υδρογόνου από ένα μόριο αιθανίου από αμινομάδα.
Remove ads
Με αιθανόλη και αμμωνία
Η αιθυλαμίνη παράγεται βιομηχανικά συνήθως με επίδραση αμμωνίας (NH3) σε αιθανόλη (CH3CH2OH) με την παρουσία καταλύτη[6]:
- Συμπαρασκευάζονται διαιθυλαμίνη και τριαιθυλαμίνη. Η χημική κινητική καθορίζει την τελική αναλογία αυτών των προϊόντων.
Με χλωριούχο αμμώνιο και αιθανάλη
Με επίδραση χλωριούχου αμμωνίου (NH4Cl) σε αιθανάλη (CH3CHO) παράγεται αρχικά υδροχλωρική αιθανιμίνη (CH3CH=NH2Cl) και έπειτα υδροχλωρική αιθαναμίνη. Η τελευταία με υδροξείδιο του νατρίου (NaOH) δίνει καθαρή αιθαναμίνη[7]:
- Μια παραλλαγή της παραπάνω είναι η επίδραση αμμωνίας σε αιθανάλη, που δίνει αιθανιμίνη, και στη συνέχεια αιθαναμίνη, με υδρογόνωση της τελευταίας:
Με αμμωνία και αιθυλαλογονίδιο
Με επίδραση αμμωνίας (NH3) σε αιθυλαλογονίδιο (CH3CH2X, μέθοδος Hofmann)[8]:
- Συμπαράγονται διαιθυλαμίνη και τριαιθυλαμίνη. Η χημική κινητική καθορίζει την τελική αναλογία αυτών των προϊόντων.
- Σύμφωνα με μια παραλλαγή, η αντίδραση επιταχύνεται με την επιπλέον χρήση υδροξειδίου του καλίου[9]:
Με αιθυλίωση φθαλιμιδικού καλίου
Με αιθυλίωση φθαλιμιδικού καλίου (σύνθεση Gabriel)[10]:
Με αναγωγή αζωτούχων ενώσεων
1. Με αναγωγή νιτραιθανίου (CH3CH2NO2)[11]:
2. Με αναγωγή αιθανονιτρίλιου (CH3CN)[12]
3. Με αναγωγή αιθανιμίνης (CH3CH=NH)[13]:
Με αποικοδόμηση προπαναμιδίου
Με αποικοδόμηση προπαναμιδίου (CH3CH2CONH2, μετάθεση Hofmann)[14]:
- Το BrOK παράγεται επιτόπου («in citu») με την αντίδραση:
Με χλωραμίνη σε αιθυλομαγνησιοαλογονίδιο
Με επίδραση χλωραμίνης (NH2Cl) σε αιθυλομαγνησιοαλογονίδιο (CH3CH2MgX)[15]:
Με προσθήκη αμμωνίας σε αιθένιο
Με προσθήκη αμμωνίας (NH3) σε αιθένιο (CH2=CH2), παράγεται αιθαναμίνη[16]:
Με προσθήκη υδρογόνου σε αζιριδίνη
Με καταλύτική προσθήκη υδρογόνου σε αζιριδίνη παράγεται αιθαναμίνη[17]:
Remove ads
Η αιθαναμίνη δίνει τις αντιδράσεις που αντιστοιχούν σε πρωτοταγή αλκυλαμίνη, όπως η πρωτονίωση, η ακυλίωση και άλλες. Δείτε παρακάτω:
Συμπεριφορά βάσης
Αλκυλίωση
Αντιδρά με αλκυλαλογονίδια (RX), παράγοντας δευτεροταγείς αμίνες:
Ακυλίωση
Αντιδρά με ακυλαλογονίδια (RCOX), παράγοντας δευτεροταγή αμίδια:
Ιμίνες
Με καρβονυλικές ενώσεις δίνει ιμίνες. Π.χ. με αλδεΰδες (RCHO):
Οξείδωση
1. Οξείδώνεται με υπεροξείδιο του υδρογόνου (H2O2) παράγοντας νιτραιθάνιο:
2. Με επίδραση ισχυρότερου οξειδωτικού, όπως το υπερμαγγανικό κάλιο (KMnO4), παράγεται αιθανάλη:
Προσθήκη
1. Προσθήκη σε διπλούς δεσμούς. Π.χ. με αιθένιο δίνει N-αιθυλαιθαναμίνη:
2. Προσθήκη σε τριπλούς δεσμούς. Π.χ. με αιθίνιο δίνει αρχικά N-αιθυλαιθεναμίνη και τελικά την ταυτομερή της N-αιθυλαιθανιμίνη:
3. Προσθήκη σε συζηγείς διπλούς δεσμούς. Π.χ. με 1,3-βουταδιένιο δίνει N-αιθυλο-1-βουτεν-2-αμίνη:
4. Προσθήκη σε ενώσεις με τριμελείς ή τετραμελείς ισοκυκλικούς δακτυλίους. Π.χ. με κυκλοπροπάνιο δίνει Ν-αιθυλο-1-προπαναμίνη::
5. Προσθήκη σε ενώσεις με τριμελείς ή τετραμελείς ετεροκυκλικούς δακτυλίους. Π.χ. με οξιράνιο δίνει 2-αιθυλαμιναιθανόλη[18]:
Παραγωγή αιθανόλης
Με επίδραση νιτρώδους οξέος (ΗΝΟ2) σε αιθαναμίνη, παράγεται αιθανόλη[19]:
Παραγωγή διαιθυλοδιαζένιου
Με επίδραση θειονυλοχλωρίδιου και οξείδωση του παραγώμενου θειοναμίδιου παράγεται διαιθυλοδιαζένιο[20]:
Επίδραση καρβενίων
Παρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγονται 1-προπαναμίνη, 2-προπαναμίνη και αιθυλομεθυλαμίνη[21]:
Remove ads
Η αιθαναμίνη, όπως και μερικές άλλες σχετικά χαμηλής μοριακής μάζας πρωτοταγείς αμίνες, είναι ένας καλός διαλύτης για το μεταλλικό λίθιο, σχηματίζοντας ένα ιόν της μορφής [Li(CH3CH2NH2)4]+ και ένα «επιδιαλυτωμένο» ηλεκτρόνιο. Αργότερα, όταν χρειάζεται, η εξάτμιση της αιθαναμίνης δίνει πίσω το μεταλλικό λίθιο. Τέτοια διαλύματα χρησιμοποιούνται για την αναγωγή ακόρεστων οργανικών ενώσεων, όπως το ναφθαλίνιο[22] και διάφορα αλκίνια. Η αιθαναμίνη είναι η πρόδρομη ένωση για πολλά φυτοφάρμακα, που περιλαμβάνουν την ατραζίνη και τη σιμαζίνη. Βρέθηκαν επίσης εφαρμογές της αιθαναμίνης και σε προϊόντα ελαστικών.
Η αιθαναμίνη χρησιμοποιήθηκε ως πρόδρομη ένωση, μαζί με το βενζονιτρίλιο, στην κλαντεσινική σύνθεση της κυκλιδίνης, που είναι ένα αναισθητικό, στενά συσχετισμένο με την κεταμίνη, που είναι ένα πιο γνωστό αναισθητικό. Ομοίως, είναι πρόδρομη ένωση και της φαινοκυκλιδίνης, που είναι ψυχαγωγικό ναρκωτικό. Για λόγο αυτό έχει βρεθεί στη μαύρη αγορά, όπως και για τη χρήση της για την παραγωγή των επίσης ψυχαγωγικών ναρκωτικών αλλουκινογόνο και τρανκουΐλιζερ. Αυτή η παραγωγή κυκλιδίνης γίνεται με τον ίδιο μηχανισμό με τη δράση της κεταμίνης (με ανταγωνισμό του υποδοχέα NMDA), αλλά με μεγαλύτερο δυναμικό στο τυφλό σημείο PCP, μεγαλύτερη ημιζωή, και σημαντικά πιο έντονα συμπαθομιμητικά φαινόμενα[23].
Remove ads
Remove ads
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
Remove ads


![{\displaystyle \mathrm {NH_{4}Cl+CH_{3}CHO{\xrightarrow {}}CH_{3}CH=NH_{2}Cl+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{+CH_{3}CHO}}CH_{3}CH_{2}NH_{3}Cl{\xrightarrow {+NaOH}}CH_{3}CH_{2}NH_{2}+NaCl+H_{2}O} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/f18654788696cae475066ba0cb21a78d8b3d968d)






![{\displaystyle \mathrm {{\xrightarrow[{+2H_{2}O}]{H^{+}}}CH_{3}CH_{2}NH_{2}+} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/0e32a6df0663ec723e0b056d66a329f90f281471)























