Tollwut
Virusinfektion Aus Wikipedia, der freien Enzyklopädie
Die Tollwut (Kompositum aus „toll“, mittelhochdeutsch für „nicht bei Sinnen“, und „Wut“), auch Rabies (von lateinisch rabere, „toll sein“) und Lyssa (von griechisch Λύσσα, „rasend“) genannt, früher auch Hundswut, Wutkrankheit und Hydrophobia, ist eine seit dem Altertum bekannte akute Infektionskrankheit durch das Rabiesvirus, die bei gleichwarmen Tieren eine tödliche (infauste) Gehirnentzündung verursacht und in der Regel durch den Biss eines tollwutkranken Tieres übertragen wird.
| Klassifikation nach ICD-10 | |
|---|---|
| A82.- | Tollwut [Rabies] |
| A82.0 | Wildtier-Tollwut |
| A82.1 | Haustier-Tollwut |
| A82.9 | Tollwut, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Die meisten Säugetiere und viele Vogelarten können sich mit dem Rabiesvirus infizieren, auf Pflanzenfresser wird die Infektion aber seltener übertragen als auf Fleischfresser. Rotfüchse, Hunde, Katzen, Fledermäuse, Frettchen, Dachse, Waschbären und Wölfe waren bis zur weitgehenden Ausrottung der Krankheit durch die Wildtier-Schluckimpfung in Europa die klassischen Tollwutüberträger. Hauptüberträger war dabei der Rotfuchs, er ist bis heute das stereotype Bild eines tollwütigen Tieres mit Schaum vor dem Maul. Tollwut kann sich allerdings auch in einer „paralytischen“ Form zeigen, bei welcher sich das erkrankte Tier ruhig, zurückgezogen oder unnatürlich zahm verhält, ohne die übliche Scheu vor dem Menschen. Außerhalb Europas kommen weitere Arten als wichtige Überträger in Frage, beispielsweise stellen in Indien streunende Hunde eine Hauptinfektionsquelle dar.
Eichhörnchen, andere Nagetiere und Kaninchen werden dagegen sehr selten angesteckt. Auch Vögel bekommen selten Tollwut, da ihre Körpertemperatur meist etwas oberhalb des Optimums für das Virus liegt. Womöglich überleben diese kleineren Arten räuberische Angriffe nur selten und erreichen damit gar nicht das erste Krankheitsstadium.
Nach einer Schätzung der WHO von 2018 sterben jährlich 59.000 Menschen an Tollwut, davon 60 % in Asien und 36 % in Afrika.[1] Indien ist das Land mit den meisten tollwutbedingten Todesfällen, es hat 35 % aller Fälle weltweit.[2] In Deutschland sind zwischen 1977 und 2000 fünf Fälle von Tollwut registriert worden, von denen drei ihren Ursprung im Ausland hatten. In ganz Europa waren es in diesem Zeitraum 281 Fälle.[3] Weltweit werden jährlich mehr als 15 Millionen Menschen aufgrund des Verdachts einer Tollwutinfektion geimpft, wodurch schätzungsweise 327.000 tollwutbedingte Todesfälle verhindert werden.[4] Ohne Schutzimpfung oder Postexpositionsprophylaxe (PEP) verläuft eine Tollwutinfektion innerhalb von 15 bis 90 Tagen – von sehr seltenen Einzelfällen abgesehen[5] – tödlich.[6] Die Postexpositionsprophylaxe ist nur innerhalb von 24 Stunden nach der Infektion wirksam, je früher, desto besser.
Erreger
Zusammenfassung
Kontext
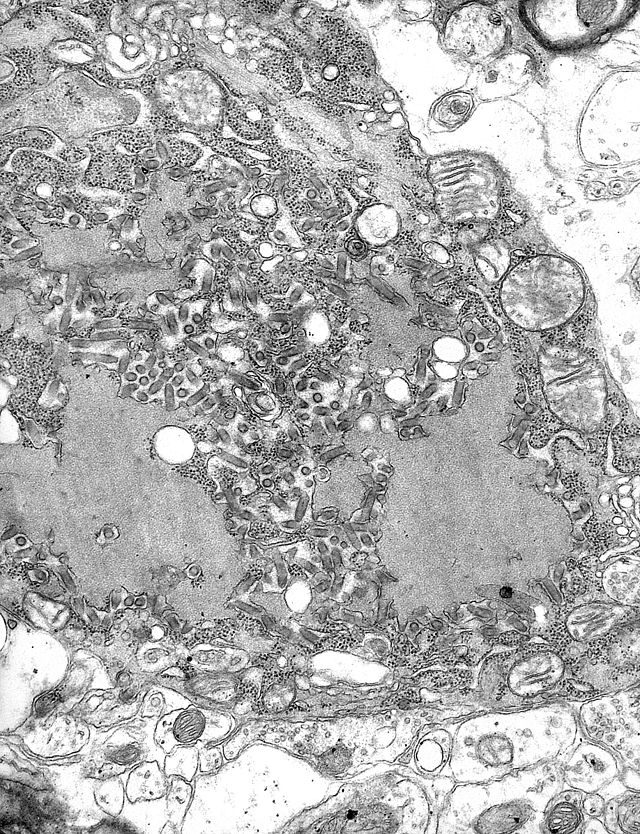
Die Tollwut wird von Viren der Gattung Lyssaviren aus der Familie der Rhabdoviridae verursacht. Dabei handelt es sich um behüllte Viren von zylindrischer Form, deren Genom als einzelsträngige RNA mit negativer Polarität vorliegt. Dies steht im Gegensatz zu anderen Viren, die den Menschen befallen, die normalerweise eine kubische Symmetrie haben. Bei all diesen Erregern werden derzeit insgesamt sieben Genotypen unterschieden:
- Genotyp 1: Rabiesvirus (RABV). Dieses Virus ist das klassische Tollwutvirus.
- Genotyp 2: Lagos-Fledermausvirus = Lagos bat virus (LBV)
- Genotyp 3: Mokola-Virus (MOKV)
- Genotyp 4: Duvenhage-Virus (DUVV)
- Genotypen 5 und 6: Europäisches Fledermaus-Lyssavirus = European bat lyssavirus (EBLV 1, 2)
- Genotyp 7: Australisches Fledermaus-Lyssavirus = Australian bat lyssavirus (ABLV)
Außer beim Genotyp 2 sind bei allen oben aufgezählten Genotypen Tollwutfälle beim Menschen beschrieben.
Die Transkription und Replikation der Viren finden im Zytoplasma der Wirtszelle innerhalb spezieller „Virenfabriken“ statt, den so genannten Negri-Körpern oder Negrischen Einschlusskörperchen (benannt nach ihrem Entdecker, dem Pathologen Adelchi Negri, der sich ab 1903 mit der Erforschung der Tollwut befasste und die nach ihm benannten Körperchen in den Ganglienzellen des Gehirns fand).[7][8] Sie haben einen Durchmesser von 2–10 µm und sind typisch für die Tollwutinfektion, so dass sie als pathognomonisches Merkmal dienen.[9]
Übertragung
Zusammenfassung
Kontext
99 % der weltweiten Fälle bei Menschen werden durch den Hund übertragen. In den USA hingegen gingen in den letzten Jahren die meisten Fälle auf Bisse von Fledermäusen zurück und diese stellen auch in Australien, Lateinamerika und Westeuropa ein gewisses Gesundheitsrisiko dar. Kontakte mit wildlebenden mit Tollwut infizierten Raubtieren wie Fuchs, Waschbär, Stinktier, Schakal, Kojote, Wolf oder Mungo können ebenso diese Erkrankung bei Menschen auslösen.[4]
Das Virus ist im Speichel eines tollwütigen Tieres vorhanden und der Infektionsweg führt üblicherweise über einen Biss oder eine Kratzwunde. Auch durch direkten Kontakt von infiziertem Speichel mit Schleimhäuten ist eine Übertragung möglich.[4] In vitro ist eine Übertragung durch Schleimhäute vorgekommen. Möglicherweise geschah eine Übertragung in dieser Form bei Menschen, die von Fledermäusen bevölkerte Höhlen erforschten. Außer bei der Organtransplantation (drei Fälle in den USA[10] zu Beginn des Jahres 2004 und drei Fälle in Deutschland Anfang 2005)[11] ist die Übertragung von Mensch zu Mensch durch Bisse, wenngleich grundsätzlich möglich, bislang nicht beobachtet worden.
Von der Eintrittsstelle wandert das Virus entlang der Nervenzellen in das Zentralnervensystem (ZNS). Der retrograde axonale Transport ist der wichtigste Schritt in der natürlichen Tollwut-Infektion. Die genauen molekularen Grundlagen dieses Transports sind noch nicht geklärt, aber es wurde nachgewiesen, dass das Protein P des Rabiesvirus mit dem Protein DYNLL1 (LC8) der leichten Kette von Dynein interagiert.[12] P agiert auch als Interferonantagonist, wodurch die Immunantwort abgemildert wird.[13]
Vom ZNS breitet sich das Virus auch in andere Organe aus, so tritt es im Speichel infizierter Tiere auf und kann sich dadurch weiterverbreiten. Oftmals tritt eine erhöhte Aggressivität mit verstärktem Beißverhalten auf, welches die Wahrscheinlichkeit, das Virus weiter zu verbreiten, erhöht.
Krankheitsverlauf und Symptome
Zusammenfassung
Kontext
Krankheitsverlauf beim Menschen
Nach der Infektion eines Menschen durch den Biss eines infizierten Tieres bleibt das Virus für etwa drei Tage in der Nähe der Eintrittspforte, wird dort vermehrt und gelangt dann über das Innere der Nervenfasern der peripheren Nerven bis in das Rückenmark und schließlich ins Gehirn. Vom Zentralnervensystem aus breitet sich das Virus entlang peripherer Nerven und Hirnnerven unter anderem auch zu Speicheldrüsen und Tränendrüsen aus und wird mit deren Sekreten ausgeschieden.[14] Ist das Virus dagegen durch den Biss direkt in die Blutbahn gelangt, erreicht es das Zentralnervensystem sehr viel schneller. Sobald das Virus das Zentralnervensystem erreicht hat, ist eine Impfung nicht mehr wirksam, daher sollte eine postexpositionelle Impfung schnellstmöglich (innerhalb weniger Stunden) erfolgen. Da die Inkubationszeit allerdings auch sehr lang sein kann, hat eine postexpositionelle Impfung auch noch nach Monaten möglicherweise noch eine Wirkung, sofern die Krankheit noch nicht ausgebrochen ist.[15]

Die Inkubationszeit – also der Zeitraum zwischen der Infektion und den ersten, erkältungsähnlichen Symptomen – liegt zwischen fünf Tagen und mehreren Jahren, meist beträgt sie zwei bis drei Monate. Die Dauer hängt von der Lokalisation der Bissstelle, der Virusunterart und dem Immunsystem des Betroffenen ab.[16]
Das Virus verursacht eine Gehirnentzündung (Enzephalitis), worauf die typischen Symptome zurückzuführen sind. Es kann auch das Rückenmark befallen werden, was sich in einer Rückenmarksentzündung (Myelitis) äußert. Bei der Übertragung durch einen Biss in Arm oder Bein äußern sich häufig zuerst Schmerzen an der gebissenen Extremität. Sensibilitätsverlust entsprechend der Hautdermatome ist regelmäßig beobachtet worden. Daher werden viele, vor allem atypische Krankheitsverläufe zunächst als Guillain-Barré-Syndrom falsch diagnostiziert. Bald danach steigern sich die zentralnervösen Symptome wie Lähmungen, Angst, Verwirrtheit, Aufregung, weiter fortschreitend zum Delirium, zu anormalem Verhalten, Halluzinationen und Schlaflosigkeit. Die Lähmung der hinteren Hirnnerven (Nervus glossopharyngeus, Nervus vagus) führt zu einer Rachenlähmung, verbunden mit einer Unfähigkeit zu sprechen oder zu schlucken – dies ist während späterer Phasen der Krankheit typisch.
Der Anblick von Wasser kann Anfälle von Hydrophobie mit Krämpfen des Rachens und Kehlkopfs hervorrufen. Der stark vermehrte Speichelfluss (Hypersalivation) kann bald nicht mehr abgeschluckt werden und bildet Schaum vor dem Mund. Die Schluckbehinderung verhindert die Verdünnung des Virus, was seine Virulenz erhöht. Geringste Umweltreize wie ein Anemophobie auslösender Luftzug, z. B. durch einen Ventilator,[17] oder Geräusche und Licht führen zu Wutanfällen, Schreien, Schlagen und Beißen, bei letzterem wird das hochkonzentrierte Virus schließlich übertragen.
Die Erkrankung kann auch in der „stummen“ Form verlaufen, bei der ein Teil der genannten Symptome fehlt. Jedoch findet sich unabhängig von der Verlaufsform bei der Bildgebung mit dem Kernspintomographen eine Aufhellung in der Region des Hippocampus und am Nucleus caudatus. Praktisch immer tritt zwei bis zehn Tage nach den ersten Symptomen der Tod ein, bei den wenigen Überlebenden blieben in der Regel schwerste Gehirnschäden zurück. Im Jahr 2012 wurden bei indigenen Gemeinschaften der zwei Urwalddörfer Truenococha und Santa Marta im peruanischen Amazonasgebiet erstmals Hinweise auf mögliche Tollwut-Resistenzen beim Menschen gefunden.[18]
Krankheitsverlauf bei Wildtieren und Haustieren
An Tollwut können alle Säugetiere und bedingt auch Vögel erkranken. Die Inkubationszeit beträgt im Regelfall zwei bis acht Wochen. Die Erkrankung dauert zwischen einem Tag und einer Woche und endet immer tödlich. Zu den ersten Symptomen gehören meist Wesensveränderungen.

Erkrankte Haushunde können dabei besonders aggressiv und bissig werden, sind übererregt, zeigen einen gesteigerten Geschlechtstrieb und bellen grundlos („rasende Wut“). Später stellen sich Lähmungen ein, die zu heiserem Bellen, Schluckstörungen (starkes Speicheln, Schaum vor dem Maul), Heraushängen der Zunge führen und infolge Lähmung der Hinterbeine kommt es zum Festliegen. Die Phase der „rasenden Wut“ kann auch fehlen und die Tollwut gleich mit den Lähmungserscheinungen beginnen („stille Wut“). Es kommen auch atypische Verläufe vor, die zunächst einer Magen-Darm-Kanal-Entzündung (Gastroenteritis) gleichen.[19]
Bei der Hauskatze gleicht das klinische Bild dem des Hundes. Häufig zieht sich eine erkrankte Katze zurück, miaut ständig und reagiert aggressiv auf Reizungen. Im Endstadium kommt es zu Lähmungen.
Beim Hausrind zeigt sich eine Tollwut zumeist zunächst in Verdauungsstörungen, es kommt zu einer Atonie und Aufgasung des Pansens und Durchfall. Insbesondere bei Weidehaltung muss die Tollwut immer als mögliche Ursache für Verdauungsstörungen in Betracht gezogen werden. Später stellen sich Muskelzuckungen, Speicheln, ständiges Brüllen und Lähmungen der Hinterbeine ein. Bei kleinen Wiederkäuern wie Schafen und Ziegen dominiert die „stille Wut“, es können aber auch Unruhe, ständiges Blöken und ein gesteigerter Geschlechtstrieb auftreten.
Beim Hauspferd kann die Tollwut als „rasende Wut“ mit Rennen gegen Stallwände und Koliken oder als „stille Wut“ mit Apathie auftreten. Die „stille Wut“ kann mit einer Bornaschen Krankheit verwechselt werden.
Beim Hausschwein dominieren Aufregung, andauerndes heiseres Grunzen, Zwangsbewegungen und Beißwut.
Bei Vögeln ist die Krankheit sehr selten und äußert sich in ängstlichem Piepen, Bewegungsstörungen und Lähmungen.
Bei Wildtieren führt eine Tollwut häufig zum Verlust der Scheu vor dem Menschen. Dabei ist jedoch zu beachten, dass viele verstädterte Wildtiere wie Füchse und Waschbären diese ohnehin nicht mehr aufweisen.
Diagnostik
Zusammenfassung
Kontext
Die Diagnose wird anhand der klinischen Symptome, dem Kontakt zu einer Erregerquelle (meist ein infiziertes Tier) und der Anamnese gestellt. Die Labordiagnostik ist vor allem bei Verdachtsfällen beim Menschen schwierig und nicht immer aussagekräftig.
Virusdiagnostik beim Tier
Bei getöteten oder verendeten Tieren wird der Virusnachweis durch Untersuchung von frischem Gehirngewebe durchgeführt. Dabei gilt der Nachweis von Negri-Körperchen (nach Aldechi Negri), also Antigenen des Rabiesvirus in 1 bis 25 µm großen Einschlusskörperchen, als beweisend. Dazu werden die Paraffinschnitte nach einer Methylblau-Eosin-Färbung nach Mann beurteilt. Der Nachweis der mit dieser Färbemethode gut sichtbaren basophilen Negri-Körperchen hat eine diagnostische Sensitivität von etwa 75 %, d. h. bei etwa einem Viertel der infizierten Tiere ist das Ergebnis falsch negativ.[20] Die Virusantigene können auch mittels eines Immunfluoreszenztests (IFT) nachgewiesen werden. Zusätzlich kann der direkte Nachweis des viralen Genoms in Gehirnproben auch mittels Polymerase-Kettenreaktion (PCR) erfolgen; ein negatives PCR-Ergebnis aus Gehirngewebe schließt eine Tollwutinfektion post mortem aus. Ein direkter Virusnachweis kann auch nach Anzucht des Virus in einer Zellkultur erfolgen.
Eine Unterscheidung bzw. Differenzierung der verschiedenen Lyssaviren wird durch eine Sequenzierung von Genomabschnitten oder der Typisierung mit verschiedenen typspezifischen monoklonalen Antikörpern erreicht.
Serologische Untersuchungen, also der Nachweis von Antikörpern gegen das Rabiesvirus im Blut des Tieres, spielen keine diagnostische Rolle beim akuten Krankheitsverdacht und sind wissenschaftlichen Fragestellungen oder der Überprüfung des Impferfolges z. B. in einem umschriebenen Bezirk nach Auslegung von Impfködern vorbehalten (siehe auch Anhang zu §12 Tollwutverordnung[21]). In den meisten europäischen Ländern werden die direkten Nachweise von Veterinäruntersuchungsämtern oder beauftragten, speziell akkreditierten Laboratorien durchgeführt.
Da die Testverfahren mit Gehirngewebe (Mikroskopie, Antigen-Nachweis, PCR) am sichersten eine Tollwutinfektion ausschließen oder feststellen können, ist eine amtstierärztliche Anordnung der Tötung des Verdachtstieres in vielen Ländern möglich. Bei Nutz- und Haustieren kann eine staatliche Entschädigung nach jeweils länderspezifischer Gesetzgebung erfolgen.
Diagnostik beim Menschen
Die Verdachtsdiagnose einer möglichen Tollwutinfektion wird durch eine sorgfältige Anamnese insbesondere zu Auslandsaufenthalten, Tierkontakt, Kontakt zu Sekreten wie Speichel oder Blut auf Schleimhäuten oder offenen Wunden, Bissereignis, Verhalten und Art des Tieres und einem eventuellen positiven Virusnachweis beim Tier gestellt. Eine Erkrankung wird vorwiegend klinisch anhand der typischen neurologischen Symptome diagnostiziert. Problematisch ist insbesondere die frühe Infektionsphase, bei der virologische Testverfahren oft noch negativ sind und die Symptomatik noch nicht ausgeprägt ist. Unmittelbar nach einer Exposition kann keine virologische Untersuchung die Infektion beweisen oder ausschließen, obwohl gerade in einem kurzen Zeitfenster nach der Exposition die Entscheidung zu einer Immunprophylaxe getroffen werden muss.
Keine bislang bekannte virologische Testmethode ist in der Lage, eine Tollwutinfektion beim Lebenden sicher auszuschließen. Nur ein eventuell positiver direkter Erregernachweis oder eine sichere Serokonversion zwischen zwei zeitlich um Wochen versetzte Serumproben (bei Ausschluss einer frischen Impfung) können eine Infektion beweisen. Diese Nachweise sind jedoch schwierig, zum einen aufgrund der latenten Ausbreitung des Virus im Nervengewebe, so dass im Untersuchungsmaterial kein Virus mehr präsent ist, zum anderen wird das Virus außerhalb des Körpers rasch inaktiviert, was Testverfahren mit Virusvermehrung einschränkt. Direkte Nachweisverfahren für Tollwutviren sind Speziallaboratorien vorbehalten.
Als direkte Nachweismethoden stehen prinzipiell ein Antigennachweis mittels Immunfluoreszenztest (IFT), eine Polymerase-Kettenreaktion (PCR), die Virusisolierung in der Zellkultur (RTCIT) oder der Mäuseinokulationstest (MIT) zur Verfügung. Bei letzterem wird die Probe in das Gehirn von Mäusen injiziert und auftretende Lähmungen oder der Tod der Maus bis zu zwei Wochen lang beobachtet. Als zu untersuchendes Material kommen (je nach Methode und möglichem Infektionsstadium) Speichel, Augenhornhaut-Abstriche (Cornea-Abstrich) oder -Abklatschpräparate, sowie Hautbioptate (insbesondere Nackenhautbioptate) in Frage. Alle Laborarbeiten und der Transport und die Versendung der Proben zum direkten Erregernachweis müssen unter besonderen Sicherheitsmaßnahmen (biologische Schutzstufe L3) erfolgen, Proben müssen bis zum Testeinsatz durchgehend kühl gehalten werden. Jeder positive, direkte Erregernachweis beweist eine Tollwutinfektion, ein negatives Testergebnis kann die Diagnose nicht ausschließen.[22] Der sichere Ausschluss oder die Bestätigung der Diagnose ist virologisch nur post mortem analog zum Nachweis beim infizierten Tier möglich.
Behandlung
Im Jahr 1885 hatte Louis Pasteur eine Tollwutbehandlung durch aktive Schutzimpfung eingeführt.[23] Eine evidenzbasierte Behandlung neben der postexpositionellen Impfung steht nicht zur Verfügung. Einzelne veröffentlichte Behandlungserfolge mit Überleben der Patienten sind hoch umstritten. Die Behandlung sollte zur Symptomlinderung gegebenenfalls unter Einsatz von Sedativa auf der Intensivstation erfolgen.[24]
Impfungen
Zusammenfassung
Kontext

Louis Pasteur entwickelte 1885 die erste Tollwut-Impfung mit abgeschwächten Erregern und rettete durch eine postexpositionelle Impfung am 6. Juli 1885 das Leben von Joseph Meister, der von einem tollwütigen Hund gebissen worden war. Heutzutage lässt sich unmittelbar nach einem Biss oder einem tollwutverdächtigen Kontakt die Infektion durch eine Simultanimpfung mit Antikörpern und Antigenen verhindern. Je weiter die Bisswunde vom zentralen Nervensystem entfernt liegt und je weniger venöse Blutgefäße verletzt wurden, desto besser ist die Prognose für den Patienten. Eine Immunprophylaxe sollte bei jedem begründeten Verdacht schnellstmöglich erfolgen.
Vorbeugende Impfung
Der Ausbruch der Erkrankung kann durch eine vorbeugende (präexpositionelle) Impfung verhindert werden. Heutzutage wird dabei ein Totimpfstoff aus inaktivierten Tollwut-Viren in den Oberarm injiziert. Wie bei aktiver Immunisierung üblich, müssen mehrere Dosen im Abstand von einigen Tagen bis Wochen verabreicht werden. Der genaue Impfplan ist präparatabhängig, in der Regel erfolgt eine Impfung zum Zeitpunkt 0, 7 und 28 Tage. Der Impfling bildet nach der Injektion schützende Antikörper gegen die Viren. Der volle Schutz wird etwa eine Woche nach der letzten Impfung erreicht. Bei Risikogruppen wie Laborpersonal oder Wildhütern wird nach 1 bis 2 Jahren die Anzahl der Antikörper im Blut überprüft und die Impfung gegebenenfalls aufgefrischt.
Postexpositionelle Impfung
Besteht der Verdacht auf eine Tollwutinfektion, führt man in der Regel eine Simultanimpfung durch.
Die passive Immunisierung besteht aus der einmaligen Gabe von Tollwut-Antikörpern. Mindestens die Hälfte der Antikörper wird dabei um die zuvor gereinigte und desinfizierte Wunde herum injiziert, der Rest wird intragluteal gegeben.[25] Die Injektion mit der aktiven Immunisierung erfolgt dabei möglichst weit von der Wunde entfernt, um die wechselseitige Neutralisation der beiden Impfstoffe möglichst gering zu halten. Die STIKO gibt folgende Empfehlung für die postexpositionelle Immunprophylaxe:[26]
| Grad der Exposition | Art der Exposition | Immunprophylaxe | |
|---|---|---|---|
| durch ein tollwutverdächtiges oder tollwütiges Wild- oder Haustier | durch einen Tollwut-Impfstoffköder | ||
| I | Berühren / Füttern von Tieren, Belecken der intakten Haut | Berühren von Impfstoffködern bei intakter Haut | keine Impfung |
| II | Knabbern an der unbedeckten Haut, oberflächliche, nicht blutende Kratzer durch ein Tier, Belecken der nicht intakten Haut | Kontakt mit der Impfflüssigkeit eines beschädigten Impfstoffköders mit nicht intakter Haut | Impfung |
| III | Jegliche Bissverletzung oder Kratzwunden, Kontamination von Schleimhäuten mit Speichel (z. B. durch Lecken, Spritzer) | Kontamination von Schleimhäuten und frischen Hautverletzungen mit der Impfflüssigkeit eines beschädigten Impfstoffköders | Impfung und einmalig simultan mit der ersten Impfung passive Immunisierung mit Tollwut-Immunglobulin (20 IE/kg Körpergewicht) |
Verbreitung und Bekämpfung
Zusammenfassung
Kontext
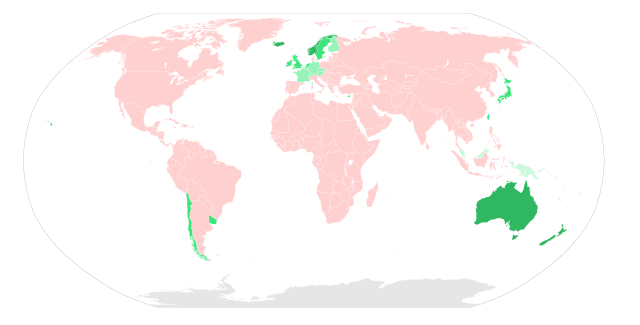
Immer tollwutfrei gewesen
Tollwut vor dem Jahr 1990 eliminiert
Tollwut im oder nach dem Jahr 1990 eliminiert
tollwutfrei, Jahr der Ausrottung unbekannt
Tollwut ist in vielen Teilen der Welt enzootisch, nur wenige Länder sind tollwutfrei. Bezüglich Übertragung, Epidemiologie und Reservoirwirten wird unterschieden zwischen der von Haustieren (meist Hunden) übertragenen urbanen Tollwut, der von Wildtieren (je nach Ort beispielsweise Füchse, Waschbären, Stachelschweine, Wölfe) übertragenen sylvatischen Tollwut und der durch Fledermäuse übertragenen Fledermaustollwut.
Das Tollwut-Virus überlebt in weiträumigen, abwechslungsreichen, ländlichen Tierwelt-Reservoiren. Die obligatorische Impfung von Tieren ist in ländlichen Gebieten weniger wirksam. Schluck-Impfstoffe können in Ködern verteilt werden, was die Tollwut in ländlichen Gebieten Frankreichs, Ontarios, Texas’, Floridas und anderswo erfolgreich zurückdrängte. Impfkampagnen können jedoch teuer sein, und eine Kosten-Nutzen-Analyse kann die Verantwortlichen dazu bringen, sich für Bestimmungen zur bloßen Eindämmung statt zur völligen Beseitigung der Krankheit zu entscheiden.

Um die Verbreitung der Krankheit zu bekämpfen, besteht für den grenzüberschreitenden Reiseverkehr mit kleinen Haus- und Heimtieren (Hunde, Katzen, Frettchen) schon seit Langem eine allgemeine Impfpflicht gegen Tollwut. Die von Land zu Land sehr unterschiedlichen zusätzlichen Bestimmungen wurden für die Verbringung von Tieren innerhalb der Europäischen Union mit der Einführung des EU-Heimtierausweises ab dem 4. Oktober 2004 vereinheitlicht.
Weltweit betrachtet sind Haushunde die wichtigste Infektionsquelle für Tollwut beim Menschen; auf sie gehen 99 Prozent der Todesfälle zurück. Jährlich gibt es etwa 50.000 registrierte Infektionen durch Hunde beim Menschen. Impfkampagnen und Kontrolle der Hundepopulation sind die einzige Möglichkeit, die urbane Tollwut wirksam zu bekämpfen.[27]
Deutschland

Für Tollwut bei Tieren besteht in Deutschland nach der Verordnung über anzeigepflichtige Tierseuchen eine Anzeigepflicht.[28] Zur Bekämpfung der Fuchstollwut wurden bis 2008, neben einer Bestandsverringerung durch eine verstärkte Bejagung des Fuchses,[29] Impfköder zur oralen Immunisierung der Füchse großflächig aus Flugzeugen in den gefährdeten Bezirken abgeworfen. Ergänzt wurden diese Maßnahmen durch Handauslagen von Ködern. Deutschland gilt seit April 2008 nach den Kriterien der Weltorganisation für Tiergesundheit (OIE) als tollwutfrei (d. h. frei von terrestrischer Tollwut),[30] nicht jedoch nach den strengeren WHO-Kriterien (frei von jeglichen Tollwutviren, auch Fledermaustollwut). Während noch im Jahr 1980 insgesamt 6800 Fälle gemeldet wurden, waren es im Jahr 1991 noch 3500, im Jahr 1995 nur 855, im Jahr 2001 noch 50 und 2004 noch 12 gemeldete Fälle. Mit fünf Fällen 2004 am stärksten von der Tollwut betroffen war der Fuchs. Vom 2. Quartal 2006 bis zum Dezember 2008 wurden in Deutschland keine Fälle von Tollwut bei Wild- oder Haustieren mehr gemeldet. Am 29. Dezember 2008 wurde jedoch im Landkreis Lörrach bei einem aus Kroatien importierten Hund amtlich die Tollwut festgestellt.[31] Ein weiterer Fall bei einem Hund wurde im März 2010 in Neustadt an der Aisch amtlich festgestellt, nachdem das drei Monate alte, illegal aus Bosnien eingeführte Tier einen Menschen gebissen hatte.[32] Im Juli 2013 wurde im unterfränkischen Landkreis Haßberge bei einem aus Marokko importierten Hundewelpen Tollwut festgestellt.[33] Auch im September 2021 war ein illegal importierter Hundewelpe Einträger des Tollwutvirus und führte zur prophylaktischen Impfung von 41 Personen.[34]
Seit 2001 sind in Deutschland insgesamt sechs Tollwutfälle bei Menschen gemeldet worden, davon im Jahr 2005 vier miteinander im Zusammenhang stehende Erkrankungen. Davon betroffen war zunächst eine 26-jährige Frau, die bei einem Aufenthalt in Indien durch einen Hundebiss infiziert wurde. Sie starb, ohne dass ihre Tollwuterkrankung diagnostiziert wurde. Nach ihrem Hirntod wurden ihr Organe zur Transplantation entnommen, drei ungeimpfte Organempfänger starben ebenfalls an Tollwut.[35] Der letzte Tollwutfall bei einem Menschen in Deutschland trat im Jahr 2007 bei einem Mann auf, der in Marokko von einem streunenden Hund gebissen wurde.[36][37][38]
Wenngleich die klassische (terrestrische) Tollwut in Deutschland nicht mehr vorkommt, lässt sich die Fledermaus-Tollwut vorerst nicht ausrotten. Ihre Erreger – Europäische Fledermaus-Lyssaviren (EBLV) 1 und 2 – sind mit dem klassischen Tollwutvirus eng verwandt, dennoch ist sie unabhängig von der klassischen Tollwut, jedoch für den Menschen ebenso gefährlich. Die derzeit verfügbaren Tollwut-Impfstoffe wirken auch gegen diese Viren. Seit 2010 werden im Schnitt rund 20 Fälle pro Jahr registriert (Stand: Ende 2018).[39]
Österreich
Durch die seit den 1990er Jahren durchgeführten Maßnahmen gilt die Tollwut in Österreich als ausgerottet. Zwei in den Jahren 2004 und 2006 vermutete Tollwutverdachtsfälle bei Füchsen konnten entkräftet werden. Die Weltgesundheitsorganisation (WHO) und die Internationale Tierseuchenorganisation haben Österreich am 28. September 2008 zum tollwutfreien Gebiet erklärt.[40]
Schweiz
Die Schweiz gilt seit 1999 als tollwutfrei. Die Krankheitsfreiheit wurde durch eine gezielte Fuchsimpfkampagne erreicht.[41][42][43]
Großbritannien
In Großbritannien trugen Hundelizenzen, Tötung von Straßenhunden, Maulkorbpflicht, strenge Quarantäne und vollständiges Importverbot von Tieren und andere Maßnahmen zur Ausrottung der Tollwut am Anfang des 20. Jahrhunderts bei.
Immer noch hat die Insel strenge Regulierungen bei der Einfuhr von Tieren. 1996 wurde eine einzelne Wasserfledermaus entdeckt, die mit dem europäischen Fledermaus-Lyssavirus 2 (EBLV-2) infiziert war. Im September 2002 wurde in Lancashire eine weitere Wasserfledermaus positiv auf EBLV-2 getestet. Ein Fledermaus-Schützer, der von der angesteckten Fledermaus gebissen worden war, erhielt eine Postexpositionsbehandlung und erkrankte nicht. Die Fledermaustollwut wird ebenfalls durch ein Virus der Gattung Lyssaviren ausgelöst, das aber nicht identisch mit dem Rabiesvirus ist; siehe dazu den Abschnitt Erreger.
Bali/Indonesien
2009 wurden mehrere Todesfälle bei Menschen von der Urlaubsinsel gemeldet. Zuvor galt die Insel als tollwutfrei.[44] Seit dem Beginn des Tollwutausbruchs 2008 haben 45 Patienten GeoSentinel- oder EuroTravNet-Einrichtungen zur Postexpositionsprophylaxe aufgesucht. Das sind 12,6 % der Reisenden, die insgesamt in Kliniken des Netzwerks zur Postexpositionsprophylaxe erschienen. Die erhobenen Daten zeigen, dass die Mehrzahl der Verletzungsfälle durch Tiere nicht durch Bisse oder Kratzer von Hunden, sondern durch Affen verursacht wurden.[45]
USA
Seit der Entwicklung von wirksamen Impfstoffen für Menschen und Immunglobulin-Behandlungen ist die Zahl der Todesopfer der Tollwut in den USA von 100 oder mehr pro Jahr am Anfang des 20. Jahrhunderts auf ein bis zwei pro Jahr gefallen, die größtenteils von Fledermaus-Bissen herrühren. Zunehmend gewinnen jedoch auch infizierte, streunende Waschbären als Überträger an Bedeutung. Diese werden vom Futter in überquellenden Mülltonnen in menschlichen Siedlungen angelockt.
Australien
Australien ist einer von wenigen Teilen der Welt, in die die Tollwut nie eingeschleppt wurde. Jedoch kommt das australische Fledermaus-Lyssavirus natürlicherweise in den meisten Festland-Staaten vor. Es befällt sowohl insektenfressende Fledermäuse der Art Saccolaimus flaviventris als auch die vier in Australien heimischen Arten der Flughunde, die sich pflanzlich ernähren.[46]
Indien
Indien ist das Land der Erde, in dem die meisten Tollwutfälle bei Menschen bekannt sind.[3] Die Übertragung erfolgt dort überwiegend durch Bisse meist freilaufender Hunde. Da eine Immunglobulin-Behandlung oft nicht verfügbar ist, wird fast ausschließlich mit der Postexpositionsmethode behandelt, die möglicherweise nicht so gute Heilungschancen wie die kombinierte Methode verspricht. Bei einem längeren Aufenthalt sollte also an eine vorherige Aktivimpfung gedacht werden (Reisemedizin). In Indien gibt es pro Jahr 18.000 bis 20.000 menschliche Tollwutfälle.[47] Da in Indien streunende Hunde nicht getötet werden dürfen, werden sie eingefangen, gegen Tollwut geimpft, gekennzeichnet und sterilisiert. Nach Schätzungen sind im Jahr 2015 nur etwa 15 % der streunenden Hunde geimpft, während es für eine effektive Verhinderung der Tollwut-Weiterverbreitung 70 % sein sollten.[2][48]
Volksrepublik China


Neben Indien ist China am meisten von Tollwut betroffen. In den Jahren 1960 bis 2014 wurden in der Volksrepublik China 120.913 Fälle von menschlicher Tollwut registriert, entsprechend durchschnittlich 2198 Fällen pro Jahr. In der Dekade zwischen 2004 und 2014 waren es 32.932 Fälle. Das Jahr mit der höchsten Inzidenz und Fallzahl war 1981 (0,7/100.000, 7037 Fälle). Die Häufigkeit der Tollwut nahm ab den 1980er Jahren zunächst aufgrund behördlicher Maßnahmen wie die Eindämmung streunender Hunde, Impfung von Hunden und Postexpositionsprophylaxe deutlich ab und erreichte im Jahr 1996 mit 159 gemeldeten Fällen (Inzidenz 0,01/100.000) ein absolutes Minimum, stieg aber danach wieder an bis zu einem zweiten Höhepunkt im Jahr 2007 mit 3300 Fällen (Inzidenz 0,3/100.000). Seitdem fallen die Zahlen wieder und lagen im Jahr 2014 bei 924 Fällen mit einer Letalität von 92 %.[49] Die Tollwut war 2014 die dritthäufigste Todesursache (nach AIDS und Tuberkulose) unter allen meldepflichtigen Infektionskrankheiten in der VR China.[51]
Überwiegend sind Bauern betroffen und die Zahl der Tollwutfälle zeigt eine deutliche jahreszeitliche Variation mit einem Maximum in den Sommermonaten. Zu mehr als 95 % sind Hunde die Überträger. Es gibt allerdings auch ein Virusreservoir in bestimmten Wildtier-Spezies.[49]
Nahezu 50 % der Fälle wurden in den Provinzen Guangxi, Hunan und Guizhou registriert. Von 315 untersuchten Fällen in diesen Provinzen erhielten 66,3 % der Patienten gar keine und 27,6 % unzureichende Postexpositionsprophylaxe. Nur 6 % erhielten volle Tollwutprophylaxe. In diesen Provinzen lag die Infektionsrate bei Hunden mit 2,3 % ebenfalls sehr hoch. Die Impfquote bei Hunden in 60 % der untersuchten Städte betrug unter 70 %.[52]
Tollwut nach Organtransplantation
Im Jahr 2004 wurde in den USA die Tollwut von einem Organspender auf die Empfänger übertragen. Drei Patienten, denen Tollwut-kontaminierte Organe transplantiert worden waren, starben an der Krankheit. Die US-Seuchenüberwachungsbehörde CDC stellte fest, dass der Organspender sich durch eine Fledermaus mit dem Virus angesteckt hatte.[10]
Auch in Deutschland sind drei Personen an einer durch Organspende übertragenen Tollwut gestorben, drei weitere mit Organen derselben Spenderin überlebten. Die im Dezember 2004 verstorbene Spenderin hatte sich im Oktober 2004 bei einem Indienurlaub durch einen Hundebiss unerkannt infiziert.[11]
Veraltete Bezeichnungen, Mythos und Geschichte
Zusammenfassung
Kontext
Früher waren auch die Bezeichnungen Hydrophobie bzw. Aquaphobie geläufig, übersetzt „Wasserscheu“ als typisches Symptom der Erkrankung. Gebräuchlich waren auch bis ins 19. Jahrhundert und darüber hinaus[53] die Benennungen als Hundswut, Hundewut und St.-Hubertus-Krankheit. Erst seit 1810 ist die heutige Bezeichnung Tollwut schriftlich nachweisbar.[54]

Dass die Übertragung durch den Biss befallener Hunde erfolgen kann, war schon in der Antike (im Corpus Hippocraticum) bekannt. In früheren Zeiten war die Tollwut von Mythen, Aberglauben und Irrtümern umgeben und schürte, da die Krankheit unweigerlich zum Tod führte, die Ängste und Phantasien der Menschen. Auch dass die Tollwut vermeintlich durch Wölfe übertragen wurde, trug zur Legendenbildung bei. Der Ursprung des Werwolfsglaubens beispielsweise wurzelt möglicherweise in der Tollwuterkrankung eines Menschen. In der Antike befassten sich auch Aristoteles und Euripides mit der Krankheit. In der griechischen Götterwelt waren Artemis, Hekate, Aktaion und Lykaon Verkünder, Verbreiter oder Opfer der Tollwut. Sirius, der Hauptstern im Sternbild des Großen Hundes, galt im antiken Griechenland als Wegbereiter der Seuche. Im Mittelalter wurde, ausgehend von Augustinus, der Ursprung der Tollwut beim Teufel gesucht; der heilige Hubertus gilt seit dieser Zeit als Schutzpatron gegen die Tollwut. Die Tollwut wurde mit dem Hubertusschlüssel behandelt. Beschrieben wurde die Tollwut auch von Galenos und Celsus sowie Avicenna, dessen Definition der rabies später Berthold Blumentrost[55] ausbaute.
Sowohl die besonderen Jagdprivilegien des Adels als auch langwierige Kriege sorgten im ausgehenden Mittelalter für eine Zunahme des Wolfbestands und somit auch der Tollwut. Aus der Zeit des Hundertjährigen Krieges wird aus Paris berichtet, dass täglich infizierte Wölfe, die in die Stadt eingedrungen waren, getötet wurden. Neben verschiedenen Wundermitteln waren religiös-magische Abwehrhandlungen gegen die Tollwut in Gebrauch. So ist zum Beispiel das Tragen eines Sator-Quadrates als Tollwut-Amulett belegt.[56]
Der österreichische Militärarzt Matthäus Mederer (1739–1805) beschäftigte sich u. a. intensiv mit der Bekämpfung von Tollwut, weshalb ihn Kaiser Joseph II. 1789, mit dem Prädikat Edler von Wuthwehr, in den erblichen Adelsstand erhob. Sein Sohn, der General Conrad von Mederer Edler von Wuthwehr (1781–1840), war der bekannteste Träger dieses an die Tollwut erinnernden Adelstitels.
Um 1884 schuf Pasteur die prophylaktisch-therapeutische Schutzimpfung gegen die Tollwut.
Meldepflicht
Zusammenfassung
Kontext
In Deutschland ist Tollwut beim Menschen eine meldepflichtige Krankheit nach § 6 Absatz 1 des Infektionsschutzgesetzes. Die namentliche Meldepflicht besteht nicht nur bei Verdacht, Erkrankung und Tod, sondern schon bei „Verletzung eines Menschen durch ein tollwutkrankes, -verdächtiges oder -ansteckungsverdächtiges Tier sowie die Berührung eines solchen Tieres oder Tierkörpers“. Beim Tier ist sie in Deutschland eine anzeigepflichtige Tierseuche nach § 4 Tiergesundheitsgesetz in Verbindung mit § 1 der Verordnung über anzeigepflichtige Tierseuchen.
In Österreich ist sie beim Menschen als Wutkrankheit (Lyssa) eine anzeigepflichtige Krankheit gemäß § 1 Abs. 1 Epidemiegesetz 1950. Die Anzeigepflicht bezieht sich auf Verdachts-, Erkrankungs- und Todesfälle sowie „Bissverletzungen durch wutkranke oder -verdächtige Tiere“. Eine Infektion mit dem Tollwut-Virus[57] ist gemäß Anhang II der Verordnung (EU) 2016/429 in Österreich beim Tier meldepflichtig.
In der Schweiz ist Tollwut als auszurottende Seuche im Sinne von Artikel 3 der Tierseuchenverordnung (TSV) mit sehr umfassenden Pflichten nach den Artikeln 142–149 TSV[58] meldepflichtig.[59] Beim Menschen ist Tollwut eine in der Schweiz ebenfalls meldepflichtige Krankheit und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Meldepflichtig ist der klinische Verdacht.
Literatur
- Th. Mertens, O. Haller, H.-D. Klenk (Hrsg.): Diagnostik und Therapie von Viruskrankheiten – Leitlinien der Gesellschaft für Virologie. 2. Auflage. München 2004, ISBN 3-437-21971-5, S. 283–288.
- N. Suttorp, M. Mielke, W. Kiehl, B. Stück: Infektionskrankheiten. Stuttgart 2004, ISBN 3-13-131691-8, S. 456 f.
- M. Rolle, A. Mayr (Hrsg.): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. 8. Auflage. Ferdinand Enke, Stuttgart 2006, ISBN 3-8304-1060-3 (books.google.com).
- S. Winkle: Kulturgeschichte der Seuchen. Artemis & Winkler, 1997, ISBN 3-933366-54-2, S. 916.
- Bill Wasik, Monica Murphy: Rabid. A Cultural History of the World’s Most Diabolical Virus. Viking Adult, 2012, ISBN 978-0-670-02373-8, S. 240.
- Epidemiology of rabies. (PDF; 1,2 MB). In: Bulletin de l'OIE, 2011, Nr. 3, S. 53–54.
- Johann Schäffer: Tollwut. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. de Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1404 f.
- Raphael Veicht: Rabies – intensivmedizinische und intensivpflegerische Herausforderung – Teil 1. In: Intensiv. Band 16, Nr. 1, 2008; Teil 2. Band 16, Nr. 2, 2008.
- Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. Auflage: ebenda 1961, S. 9–223, hier: S. 195–198.
Weblinks
Commons: Tollwut – Sammlung von Bildern, Videos und Audiodateien
Wiktionary: Tollwut – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
- Tollwut (Rabies) – Informationen des Robert Koch-Instituts (Deutschland)
- Tollwut. Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz, 30. Juli 2024 (Österreich).
- Tollwut. Bundesamt für Gesundheit BAG, 4. April 2024 (Schweiz).
- Rabies – detaillierte Informationen des Center for Disease Control and Prevention (englisch).
- Datenbank zur Ausbreitung der Tollwut in Europa. Friedrich-Loeffler-Institut (englisch).
- Rabies Portal. OIE (englisch).
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.