Sulforaphan
Isothiocyanat aus Kreuzblütlern, starkes indirektes Antioxidans Aus Wikipedia, der freien Enzyklopädie
Sulforaphan, chemisch 1-Isothiocyanato-4-methylsulfinyl-butan, ist ein Isothiocyanat. Das Senföl entsteht bei der enzymatischen Hydrolyse des Senfölglykosids Glucoraphanin.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
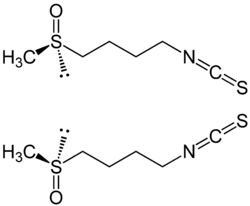 | ||||||||||
| (R)-Sulforaphan (oben) und (S)-Sulforaphan (unten) | ||||||||||
| Allgemeines | ||||||||||
| Name | Sulforaphan | |||||||||
| Andere Namen | ||||||||||
| Summenformel | C6H11NOS2 | |||||||||
| Kurzbeschreibung |
leicht gelbliche Flüssigkeit[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 177,29 g·mol−1 | |||||||||
| Siedepunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Eigenschaften und Vorkommen
Sulforaphan ist ein starkes indirektes Antioxidans.[4] Es wurde erstmals 1992 von Paul Talalay und Kollegen an der Johns-Hopkins-Universität in Baltimore isoliert und beschrieben.[5]

Der sekundäre Pflanzenstoff kommt als Senfölglykosid-Glucoraphanin insbesondere in Kreuzblütengewächsen wie Kohl und Broccoli vor. Im Unterschied zu Vitamin C, Vitamin E oder β-Carotin neutralisiert der Wirkstoff freie Radikale nicht direkt, sondern indirekt, indem es Phase-II-Enzyme aktiviert. Hierdurch werden nachhaltige antioxidative Abwehrmechanismen des Körpers in Gang gesetzt.[6]
Forschung
Zusammenfassung
Kontext
Wirkung auf Krebszellen
In verschiedenen präklinischen Studien konnte sowohl in der Zellkultur als auch in Tierversuchen eine Tumorzellen hemmende Wirkung von Sulforaphan nachgewiesen werden. Hierbei sollen bestimmte Komponenten von sich teilenden Krebszellen, die sogenannten Mikrotubuli, von Sulforaphan zerstört werden, was zum Niedergang der Krebszelle führt. Dieser Ergebnisse lassen sich aber nicht einfach auf den Menschen übertragen.[7]
Eine Metaanalyse verschiedener Beobachtungsstudien kommt zu den Schluss, dass Menschen, die wenig Brokkoli essen, öfter an Krebs erkranken.[8] Die Autoren weisen aber darauf hin, dass die beobachtete Assoziation mit Vorsicht zu betrachten sei. Die ausgewerteten Beobachtungsstudien zeigten kaum eine statistische Signifikanz, die Datenlage war insgesamt heterogen, als Grundlage gaben die Studienteilnehmer selbst an, wie viel Brokkoli sie gegessen hatten. Patienten, die regelmäßig Brokkoli essen, können sich auch insgesamt gesünder und bewusster ernähren, und damit allgemein ihr Krebsrisiko reduzieren.[7]
Es wird von Fachgesellschaften nicht empfohlen, Sulforaphan zusätzlich zur normalen Ernährung oder in Form von Nahrungsergänzungsmitteln zur Prävention oder Behandlung von Krebs einzunehmen.
Keimtötende Wirkung
Gegen den Magengeschwür-Verursacher Helicobacter pylori ist Sulforaphan alleine nicht wirksam, möglicherweise kann es aber synergetisch mit konventionellen Medikamenten gegen diese Infektion wirken.[9]
Wirkung auf Blutfette
Sulforaphan wirkt in Tierstudien (Kontext high-fat-Diät) günstig auf Körpergewicht, Lebergewicht, Gesamtcholesterin, LDL-Cholesterin und Triglyceride, aber nicht HDL.[10]
Wirkung auf Verhaltensmerkmale bei Autismus
Sulforaphan wurde in mehreren klinischen Studien darauf untersucht, ob es psychische Symptome bei Autismus verbessern kann. Hier zeigten sich in einigen Testreihen keine relevanten Effekte,[11][12] obwohl andere Studien eine Wirkung z. B. auf Reizbarkeit beschrieben.[13][14]
Nebenwirkungen
Eine Forschergruppe in Hamburg konnte zeigen, dass höhere Sulforaphankonzentrationen die Schlagkraft von Herzmuskelzellen reduzieren kann. Es wird daher eine engmaschige Überwachung der Herzmuskelfunktion für Patienten mit Herzerkrankungen vorgeschlagen.[15]
Analytik
Die sichere qualitative und quantitative Bestimmung gelingt nach angemessener Probenvorbereitung durch Kopplung der HPLC mit der Massenspektrometrie.[16][17][18][19]
Metabolismus

Der Abbau und die Ausscheidung von Sulforaphan geschieht in Säugetieren hauptsächlich mittels einer Glutathion-S-Transferase, indem es zu einem Dithiocarbamat umgesetzt wird, dabei wird die Thiolgruppe des Glutathions an die Isothiocyanatgruppe des Sulforaphans addiert. Nach der enzymatischen Abspaltung der Glutaminsäure und des Glycins wird durch Acetylierung ein N-Acetylcystein-Addukt gebildet, welches in Tierversuchen an Ratten (zusammen mit dem Glutathion-Addukt) in Urin und Galle gefunden werden konnte. Sulforaphan kann auch zu seinem Thioether-Analogon Erucin reduziert werden, die genauen Mechanismen dazu sind bislang noch ungeklärt.[20]
Literatur
- B. M. Kaminski, D. Steinhilber u. a.: Phytochemicals resveratrol and sulforaphane as potential agents for enhancing the anti-tumor activities of conventional cancer therapies. In: Current Pharmaceutical Biotechnology. Band 13, Nummer 1, Januar 2012, S. 137–146, PMID 21466425 (Review).
- Y. S. Keum: Regulation of the Keap1/Nrf2 system by chemopreventive sulforaphane: implications of posttranslational modifications. In: Annals of the New York Academy of Sciences. Band 1229, Juli 2011, S. 184–189, doi:10.1111/j.1749-6632.2011.06092.x. PMID 21793854 (Review).
- C. W. Beecher: Cancer preventive properties of varieties of Brassica oleracea: a review. In: The American Journal of Clinical Nutrition. Band 59, Nummer 5 Suppl, 1994, S. 1166S–1170S, PMID 8172118 (Review). PDF (freier Volltextzugriff, auf Englisch).
- C. Fimognari, P. Hrelia: Sulforaphane as a promising molecule for fighting cancer. In: Mutation Research. Band 635, Nummer 2–3, 2007, S. 90–104, doi:10.1016/j.mrrev.2006.10.004. PMID 17134937 (Review).
- N. Juge, R. F. Mithen, M. Traka: Molecular basis for chemoprevention by sulforaphane: a comprehensive review. In: Cellular and Molecular Life Sciences. Band 64, Nummer 9, 2007, S. 1105–1127, doi:10.1007/s00018-007-6484-5. PMID 17396224 (Review).
Einzelnachweise
Weblinks
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
