Loading AI tools
Praseodym ist ein chemisches Element mit dem Elementsymbol Pr und der Ordnungszahl 59. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der Seltenen Erden. Von der Grünfärbung seiner Verbindungen kommt auch der Name: das griechische Wort πράσινος prásinos bedeutet „grün“, δίδυμος didymos „doppelt“ oder „Zwilling“.
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Praseodym, Pr, 59 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Lanthanoide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | La, 6, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß, gelblicher Farbton | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-120-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.291 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 5,2 ppm (49. Rang)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 140,90766(1)[3] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 185 (247) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 203 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5.4702(4) eV[4] ≈ 527.79 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 10.631(20) eV[4] ≈ 1025.7 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 21.6237(25) eV[4] ≈ 2086.37 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 38.981(25) eV[4] ≈ 3761.1 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 57.53(5) eV[4] ≈ 5550 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 6,475 g/cm3 (25 °C)[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 2,9 · 10−3)[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1208 K (935 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3403 K[9] (3130 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 20,80 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 331 kJ/mol[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 6,9 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 2280 m·s−1 bei 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1,43 · 106 S·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 13 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +2, +3, +4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,35 V (Pr3+ + 3 e− → Pr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,13 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

1841 extrahierte Carl Gustav Mosander die Seltene Erde Didym aus Lanthanoxid. 1874 bemerkte Per Teodor Cleve, dass es sich bei Didym eigentlich um zwei Elemente handelte. Im Jahr 1879 isolierte Lecoq de Boisbaudran Samarium aus Didym, das er aus dem Mineral Samarskit gewann. 1885 gelang es Carl Auer von Welsbach, Didym in Praseodym und Neodym zu trennen, die beide Salze mit verschiedenen Farben bilden.[12]
Praseodym kommt in natürlicher Form nur in chemischen Verbindungen vergesellschaftet mit anderen Lanthanoiden, hauptsächlich in folgenden Mineralien vor:
|
Die weltweiten Reserven werden auf 4 Millionen Tonnen geschätzt.
Wie bei allen Lanthanoiden werden zuerst die Erze durch Flotation angereichert, danach die Metalle in entsprechende Halogenide umgewandelt und durch fraktionierte Kristallisation, Ionenaustausch oder Extraktion getrennt.
Das Metall wird durch Schmelzflusselektrolyse oder Reduktion mit Calcium gewonnen.
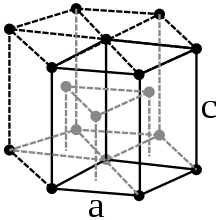
Physikalische Eigenschaften
Praseodym ist ein weiches, silberweißes paramagnetisches Metall, das zu den Lanthanoiden und Metallen der Seltenen Erden gehört. Bei 798 °C wandelt sich das hexagonale α-Pr in das kubisch-raumzentrierte β-Pr um.
Chemische Eigenschaften
Bei hohen Temperaturen verbrennt Praseodym zum Sesquioxid Pr2O3. Es ist in Luft etwas korrosionsbeständiger als Europium, Lanthan oder Cer, bildet aber leicht eine grüne Oxidschicht aus, die an der Luft abblättert. Mit Wasser reagiert es unter Bildung von Wasserstoff zum Praseodymhydroxid (Pr(OH)3). Praseodym tritt in seinen Verbindungen drei- und vierwertig auf, wobei die dreiwertige Oxidationszahl die häufigere ist. Pr(III)-Ionen sind gelbgrün, Pr(IV)-Ionen gelb. Unter besonderen reduktiven Bedingungen kann auch zweiwertiges Praseodym erzeugt werden, z. B. im Praseodym(II,III)-iodid (Pr2I5).
Natürliches Praseodym besteht nur aus dem stabilen Isotop 141Pr. 38 weitere radioaktive Isotope sind bekannt, wobei 143Pr und 142Pr mit einer Halbwertszeit von 13,57 Tagen beziehungsweise 19,12 Stunden die langlebigsten sind. Alle anderen Isotope haben Halbwertszeiten von weniger als 6 Stunden, die meisten sogar weniger als 33 Sekunden. Es gibt auch 6 metastabile Zustände, wobei 138mPr (t½ 2,12 Stunden), 142mPr (t½ 14,6 Minuten) und 134mPr (t½ 11 Minuten) die stabilsten sind.
Die Isotope bewegen sich in einem Atommassenbereich von 120,955 (121Pr) bis 158,955 (159Pr).
- Praseodym wird in Legierungen mit Magnesium zur Herstellung von hochfestem Metall für Flugzeugmotoren verwendet.
- Legierungen mit Cobalt und Eisen sind starke Dauermagnete.
- Praseodymverbindungen werden zum Färben von Glas und Emaille verwendet (zum Beispiel in grün gefärbten Scheinwerfergläsern in der Beleuchtungstechnik).
- Die Verbindungen verbessern auch die UV-Absorption und werden für Augenschutzgläser beim Schweißen benutzt.
- Das Praseodym-Ion Pr3+ wird als Dotant für Lasermedien in Feststofflasern verwendet. So kommt es beispielsweise in Pr3+:LiYF4-Lasern vor.
Oxide
- grünes Praseodym(III)-oxid (Pr2O3)
- braun-schwarzes Praseodym(III,IV)-oxid (Pr6O11)
- fast schwarzes Praseodym(IV)-oxid (PrO2)
Halogenide
Bekannt sind von allen Oxidationsstufen mehrere Halogenide beispielsweise Praseodym(III)-fluorid (PrF3), Praseodym(IV)-fluorid (PrF4), Praseodym(III)-chlorid (PrCl3), Praseodym(III)-bromid (PrBr3), Praseodym(III)-iodid (PrI3), Praseodym(II,III)-iodid (Pr2I5). Die dreiwertigen Halogenide bilden verschiedene Hydrate.
Außerdem bildet es mehrere Fluoridokomplexe wie z. B. das K2[PrF6] mit vierwertigem Pr.
Andere Verbindungen
Binäre Verbindungen sind z. B. Praseodym(III)-sulfid (Pr2S3), Praseodymnitrid (PrN), Praseodymphosphid (PrP).
Daneben ist Praseodym in diversen Salzen, wie dem hygroskopischen Praseodym(III)-nitrat (Pr(NO3)3 · x H2O), dem schön kristallisierenden Praseodym(III)-sulfat (Pr2(SO4)3 · 8 H2O) und anderen vertreten.
Eine Übersicht über Praseodymverbindungen bietet die Kategorie:Praseodymverbindung.
- Praseodym(III)-sulfat Octahydrat
- Praseodym(III)-chlorid Heptahydrat
Commons: Praseodym – Sammlung von Bildern, Videos und Audiodateien
Wiktionary: Praseodym – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
- Eintrag zu Praseodym. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Metallisch blankes Praseodym
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.



