Photosystem I
Enzymfamilie Aus Wikipedia, der freien Enzyklopädie
Das Photosystem I ist ein wesentlicher Bestandteil der Photosynthese, also der Bildung von organischen Stoffen mit Hilfe von Licht als Energiequelle, das in Pflanzen, Algen, photosynthetischen Protisten und photosynthetischen Bakterien vorkommt. Es ist ein besonders strukturiertes Stoffsystem, bestehend aus einem Lichtsammel- und einem Reaktionskomplex.[1] Im Photosystem I wird ein starkes Reduktionsmittel (NADPH) für die Synthese organischer Stoffe aus Kohlenstoffdioxid und Wasser gebildet und Lichtenergie in eine für diese Biosynthese geeignete Energiequelle Adenosintriphosphat (ATP) umgewandelt.

Eigenschaften
Zusammenfassung
Kontext
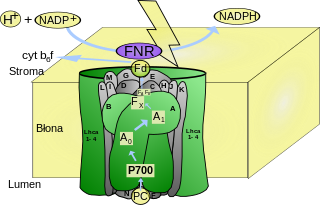
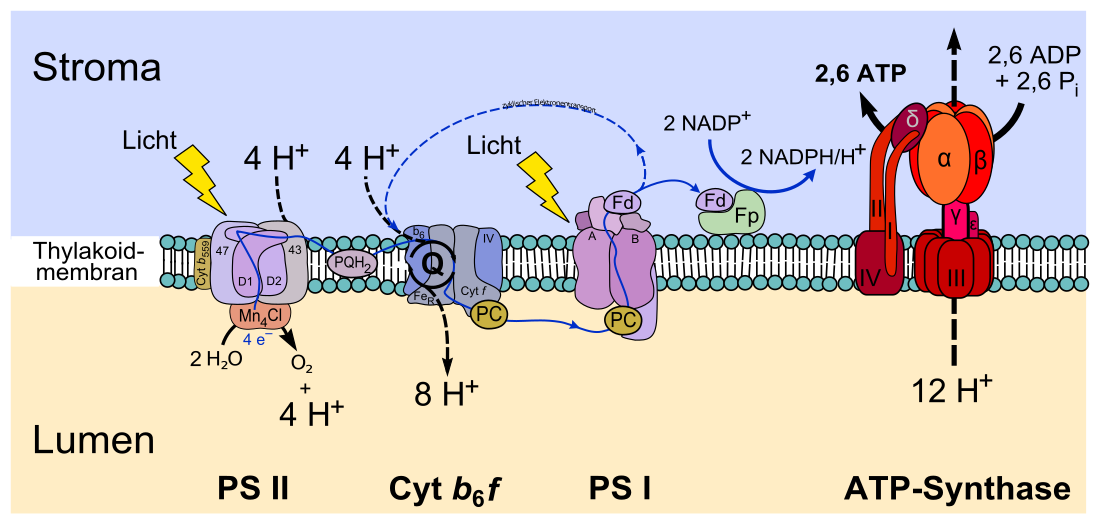
Das Photosystem I (PS I) ist ein Proteinkomplex aus mehreren Membranproteinen, der im Zuge der Photosynthese eine Oxidation von Plastocyanin und die Reduktion von Ferredoxin durch absorbierte Photonen katalysiert.[1] Es befindet sich bei Pflanzenzellen in der Thylakoidmembran der Chloroplasten und besteht aus 15 Proteinen.[2] Es dient dazu, Photonen zu absorbieren und dem Reaktionszentrum P 700 zuzuleiten, einem Chlorophyll-a-enthaltenden Molekülkomplex, das sich durch eine Absorption bei einer Wellenlänge von etwa 700 nm auszeichnet. Es dient als Photosensibilisator. Nach Anregung durch Photonen entsteht innerhalb von 100 Picosekunden ein sekundäres Radikalpaar, das bei Raumtemperatur in 300 Nanosekunden zerfällt bzw. in 300 μs bei 77 Kelvin.[3]
Die übrigen Chlorophyll-a-Moleküle haben, ebenso wie die anderen Chlorophylle, Biliproteine und Carotinoide, eine Antennenfunktion, d. h., sie übertragen die absorbierte Strahlungsenergie auf das Reaktionszentrum. Sie sind für das Lichtsammeln in der Thylakoidmembran in zwei parallelen Schichten (luminal und stromal) angeordnet.[2] Im Bereich des Elektronentransports sind sie dagegen in einer Pseudo-C2-Symmetrie orthogonal zur Membran angeordnet.[2] Am wichtigsten für die Photosynthese ist hierbei die Übertragung der photochemischen Anregungsenergie auf die Nachbarmoleküle. Dabei müssen sich das Fluoreszenzspektrum des Spendermoleküls mit dem Absorptionsspektrum des Empfängermoleküls überlappen und die Chlorophyllmoleküle in der Membran dicht gepackt liegen. Es finden dabei sowohl Energietransfer- als auch Elektronentransferprozesse statt.
Bei Zimmertemperatur zeigt das Chlorophyll-a-Fluoreszenzspektrum eine starke Absorptionsbande bei 685 nm und eine schwächere bei 740 nm. Wird das Spektrum bei tiefen Temperaturen ermittelt, so ergeben sich Banden bei 685, 695 und 720 nm, wobei die ersten beiden dem Pigmentsystem II, die bei 720 nm dem Pigmentsystem I zugeordnet werden.[4]
Die Pigmentzusammensetzung der Photosysteme in höheren Pflanzen ist folgende:
- Photosystem I: Carotine, Chlorophyll a, Chlorophyll b;
- Photosystem II: Xanthophyll, Chlorophyll a, Chlorophyll b
Die Photosysteme unterscheiden sich nicht nur im Absorptionsspektrum des Pigments im Reaktionszentrum, sondern auch durch die Zusammensetzung der Antennenpigmente. Photosystem II ist beispielsweise reicher an Chlorophyll b. Photosystem I ist im Vergleich zum Photosystem II weniger empfindlich gegen Temperaturerhöhungen.[5]
Zusammensetzung
Zusammenfassung
Kontext

Zwei Proteine des Photosystems I, PsaA und PsaB, besitzen jeweils elf Transmembranhelices und eine Masse von etwa 80 kDa und bilden ein Heterodimer und binden als Cofaktor etwa 80 Chlorophyll-a-Moleküle, etwa 20 β-Carotine zur Lichtabsorption und etwa sechs Chlorophyll-a-Moleküle, zwei Phyllochinone und ein 4Fe-4S-Cluster für den Elektronentransfer.[2] Die anderen dreizehn Proteine sind relativ klein, mit Massen zwischen vier und achtzehn Kilodalton.[2]
| Untereinheit | Beschreibung |
|---|---|
| A | 83 kDa, 751 Aminosäuren |
| B | 82,5 kDa, 735 Aminosäuren |
| C | 8,9 kDa, Elektronentransfer von P700 auf Ferredoxin |
| D | 19 kDa |
| E | 7,5 kDa |
| F | 19 kDa |
| G | 8 kDa, nur in Pflanzen |
| H | 10 kDa, in Pflanzen |
| I | 5 kDa |
| J | 5 kDa, bindet drei Chlorophyllmoleküle |
| K | 8.5 kDa, bindet zwei Chlorophyllmoleküle |
| L | 16 kDa |
| M | 3,5 kDa, nur in Cyanobakterien |
| N | 9 kDa, in Pflanzen und Algen |
| O | |
| X | 4 kDa, nur in Cyanobakterien |
| Pigmente | |
| Chlorophyll a | 95 Moleküle im Antennensystem |
| Chlorophyll a | 2 Moleküle |
| Chlorophyll a0 | Chlorophyll а695 – primärer Elektronenakzeptor |
| Chlorophyll а und a' | P700 |
| β-Carotin | 22 Moleküle |
| Coenzyme/Cofaktoren | |
| Fa | Fe4S4 Eisen-Schwefel-Cluster |
| Fb | Fe4S4 Eisen-Schwefel-Cluster |
| Fx | Fe4S4 Eisen-Schwefel-Cluster |
| Ferredoxin | Elektronenüberträger |
| Plastocyanin | Lösliches Protein, enthält ein Kupferion |
| QK-A | Phyllochinon – ein Elektronenakzeptor beim Elektronentransport (Untereinheit A) |
| QK-B | Phyllochinon – ein Elektronenakzeptor beim Elektronentransport (Untereinheit B) |
| Ca2+ | Calciumion |
| Mg2+ | Magnesiumion |
Photonen- und Elektronentransport
Zusammenfassung
Kontext

Die als Antennen wirkenden Substanzen der Photosysteme werden als Lichtsammelkomplex (LHC) zusammengefasst. Durch diesen wird die lichtabsorbierende Fläche vergrößert. Die Reaktionszentren sind die eigentlichen Redoxsysteme des photochemischen Elektronentransports. Das Reaktionszentrum P 700 des Photosystems I ist ein starkes Reduktionsmittel (Standard-Reduktionspotential im Grundzustand liegt bei circa +0,45 V, im photochemisch angeregten Zustand liegt der Wert bei −0,6 V). Es absorbiert zwei Photonen und wirkt dann als primärer Elektronendonator und überträgt unter zweimaliger Anregung mit Photonen insgesamt zwei Elektronen auf den Primärakzeptor A, ein Eisen-Schwefel-Protein. Der Primärakzeptor ist in der Lage, das auf der Membran liegende Ferredoxin zu reduzieren. Das bedeutet, dass das Ferredoxin hier der Elektronenakzeptor ist. Von hier werden die Elektronen auf ein FAD-haltiges Enzym übertragen.
Dieses katalysiert folgende Reaktion:
- NADP+ geht unter Aufnahme von zwei Protonen und zwei Elektronen in NADPH + H+ über.
Reaktionsprodukt des Photosystems I ist der Energiespeicher ATP:
- In einer Phosphorilierungsreaktion wird ATP aus ADP und Phosphat gebildet.
ATP ist der Energielieferant für die in der Dunkelreaktion (Atmung) ablaufende Prozesse. Der Elektronenausgleich erfolgt im weiteren Verlauf im Zusammenwirken mit dem Photosystem II durch das als Donator fungierende Plastocyanin. Es ist ein Protein mit Redoxeigenschaften, das in seinem aktiven Zentrum zwei Kupferionen gebunden enthält. Dieses erhält seine Elektronen von dem Cytochrom-b-Komplex, der seinerseits vom Plastochinon reduziert wird. Das Plastochinon selbst geht bei der Elektronenaufnahme in Plastochinol über. Damit ist die Kette geschlossen und die Elektronenbilanz ausgeglichen. Bei der Gesamtreaktion der Photosynthese entsteht auch Sauerstoff, und zwar bei der Lichtreaktion im Photosystem II. Er wird aus dem Wasser gebildet. Gleichzeitig zum Chlorophyll im Photosystem I vorhandenes Carotin wirkt absorbierend und entfernt den gebildeten Singulettsauerstoff, der für die Blätter der Pflanze toxisch ist.
Es können sich unterschiedliche Dunkelreaktion anschließen: beispielsweise die enzymatisch ablaufende Verwertung des gebundenen Kohlenstoffs, wodurch die Photosynthese zu einem Kreisprozess wird, der nach seinem Hauptentdecker Calvin-Zyklus genannt wird. Insgesamt gesehen lässt sich der im Photosystem I ablaufende Prozess als Elektronentransportkette klassifizieren. Dazu lässt sich anmerken, dass es sich bei der Photosynthese um eine Photoreaktion mit einer Quantenausbeute von über 90 % handelt.
Der für die ATP-Produktion nötige Protonengradient kann nicht nur über die lineare Elektronentransportkette, sondern auch über einen zyklischen Elektronentransport im Photosystem I erzeugt werden.[6]
Entwicklungsgeschichte
Molekularbiologische Daten unterstützen die Aussage, dass sich das Photosystem I wahrscheinlich vom Photosystem der grünen Schwefelbakterien und Heliobacteria entwickelt hat. So ähnelt sich, dass das Redoxpotential negativ genug ist, um Ferredoxin zu reduzieren. Außerdem enthalten alle drei Elektronentransportketten Eisen-Schwefel-Proteine.[7]
Literatur
- X. Qin, M. Suga, T. Kuang, J.-R. Shen: Structural basis for energy transfer pathways in the plant PSI-LHCI supercomplex. In: Science. 348, 2015, S. 989, doi:10.1126/science.aab0214.
- Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer: Photochemie: Konzepte, Methoden, Experimente. J. Wiley & Sons, Weinheim u. a. O. 1998, ISBN 3-527-29545-3.
- Peter Karlson: Kurzes Lehrbuch der Biochemie für Mediziner und Naturwissenschaftler. Thieme Verlag, Stuttgart 1977, ISBN 3-13-357810-3.
- W. Baumeister: rororo-Pflanzenlexikon, Bd. 1: Allgemeine Botanik. 59.–62. Tausend. rororo 1979, ISBN 3-499-16100-1.
- Wilhelm Nultsch: Allgemeine Botanik: kurzes Lehrbuch für Mediziner und Naturwissenschaftler. 8. Auflage. Thieme Verlag, Stuttgart, New York 1986, ISBN 3-13-383308-1, S. 257,261.
- A. Gilbert, J. Baggott: Essentials of Molecular Photochemistry. Oxford Blackwill Scientific Publications, 1991, ISBN 0-632-02429-1.
- R. Croce, H. van Amerongen: Light-harvesting in photosystem I. In: Photosynthesis research. Band 116, Nummer 2–3, Oktober 2013, S. 153–166, doi:10.1007/s11120-013-9838-x, PMID 23645376, PMC 3825136 (freier Volltext).
- T. Roach, A. Krieger-Liszkay: Regulation of photosynthetic electron transport and photoinhibition. In: Current protein & peptide science. Band 15, Nummer 4, 2014, S. 351–362, PMID 24678670, PMC 4030316 (freier Volltext).
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.