Top-Fragen
Zeitleiste
Chat
Kontext
Diphenylketen
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
Diphenylketen wurde 1905 zuerst von Hermann Staudinger isoliert und als erster Vertreter der außerordentlich reaktiven Stoffklasse der Ketene[5] mit der allgemeinen Formel R1R2C=C=O (R1=R2=Phenylgruppe) identifiziert.[8] Mit den kumulierten Doppelbindungen in der Ketenstruktur R1R2C=C=O stellt Diphenylketen ein Heterokumulen dar. Die wichtigste Reaktion des Diphenylketens ist die [2+2]-Cycloaddition an C-C-, C-N-, C-O-, C-S-Mehrfachbindungen.[9]
Remove ads
Remove ads
Vorkommen und Darstellung
Zusammenfassung
Kontext
Die erste Synthese von H. Staudinger ging aus von Chlor-diphenyl-acetylchlorid (aus Benzilsäure und Thionylchlorid[10]), aus dem mit Zink in einer Dehalogenierungsreaktion zwei Chloratome abgespalten werden.[5]

Eine frühe Synthese nutzt Benzilmonohydrazon (aus Benzil und Hydrazinhydrat[11]), das mit Quecksilber(II)-oxid und Calciumsulfat zum Mono-diazoketon oxidiert und anschließend bei 100 °C unter Stickstoffabspaltung in 58%iger Ausbeute in das Diphenylketen umgelagert wird.[12]

Eine weitere frühe Diphenylketen-Synthese stammt von Eduard Wedekind, der bereits 1901 bei der Dehydrohalogenierung von Diphenylacetylchlorid mit Triethylamin Diphenylketen erhielt, ohne es jedoch zu isolieren und zu charakterisieren.[13] Diese Variante wurde auch 1911 von H. Staudinger beschrieben.[14]

Eine Laborstandardvorschrift[1] basiert auf dem Staudinger-Verfahren und liefert Diphenylketen als orangefarbenes Öl in Ausbeuten von 53 bis 57 %.
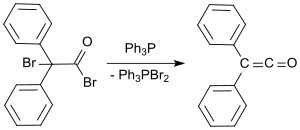
In einem jüngeren Verfahren wird 2-Brom-2,2-diphenylacetylbromid mit Triphenylphosphin in Ausbeuten bis 81 % zu Diphenylketen umgesetzt.[3]
Unlängst wurde eine Synthese von Diphenylketen aus Diphenylessigsäure und dem Hendrickson-Reagenz (Triphenylphosphoniumanhydrid-Triflat, aus Triphenylphosphinoxid und Trifluormethansulfonsäureanhydrid)[15][16] unter Wasserabspaltung in 72%iger Ausbeute berichtet.[17]

Remove ads
Eigenschaften
Diphenylketen ist bei Raumtemperatur ein orangefarbenes bis rotes Öl – mit der Farbe konzentrierter Kaliumdichromat-Lösung[5] –, das sich mit unpolaren organischen Lösungsmitteln wie z. B. Diethylether, Aceton, Benzol, Tetrahydrofuran, Chloroform mischt[6] und in der Kälte zu gelben Kristallen erstarrt.[5] Die Verbindung wird durch Luft leicht oxidiert, kann aber in dicht verschlossenen Behältnissen bei 0 °C mehrere Wochen ohne Zersetzung[1] bzw. in einer Stickstoffatmosphäre unter Zusatz einer kleinen Menge Hydrochinon als Polymerisationsinhibitor[12] aufbewahrt werden.
Die hohe Reaktivität des Diphenylketens manifestiert sich auch in der Bildung von drei definierten Dimeren:[18]
- das cyclische Diketon 2,2,4,4-Tetraphenylcyclobutan-1,3-dion (I) durch Erhitzen mit Chinolin
- das β-Lacton 4-(Diphenylmethylen)-3,3-diphenyloxetan-2-on (II) durch Erhitzen mit Natriummethanolat und
- das Tetralin-derivat 2,2,4-Triphenylnaphthalin-1,3-(2H,4H)-dion (III) durch Erhitzen mit Benzoylchlorid

und daraus abgeleiteten höheren Oligomeren.
Remove ads
Anwendungen
Zusammenfassung
Kontext
In ihrer Konstitution wie in ihrer Reaktivität zeigen Ketene der allgemeinen Formel R1R2C=C=O viele Parallelen zu Isocyanaten der allgemeinen Formel R-N=C=O.
Diphenylketen addiert Wasser unter Bildung von Diphenylessigsäure, Ethanol zum Diphenylessigsäureethylester oder Ammoniak zum entsprechenden Amid.[5] Mit Carbonsäuren entstehen gemischte Anhydride der Diphenylessigsäure, die zur Aktivierung von geschützten Aminosäuren für die Peptidverknüpfung herangezogen werden können.

So entsteht bei der Aktivierung von Z-Leucin mit Diphenylketen und anschließender Umsetzung mit Phenylalanin-ethylester in 59%iger Ausbeute das geschützte Dipeptid Z-Leu-Phe-OEt (N-Benzyloxycarbonyl-L-leucyl-L-phenylalanin-ethylester).[19]
Diphenylketen neigt zur Autoxidation, bei der sich über ein intermediär entstehendes Diphenyl-Acetolacton bei Temperaturen über 60 °C der entsprechende Polyester bildet.[20]

In einer Wittig-Reaktion können aus Diphenylketen Allene dargestellt werden.[21]

Mit Triphenylphosphindiphenylmethylen und Diphenylketen entsteht z. B. bei 140 °C unter Druck Tetraphenylallen in 70%iger Ausbeute.[22]
Die synthetisch interessantesten Reaktionen des Diphenylketens sind [2+2]-Cycloadditionen, wie z. B. die Reaktion mit Cyclopentadien zu einem Diels-Alder-Addukt.[23]

Imine wie z. B. Benzalanilin bilden mit Diphenylketen β-Lactame

und mit Carbonylverbindungen entstehen analog β-Lactone.[23]
Die [2+2]-Cycloaddition von Diphenylketen mit Phenylacetylen führt zunächst zu einem Cyclobutenon, das thermisch zu einem Phenylvinylketen aromatisiert und in einer [4+2]-Cycloaddition in 81%iger Ausbeute zu 3,4-Diphenyl-1-naphthol cyclisiert.[24]

Aus dieser so genannten Smith-Hoehn-Reaktion hat sich eine allgemeine Synthesemethode für substituierte Phenole und Chinone entwickelt.[8]
Remove ads
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
