Loading AI tools
Auftreten von zwei oder mehreren chemischen Verbindungen mit gleicher Summenformel und Molekülmasse Aus Wikipedia, der freien Enzyklopädie
Isomerie (von den altgriechischen Wortbildungselementen ἴσος (isos) „gleich“, μέρος (meros) „Anteil, Teil, Stück“) ist das Auftreten von zwei oder mehreren chemischen Verbindungen mit gleicher Summenformel und Molekülmasse, die sich jedoch in der Verknüpfung oder der räumlichen Anordnung der Atome unterscheiden. Die entsprechenden Verbindungen werden Isomere genannt und lassen sich durch unterschiedliche Strukturformeln darstellen. Sie unterscheiden sich in ihren chemischen und/oder physikalischen und oft auch in ihren biochemischen Eigenschaften. Isomerie tritt vor allem bei organischen Verbindungen, aber auch bei (anorganischen) Koordinationsverbindungen auf. Die Isomerie wird in verschiedene Bereiche unterteilt.
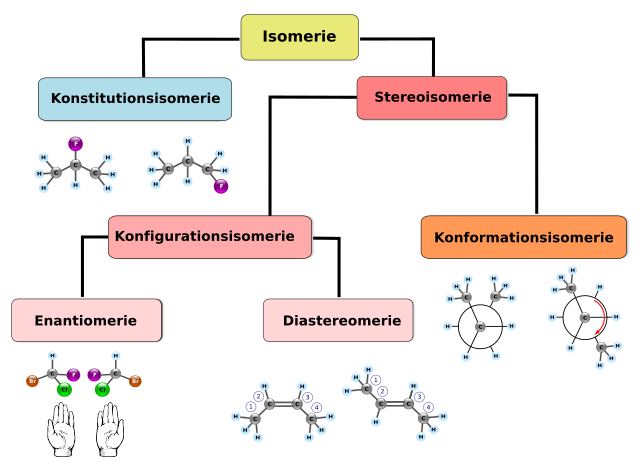

Konstitutionsisomere (auch Strukturisomere genannt) besitzen die gleiche allgemeine Summenformel, unterscheiden sich aber in der Reihenfolge der Atome und in ihren Bindungen. Die Isomere sind daher im Allgemeinen verschiedene Substanzen mit unterschiedlichen chemischen (u. a. Reaktivität) und physikalischen Eigenschaften (u. a. Schmelz- und Siedepunkt, Löslichkeit). Man kann mehrere Fälle unterscheiden:
Ein Sonderfall der Bindungsisomerie ist dabei die Tautomerie, bei der (meist zwei) verschiedene Isomere in einer reversiblen chemischen Reaktion ineinander übergehen, indem Teile des Moleküls (meist Wasserstoffatome) ihren Platz wechseln und sich dadurch Bindungen verschieben, z. B. eine vormalige Doppelbindung zu einer Einfachbindung wird und dafür an anderer Stelle des Moleküls eine Doppelbindung oder ein Ringschluss entsteht. Aufgrund des schnellen Erreichens des chemischen Gleichgewichtes lassen sich die einzelnen Tautomere dabei allerdings meist nicht separat isolieren.




Stereoisomere haben grundsätzlich die gleiche Struktur (Konstitution) – und damit auch die gleiche Summenformel –, unterscheiden sich aber durch die räumliche Anordnung (Konfiguration) der Atome.
Konfigurationsisomere sind Stereoisomere, jedoch ohne Berücksichtigung der Konformation.
Ein wichtiger Fall sind Enantiomere, Konfigurationsisomere, die sich wie Bild und Spiegelbild zueinander verhalten, aber keine Symmetrieebene innerhalb des Moleküls aufweisen. Enantiomere unterscheiden sich deshalb in allen Stereozentren (Atome, die aufgrund von vier unterschiedlichen Substituenten unter diesen zwei verschiedene Reihenfolgen erlauben). Wichtige Beispiele sind Zucker, Aminosäuren und viele chirale Arzneistoffe. Früher verwendete man auch den Begriff der optischen Isomere, angelehnt an die optische Aktivität enantiomerenreiner Verbindungen.[2]
Alle Konfigurationsisomere, die keine Enantiomere sind, bezeichnet man als Diastereomere. Diastereoisomere unterteilen sich wie folgt:
Berechnung der maximalen Anzahl an Stereoisomeren eines Moleküls: 2n bei n Chiralitätszentren. Wenn meso-Formen vorhanden sind, verringert sich die Anzahl der Isomere jeweils pro meso-Form um eins.
Bsp: Cyclohexan mit je einem unterschiedlichen Substituenten an jedem der sechs Kohlenstoffatome des Rings hat sechs Stereozentren, also gibt es maximal 26 = 64 Stereoisomere.
Im Zusammenhang mit Stereoisomeren tritt oft optische Aktivität auf, d. h., Enantiomere drehen die Ebene von linear polarisiertem Licht um den gleichen Betrag in entgegengesetzte Richtungen.
Allen bisher genannten Konfigurationsisomeren ist gemeinsam, dass ein Isomer nur durch Bindungsbruch in eine andere Form überführt werden kann. Das trifft auf die letzte Gruppe von Isomeren nicht zu: Konformationsisomere (Konformere) sind Stereoisomere, die sich schon durch die Drehung von Einfachbindungen ineinander überführen lassen. Daher wird häufig auch von Rotameren gesprochen. Die thermische Energie bei Raumtemperatur reicht für die Überführung meist aus. Ein Beispiel ist das ekliptische (verdeckte) und das gestaffelte Ethan (gut sichtbar in der Newman-Projektion). Die beiden Gruppen des Ethans können im Prinzip in jedem beliebigen Winkel zueinander stehen, wobei die Energiedifferenz geringer als die thermische Energie ist, so dass in einer Lösung die isomeren Formen kontinuierlich ineinander übergehen und sich normalerweise nicht isolieren lassen. Ein Sonderfall ist die Atropisomerie, bei der eine axiale Chiralität auftritt.
Der Begriff der Mesomerie gehört trotz der sprachlichen Ähnlichkeit nicht in diesen Themenbereich.
Die folgende Tabelle gibt eine kurze Übersicht über die wichtigsten Formen der Isomerie:
| Isomere | Gemeinsamkeiten | Unterschiede | Unterschiedliche chemische und physikalische Eigenschaften | Überführung ohne Bindungsbruch möglich | ||
|---|---|---|---|---|---|---|
| Konstitutionsisomere | Summenformel | Struktur | ja | nein | ||
| Stereoisomere | Konfigurationsisomere | Diastereomere | Summenformel + Struktur |
räumliche Anordnung | ja | nein |
| Enantiomere | räumliche Anordnung, aber wie Bild und Spiegelbild | optisch aktiv, chemische Unterschiede nur bei chiralen Reaktionspartnern (z. B. Enzymen) | nein | |||
| Konformationsisomere | räumliche Stellung | nein | ja | |||
Auch in der Komplexchemie gibt es eine Reihe sehr unterschiedlicher Formen der Isomerie, aber alle Formen lassen sich wieder in zwei große Gruppen einteilen, die Konstitutionsisomere und die Stereoisomere.
Bindungsisomerie tritt dann auf, wenn ein Ligand über mehrere verschiedene seiner Atome mit dem Zentralatom verbunden werden kann. So unterscheiden sich Nitrokomplexe oder Nitritokomplexe:

Analoges gilt für Cyanate (–OCN) und Isocyanate (–NCO) sowie für Thiocyanate (–SCN) und Isothiocyanate (–NCS).
Bei Komplexen, durch Auswechseln eines Liganden in der Koordinationssphäre mit einem gebundenen Ion, z. B.
Hydratationsisomerie ist ein Spezialfall der Ionisationsisomerie, bei dem Wassermoleküle als Liganden beteiligt sind. Die Teilchen in eckigen Klammern bilden den Komplex; die Chloridionen außerhalb der eckigen Klammern sind nur ionisch gebunden:
Liegen in einem Komplex sowohl Anion als auch Kation als Komplexe vor, können die Liganden von Zentralatom 1 mit denen von Zentralatom 2 vertauscht werden.
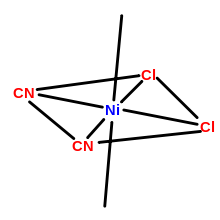
Analog zur Stereoisomerie bei organischen Molekülen unterscheidet man Komplexe, die zwar eine gleiche Zusammensetzung, aber einen anderen räumlichen Aufbau haben. Je nach Geometrie des Komplexes kann es zu unterschiedlichen Ausprägungen der Stereoisomerie kommen. Analog zur Diastereomerie in der organischen Chemie ist die cis-trans-Isomerie definiert. Sie tritt beispielsweise bei planar-quadratischen oder oktaedrischen Komplexen, aber nicht bei tetraedrischen Komplexen auf.
 |
 |
 |
Liegen drei gleiche Liganden in einem oktaedrischen Komplex vor, kann zwischen fac(ialen)- und mer(idionalen)-Isomeren unterschieden werden.
 |
 |
Wenn keine Drehspiegelachse im Molekül vorhanden ist, so tritt natürlich auch Enantiomerie auf. Im Gegensatz zur organischen Chemie (4 verschiedene Substituenten am Kohlenstoff) gibt es keine einfache Regel, wann das der Fall ist, außer der Komplex ist tetraedrisch koordiniert. Das liegt daran, dass Koordinationen > 4 und Chelatkomplexe auftreten können. So ist z. B. cis-[Co(Br)2(en)2] optisch aktiv, die trans-Form dagegen nicht.
In der Medizin kann der Stereoisomerie von Arzneistoffen eine erhebliche Bedeutung zukommen. Zahlreiche Arzneistoffe enthalten mindestens ein Stereozentrum. Die unterschiedlichen Enantiomere (bei mehreren Stereozentren Isomere) können unterschiedliche pharmakodynamische und pharmakokinetische Eigenschaften besitzen; im Hinblick auf die Pharmakodynamik ist dies insbesondere davon abhängig, ob sich das Stereozentrum in einem für die Wirkstoff-Rezeptor-Interaktion relevanten Bereich des Arzneistoffmoleküls befindet. Ist dies der Fall, dann ist sehr oft – jedoch nicht immer – nur eines der Enantiomere für die erwünschten Wirkungen verantwortlich; dieses wird auch als Eutomer bezeichnet. Das andere Enantiomer (das Distomer) kann zur Hauptwirkung beitragen, unwirksam, im ungünstigen Fall aber auch schädlich oder toxisch sein. Im letzten Fall kann das Distomer als 50%ige Verunreinigung des Wirkstoffs aufgefasst werden.[5][6]
Thalidomid, der Wirkstoff von Contergan ist eine chirale Verbindung, die als Racemat verkauft wurde. Die sedierende Wirkung kommt dem (+)-(R)-Enantiomer zu,[7] die fruchtschädigende Wirkung wird dem (−)-(S)-Enantiomer zugeschrieben.
Der Arzneistoff Methylphenidat besitzt zwei Stereozentren. Es gibt also vier Konfigurationsisomere: (2R,2′R)-Form, (2S,2′S)-Form, (2R,2′S)-Form und die (2S,2′R)-Form. Bei der Synthese entstehen die (2R,2′R)-Form und die (2S,2′S)-Form als Racemat in gleicher Menge. Weiterhin wird bei der Synthese das Racemat aus der (2R,2′S)-Form und der (2S,2′R)-Form gebildet. Arzneilich verwendet wird das Racemat der threo-Form, das (2RS,2′RS)-Methylphenidat, wenngleich aus grundsätzlichen Überlegungen die Verwendung eines besser bzw. nebenwirkungsärmer wirksamen Enantiomers zu bevorzugen wäre.[5] Die pharmakologische Wirkung ist hauptsächlich auf die D-(+)-Form zurückzuführen [D-(+)-Methylphenidat, D-threo-Methylphenidat, d-TMP, (2R,2′R)-Methylphenidat].

Das in den USA und in der Schweiz[8] zugelassene Focalin® enthält ausschließlich das (2R,2′R)-Methylphenidat-Stereoisomer und wirkt daher bereits in niedrigerer Dosierung.
Bei der klassischen chemischen Synthese wird in der Regel ein Racemat erzeugt, d. h., beide Enantiomere liegen zu gleichen Anteilen vor. Sofern ein enantiomerenreines Endprodukt gewünscht wird, muss daher eine asymmetrische Synthesestrategie verfolgt werden. Die Enantiomerentrennung racemischer Wirkstoffe durch Racematspaltung kann ebenso genutzt werden, um enantiomerenreine Arzneistoffe zu gewinnen. Mit Hilfe der Gentechnik oder durch Fermentation erzeugte pharmazeutische Wirkstoffe sind fast immer enantiomerenrein. Alternativ können Arzneistoffe auch aus Naturstoffen (dem chiralen Pool) isoliert werden, wobei in der Regel ebenfalls enantiomerenreine Produkte erhalten werden.
Die Isomerie wurde in den 1820er Jahren entdeckt. Das erste Beispiel dafür war die Isomerie von Silbercyanat (AgOCN) mit Silberfulminat (AgONC). Silbercyanat war 1822 von Justus Liebig (zusammen mit Joseph Louis Gay-Lussac) analysiert worden, Silberfulminat 1823 von Jöns Jakob Berzelius. Zunächst kam es zu einem Streit über die Richtigkeit der Analysen. Nachdem weitere Beispiele unterschiedlicher Substanzen mit gleicher prozentualer Zusammensetzung gefunden worden waren, z. B. Ammoniumcyanat und Harnstoff, wurde schließlich – zunächst von Gay-Lussac – anerkannt, dass verschiedene Stoffe dieselbe quantitative Zusammensetzung haben können. Berzelius, der 1832 für Trauben- und Weinsäure die gleiche elementare Zusammensetzung feststellte, prägte dafür den Begriff Isomerie.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.